Alkany - Alkane

W chemii organicznej , w alkano- lub parafiny (historyczne trywialne nazwa który również innych znaczeń ), jest acykliczny nasycony węglowodór . Innymi słowy, alkan składa się z atomów wodoru i węgla ułożonych w strukturę drzewa , w której wszystkie wiązania węgiel-węgiel są pojedyncze . Alkany mają ogólny wzór chemiczny C n H 2 n +2 . Alkany różnią się złożonością od najprostszego przypadku metanu (CH 4 ), gdzie n = 1 (czasami nazywanego cząsteczką macierzystą), do dowolnie dużych i złożonych cząsteczek, takich jak pentakontan (C 50 H 102 ) lub 6-etylo-2- metylo-5- (1-metyloetylo) oktan, izomer o tetradekanie (C 14 H 30 ).
Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) określa alkany „acykliczne węglowodory rozgałęzione lub nierozgałęzione o wzorze ogólnym C, n H 2 n +2 i dlatego składający się wyłącznie z atomów wodoru i nasyconych atomów węgla.” Jednak niektóre źródła używają określenia na określenie jakiegokolwiek nasycony węglowodór, w tym te, które są albo monocykliczny (tj cykloalkany ) lub policykliczna, mimo ich wyraźnego o wzorze ogólnym (tj cykloalkany, takie jak C, N H 2 N ).
W alkanie każdy atom węgla jest zhybrydyzowany sp 3 z 4 wiązaniami sigma (C–C lub C–H ), a każdy atom wodoru jest połączony z jednym z atomów węgla (w wiązaniu C–H). Najdłuższa seria połączonych atomów węgla w cząsteczce jest znana jako szkielet węglowy lub szkielet węglowy. Liczbę atomów węgla można uznać za wielkość alkanu.
Jedną z grup wyższych alkanów są woski , ciała stałe o standardowej temperaturze i ciśnieniu otoczenia (SATP), dla których liczba atomów węgla w szkielecie węgla jest większa niż około 17. Alkany z powtarzającymi się jednostkami –CH 2 stanowią alkany homologiczne. szereg związków organicznych, w których człony różnią się masą cząsteczkową o wielokrotność 14,03 u (całkowita masa każdej takiej jednostki mostka metylenowego , składającego się z jednego atomu węgla o masie 12,01 u i dwóch atomów wodoru o masie ~1,01 u każdy) .
Metan jest wytwarzany przez bakterie metanogenne, a niektóre długołańcuchowe alkany działają jako feromony u niektórych gatunków zwierząt lub jako woski ochronne w roślinach i grzybach. Niemniej jednak większość alkanów nie wykazuje dużej aktywności biologicznej . Można je postrzegać jako drzewa molekularne, na których można zawiesić bardziej aktywne/reaktywne grupy funkcyjne cząsteczek biologicznych.
Alkany mają dwa główne źródła handlowe: ropa naftowa (ropa naftowa) i gaz ziemny .
Grupa alkilowa to fragment cząsteczki oparty na alkanie, który ma jedną otwartą wartościowość wiązania. Zazwyczaj są one skracane za pomocą symbolu dowolnej grupy organylowej, R, chociaż Alk jest czasami używany do specyficznego symbolizowania grupy alkilowej (w przeciwieństwie do grupy alkenylowej lub arylowej).
Struktura i klasyfikacja
Zwykle odległość pojedynczego wiązania CC wynosi 1,53 Å. Węglowodory nasycone mogą być liniowe, rozgałęzione lub cykliczne . Trzecia grupa jest czasami nazywana cykloalkanami . Bardzo skomplikowane struktury są możliwe dzięki połączeniu alkanów liniowych, rozgałęzionych, cyklicznych.
Izomeria
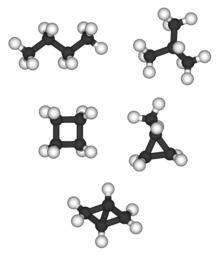
Bicyklo [1.1.0] butan jest jedynym C 4 H 6 alkanu i ma izomer alkanu; tetrahedrane (poniżej) jest jedynym C 4 H 4 alkan, więc nie ma alkan izomerem.
Alkany zawierające więcej niż trzy atomy węgla mogą być ułożone na różne sposoby, tworząc izomery strukturalne . Najprostszym izomerem alkanu jest ten, w którym atomy węgla są ułożone w pojedynczy łańcuch bez rozgałęzień. Ten izomer jest czasami nazywany izomerem n ( n dla „normalnego”, chociaż niekoniecznie jest to najczęstszy). Jednak łańcuch atomów węgla może być również rozgałęziony w jednym lub kilku punktach. Liczba możliwych izomerów szybko rośnie wraz z liczbą atomów węgla. Na przykład dla alkanów acyklicznych:
- C 1 : tylko metan
- C 2 : tylko etan
- C 3 : tylko propan
- C 4 : 2 izomery butanu i izobutanu
- Izomery C 5 :3: pentan , izopentan i neopentan
- C 6 : 5 izomery: heksan , 2-metylopentan , 3-metylopentan , 2,2-dimetylobutan , i 2,3-dimetylobutan
- Izomery C 7 : 9: heptan , metyloheksan (2 izomery), dimetylopentan (4 izomery), 3-etylopentan , 2,2,3-trimetylobutan
- C, 8 : 18 izomery oktan , 2-methylheptane , 3-methylheptane , 2,3-dimetyloheksan , 3,4-dimetyloheksan , 2,3,4-trimetylopentan , 3,3-dimetyloheksan , 2,2-trimetylopentan , 2, 4-dimetyloheksan , 2,2,4-trimetylopentan , 2,3,3-trimetylopentan , 3,3,4-trimetylopentan , 3,4,4-trimetylopentan , 2,4,4-trimetylopentan , (5 izomerów)
- C 9 : 35 izomerów
- C 10 : 75 izomerów
- C 12 : 355 izomerów
- C 32 : 27 711 253 769 izomerów
- C 60 : 22 158 734 535 770 411 074 184 izomery, z których wiele nie jest stabilnych.
Alkany rozgałęzione mogą być chiralne . Na przykład 3-metyloheksan i jego wyższe homologi są chiralne ze względu na ich centrum stereogeniczne przy atomie węgla 3. Powyższa lista zawiera tylko różnice w łączności, a nie stereochemię. Oprócz izomerów alkanu łańcuch atomów węgla może tworzyć jeden lub więcej pierścieni. Takie związki nazywane są cykloalkanami i są również wyłączone z powyższej listy, ponieważ zmiana liczby pierścieni zmienia wzór cząsteczkowy . Na przykład, cyklobutan i metylocyklopropano izomery od siebie (C 4 H 8 ), lecz nie są izomery butanu, (C 4 H 10 ).
Nomenklatura
IUPAC (systematyczny sposób nazywania związków) do alkanów jest oparty na identyfikacji łańcuchów węglowodorowych. Nierozgałęzione, nasycone łańcuchy węglowodorowe są systematycznie nazywane z greckim przedrostkiem liczbowym oznaczającym liczbę węgli i przyrostkiem „-ane”.
W 1866 roku August Wilhelm von Hofmann zasugerował usystematyzowanie nomenklatury poprzez użycie całej sekwencji samogłosek a, e, i, o oraz u do stworzenia sufiksów -ane, -ene, -ine (lub -yne), -one, -une, dla te węglowodory C n H 2 n + 2 , C n H 2 n , C n H 2 n -2 , C n H 2 n -4 , C n H 2 n -6 . We współczesnej nomenklaturze pierwsze trzy konkretnie nazywają węglowodory z wiązaniami pojedynczymi, podwójnymi i potrójnymi; podczas gdy "-one" reprezentuje teraz keton .
Alkany liniowe
Alkany o prostym łańcuchu są czasami oznaczone przedrostkiem „n-” lub „ n -”(dla „normalnego”), gdy istnieje nieliniowy izomer . Chociaż nie jest to bezwzględnie konieczne i nie jest częścią systemu nazewnictwa IUPAC, użycie jest nadal powszechne w przypadkach, gdy chcemy podkreślić lub rozróżnić izomery o łańcuchu prostym i rozgałęzionym, np. „ n- butan ” zamiast po prostu „butan”, aby odróżnić go od izobutanu . Alternatywne nazwy dla tej grupy stosowane w przemyśle naftowym to parafiny liniowe lub n- parafiny .
Sześć pierwszych członków serii (pod względem liczby atomów węgla) nosi następujące nazwy:
- metan
- CH 4 – jeden węgiel i 4 wodór
- etan
- C 2 H 6 – dwa węgiel i 6 wodór
- propan
- C 3 H 8 – trzy węgiel i 8 wodór
- butan
- C 4 H 10 – cztery węgiel i 10 wodór
- pentan
- C 5 H 12 – pięć węgla i 12 wodór
- heksan
- C 6 H 14 – sześć węgla i 14 wodór
Pierwsze cztery nazwy pochodzą od metanolu , eteru , kwasu propionowego i kwasu masłowego . Alkany z pięcioma lub więcej atomami węgla są nazywane przez dodanie przyrostka -ane do odpowiedniego przedrostka mnożnika liczbowego z usunięciem dowolnej końcowej samogłoski ( -a lub -o ) z podstawowego terminu liczbowego. Stąd, pentan , C 5 H 12 ; heksan , C 6 H 14 ; heptan , C 7 H 16 ; oktan , C 8 H 18 ; itd. Przedrostek liczbowy jest na ogół grecki, jednak alkany z liczbą atomów węgla kończącą się na dziewięć, na przykład nonane , używają przedrostka łacińskiego non- . Aby uzyskać pełniejszą listę, zobacz listę alkanów o prostym łańcuchu .
Alkany rozgałęzione
Proste rozgałęzione alkany często mają wspólną nazwę z przedrostkiem, aby odróżnić je od alkanów liniowych, na przykład n- pentan , izopentan i neopentan .
Do utworzenia nazwy systematycznej można użyć konwencji nazewnictwa IUPAC.
Kluczowe kroki w nazewnictwie bardziej skomplikowanych rozgałęzionych alkanów są następujące:
- Zidentyfikuj najdłuższy ciągły łańcuch atomów węgla
- Nazwij ten najdłuższy łańcuch główny, używając standardowych reguł nazewnictwa
- Nazwij każdy łańcuch boczny, zmieniając sufiks nazwy alkanu z „-ane” na „-yl”
- Ponumeruj najdłuższy ciągły łańcuch, aby uzyskać możliwie najniższe liczby dla łańcuchów bocznych
- Ponumeruj i nazwij łańcuchy boczne przed nazwą łańcucha głównego
- Jeśli istnieje wiele łańcuchów bocznych tego samego typu, użyj przedrostków, takich jak „di-” i „tri-”, aby wskazać go jako taki i ponumeruj każdy z nich.
- Dodaj nazwy łańcuchów bocznych w kolejności alfabetycznej (bez względu na przedrostki "di-" itp.) przed nazwą łańcucha głównego
| Nazwa zwyczajowa | n -pentan | izopentan | neopentan |
|---|---|---|---|
| Nazwa IUPAC | pentan | 2-metylobutan | 2,2-dimetylopropan |
| Struktura |  |

|
Nasycone węglowodory cykliczne
Chociaż technicznie różni się od alkanów, ta klasa węglowodorów jest określana przez niektórych jako „cykliczne alkany”. Jak sugeruje ich opis, zawierają one jeden lub więcej pierścieni.
Proste cykloalkany mają przedrostek „cyklo-”, aby odróżnić je od alkanów. Cykloalkany, są nazywane zgodnie z ich niecyklicznych odpowiedników w odniesieniu do liczby atomów węgla w ich trzony, na przykład cyklopentan (C 5 H 10 ) jest cykloalkan o 5 atomach węgla, tak jak pentan (C 5 H 12 ), lecz są połączone w pięcioczłonowym pierścieniu. W podobny sposób propan i cyklopropan , butan i cyklobutan itp.
Podstawione cykloalkany są nazywane podobnie do podstawionych alkanów – podany jest pierścień cykloalkanowy, a podstawniki są zgodne z ich pozycją na pierścieniu, z numeracją określoną według zasad pierwszeństwa Cahna-Ingolda-Preloga .
Nazwy trywialne/pospolite
Trywialna ( niesystematyczna ) nazwa alkanów to „parafiny”. Razem alkany są znane jako „seria parafinowa”. Trywialne nazwy związków są zazwyczaj artefaktami historycznymi. Zostały one ukute przed opracowaniem systematycznych nazw i zostały zachowane ze względu na znane zastosowanie w przemyśle. Cykloalkany są również nazywane naftenami.
Alkany o rozgałęzionych łańcuchach nazywane są izoparafinami . „Parafina” jest terminem ogólnym i często nie rozróżnia czystych związków i mieszanin izomerów , tj. związków o tym samym wzorze chemicznym , np. pentanu i izopentanu .
- W IUPAC
Następujące nazwy zwyczajowe są zachowywane w systemie IUPAC:
- Nie-IUPAC
Niektóre trywialne nazwy spoza IUPAC są czasami używane:
- cetan, dla heksadekanu
- cerane, dla heksakozanu
Właściwości fizyczne
Wszystkie alkany są bezbarwne. Alkany o najniższych masach cząsteczkowych to gazy, te o średniej masie cząsteczkowej to ciecze, a najcięższe to woskowate ciała stałe.
Tabela alkanów
| Alkany | Formuła | Temperatura wrzenia [°C] | Temperatura topnienia [°C] | Gęstość [kg/m 3 ] (przy 20 °C ) | Izomery |
| Metan | CH 4 | -162 | −182 | 0,656 (gaz) | 1 |
| Etan | C, 2 H 6 | −89 | −183 | 1,26 (gaz) | 1 |
| Propan | C 3 H 8 | −42 | −188 | 2.01 (gaz) | 1 |
| Butan | C 4 H 10 | 0 | -138 | 2,48 (gaz) | 2 |
| Pentan | C 5 H 12 | 36 | −130 | 626 (ciecz) | 3 |
| Heksan | C 6 H 14 | 69 | −95 | 659 (ciecz) | 5 |
| Heptan | C 7 H 16 | 98 | −91 | 684 (ciecz) | 9 |
| Oktan | C 8 H 18 | 126 | −57 | 703 (ciecz) | 18 |
| Nonane | C 9 H 20 | 151 | −54 | 718 (ciecz) | 35 |
| Dekan | C 10 H 22 | 174 | -30 | 730 (ciecz) | 75 |
| Undekane | C 11 H 24 | 196 | −26 | 740 (płyn) | 159 |
| Dodekan | C 12 H 26 | 216 | -10 | 749 (płyn) | 355 |
| Tridekan | C 13 H 28 | 235 | -5,4 | 756 (ciecz) | 802 |
| Tetradekan | C 14 H 30 | 253 | 5,9 | 763 (ciecz) | 1858 |
| Pentadekan | C 15 H 32 | 270 | 10 | 769 (ciecz) | |
| Heksadekan | C 16 H 34 | 287 | 18 | 773 (ciecz) | |
| Heptadekan | C 17 H 36 | 303 | 22 | 777 (stały) | |
| Oktadekan | C 18 H 38 | 317 | 28 | 781 (stały) | |
| Nonadekan | C 19 H 40 | 330 | 32 | 785 (stały) | |
| Ikozan | C 20 H 42 | 343 | 37 | 789 (stały) | |
| Triakontan | C 30 H 62 | 450 | 66 | 810 (stały) | |
| Tetrakontan | C 40 H 82 | 525 | 82 | 817 (stały) | |
| Pentakontan | C 50 H 102 | 575 | 91 | 824 (stały) | |
| Heksakontan | C 60 H 122 | 625 | 100 | 829 (stały) | |
| Heptakontan | C 70 H 142 | 653 | 109 | 869 (stały) |
Temperatura wrzenia
Alkany doświadczają międzycząsteczkowych sił van der Waalsa . Silniejsze międzycząsteczkowe siły van der Waalsa prowadzą do wyższych temperatur wrzenia alkanów.
Istnieją dwa wyznaczniki siły sił van der Waalsa:
- liczba elektronów otaczających cząsteczkę , która wzrasta wraz z masą cząsteczkową alkanu
- pole powierzchni cząsteczki
Pod standardowych warunkach , z chlorkiem 4 do C 4 H 10 alkany są gazami; z C 5 H 12 do C 17 H 36 są cieczami; C i po 18 H 38 są one ciałami stałymi. Ponieważ temperatura wrzenia alkanów jest określana przede wszystkim wagowo, nie powinno dziwić, że temperatura wrzenia ma prawie liniowy związek z wielkością ( masą cząsteczkową ) cząsteczki. Z reguły temperatura wrzenia wzrasta o 20–30 °C dla każdego węgla dodanego do łańcucha; zasada ta dotyczy innych serii homologicznych.
Alkan o prostym łańcuchu będzie miał wyższą temperaturę wrzenia niż alkan o rozgałęzionym łańcuchu ze względu na większą powierzchnię w kontakcie, a tym samym większe siły van der Waalsa między sąsiednimi cząsteczkami. Na przykład porównaj izobutan (2-metylopropan) i n-butan (butan), które wrze w temperaturze -12 i 0 °C oraz 2,2-dimetylobutan i 2,3-dimetylobutan, które wrze odpowiednio w 50 i 58 °C .
Z drugiej strony, cykloalkany mają tendencję do wyższych temperatur wrzenia niż ich liniowe odpowiedniki ze względu na zablokowane konformacje cząsteczek, które dają płaszczyznę kontaktu międzycząsteczkowego.
Temperatury topnienia
Temperatury topnienia alkanów mają podobny trend do temperatur wrzenia z tego samego powodu, jak opisano powyżej. Oznacza to, że (wszystkie inne czynniki są równe) im większa cząsteczka, tym wyższa temperatura topnienia. Istnieje jedna znacząca różnica między temperaturami wrzenia a temperaturami topnienia. Ciała stałe mają bardziej sztywną i stałą strukturę niż ciecze. Ta sztywna struktura wymaga energii do rozbicia. Tak więc lepiej poskładane solidne konstrukcje będą wymagały więcej energii, aby się rozerwać. W przypadku alkanów widać to na powyższym wykresie (tj. niebieska linia). Alkany o numerach nieparzystych mają niższy trend w zakresie temperatur topnienia niż alkany o numerach parzystych. Dzieje się tak, ponieważ alkany parzyste dobrze pakują się w fazie stałej, tworząc dobrze zorganizowaną strukturę, która wymaga więcej energii do rozbicia. Alkany o numerach nieparzystych pakują się gorzej, więc „luźniejsza” zorganizowana, solidna struktura upakowania wymaga mniej energii do rozerwania. Wizualizację struktur krystalicznych zob.
Temperatury topnienia alkanów o rozgałęzionym łańcuchu mogą być wyższe lub niższe niż dla odpowiednich alkanów o łańcuchu prostym, ponownie w zależności od zdolności danego alkanu do dobrego upakowania w fazie stałej.
Przewodność i rozpuszczalność
Alkany w żaden sposób nie przewodzą elektryczności ani nie są zasadniczo spolaryzowane przez pole elektryczne . Z tego powodu nie tworzą wiązań wodorowych i są nierozpuszczalne w rozpuszczalnikach polarnych, takich jak woda. Ponieważ wiązania wodorowe między poszczególnymi cząsteczkami wody są ustawione z dala od cząsteczki alkanu, współistnienie alkanu i wody prowadzi do zwiększenia porządku molekularnego (zmniejszenia entropii ). Ponieważ nie ma znaczącego wiązania między cząsteczkami wody a cząsteczkami alkanu, druga zasada termodynamiki sugeruje, że to zmniejszenie entropii należy zminimalizować poprzez zminimalizowanie kontaktu między alkanem a wodą: mówi się, że alkany są hydrofobowe, ponieważ są nierozpuszczalne w wodzie.
Ich rozpuszczalność w niepolarnych rozpuszczalnikach jest stosunkowo wysoka, właściwość ta nazywa się lipofilnością . Na przykład alkany mieszają się ze sobą we wszystkich proporcjach.
Gęstość alkanów zwykle wzrasta wraz z liczbą atomów węgla, ale pozostaje mniejsza niż wody. Stąd alkany tworzą górną warstwę w mieszaninie alkano-woda.
Geometria molekularna

Struktura molekularna alkanów bezpośrednio wpływa na ich właściwości fizyczne i chemiczne. Wywodzi się z konfiguracji elektronowej z węgla , który ma cztery elektronów wartościowości . Atomy węgla w alkanach są opisane jako hybrydy sp 3 , to znaczy, z dobrym przybliżeniem, elektrony walencyjne znajdują się na orbitalach skierowanych w kierunku narożników czworościanu, które pochodzą z kombinacji orbitalu 2s i trzech 2p orbitale. Geometrycznie kąt między wiązaniami wynosi cos -1 (-1/3) ≈ 109,47°. Jest to dokładne w przypadku metanu, podczas gdy większe alkany zawierające kombinację wiązań C-H i C-C zwykle mają wiązania, które mieszczą się w kilku stopniach tej wyidealizowanej wartości.
Długości wiązania i kąty wiązania
Alkan ma tylko pojedyncze wiązania C-H i C-C. Te pierwsze wynikają z nakładania się orbitalu sp 3 węgla z orbitalem 1s wodoru; ten ostatni przez nakładanie się dwóch orbitali sp 3 na sąsiednich atomach węgla. Długości wiązań wynoszą 1,09 x 10 -10 m dla wiązania C-H i 1,54 x 10 -10 M wiązaniem C-C.
Przestrzenny układ wiązań jest podobny do układu czterech orbitali sp 3 – są one ułożone czworościennie pod kątem 109,47° między nimi. Wzory strukturalne, które przedstawiają wiązania jako prostopadłe do siebie, choć zarówno powszechne, jak i użyteczne, nie oddają dokładnie geometrii.
Struktura
Wzór strukturalny i kąty wiązania zwykle nie wystarczają do pełnego opisania geometrii cząsteczki. Istnieje dodatkowy stopień swobody dla każdego wiązania węgiel-węgiel: kąt skręcania między atomami lub grupami związanymi z atomami na każdym końcu wiązania. Przestrzenny układ opisany przez kąty torsyjne cząsteczki jest znany jako jej konformacja .

Etan stanowi najprostszy przypadek do badania konformacji alkanów, ponieważ istnieje tylko jedno wiązanie C–C. Jeśli spojrzymy w dół osi wiązania C–C, zobaczymy tzw. projekcję Newmana . Atomy wodoru na przednim i tylnym atomie węgla mają między sobą kąt 120°, wynikający z rzutu podstawy czworościanu na płaską płaszczyznę. Jednak kąt skręcania pomiędzy danym atomem wodoru przyłączonym do przedniego węgla i danym atomem wodoru przyłączonym do tylnego węgla może zmieniać się swobodnie w zakresie od 0° do 360°. Jest to konsekwencją swobodnej rotacji wokół pojedynczego wiązania węgiel-węgiel. Pomimo tej pozornej swobody, ważne są tylko dwie konformacje ograniczające: konformacja zaćmiona i konformacja przesunięta .
Obie konformacje różnią się energią: konformacja przesunięta ma 12,6 kJ/mol (3,0 kcal/mol) mniej energii (bardziej stabilna) niż konformacja zaćmiona (najmniej stabilna).
Ta różnica energii między dwiema konformacjami, znana jako energia skręcania , jest niska w porównaniu z energią cieplną cząsteczki etanu w temperaturze otoczenia. Istnieje stała rotacja wokół wiązania C–C. Czas potrzebny na etan cząsteczki przechodzą z jednej rozłożone konformacji do drugiej, co odpowiada rotacji jednego CH 3, grupę o 120 ° w stosunku do drugiego, jest rzędu 10 -11 sekund.
Przypadek wyższych alkanów jest bardziej złożony, ale oparty na podobnych zasadach, przy czym konformacja antyperiplanarna zawsze jest najbardziej uprzywilejowana wokół każdego wiązania węgiel-węgiel. Z tego powodu alkany są zwykle pokazywane w układzie zygzakowatym na schematach lub w modelach. Rzeczywista struktura zawsze będzie się nieco różnić od tych wyidealizowanych form, ponieważ różnice w energii między konformacjami są małe w porównaniu z energią cieplną cząsteczek: Cząsteczki alkanu nie mają ustalonej formy strukturalnej, cokolwiek mogą sugerować modele.
Właściwości spektroskopowe
Praktycznie wszystkie związki organiczne zawierają wiązania węgiel-węgiel i węgiel-wodór, a więc wykazują niektóre cechy alkanów w swoich widmach. Alkany wyróżniają się brakiem innych grup, a zatem brakiem innych charakterystycznych cech spektroskopowych grupy funkcyjnej, takich jak –OH , –CHO , –COOH itp.
Spektroskopia w podczerwieni
Tryb rozciągania węgiel-wodór daje silną absorpcję między 2850 a 2960 cm- 1 , podczas gdy tryb rozciągania węgiel-węgiel absorbuje od 800 do 1300 cm- 1 . Tryby zginania węgiel-wodór zależą od natury grupy: grupy metylowe wykazują pasma przy 1450 cm- 1 i 1375 cm- 1 , podczas gdy grupy metylenowe wykazują pasma przy 1465 cm- 1 i 1450 cm- 1 . Łańcuchy węglowe z więcej niż czterema atomami węgla wykazują słabą absorpcję przy około 725 cm- 1 .
Spektroskopia NMR
Rezonanse protonowe alkanów zwykle występują przy δ H = 0,5–1,5. Rezonanse węgla-13 zależą od liczby atomów wodoru przyłączonych do węgla: δ C = 8–30 (pierwotny, metyl, –CH 3 ), 15–55 (wtórny, metylen, –CH 2 –), 20–60 (trzeciorzędowy, metynowy, C–H) i czwartorzędowy. Rezonans węgla-13 czwartorzędowych atomów węgla jest charakterystycznie słaby, ze względu na brak jądrowego efektu Overhausera i długi czas relaksacji i może być pominięty w słabych próbkach lub próbkach, które nie były badane przez wystarczająco długi czas.
Spekrtometria masy
Alkany mają wysoką energię jonizacji , a jon cząsteczkowy jest zwykle słaby. Wzór fragmentacji może być trudny do interpretacji, ale w przypadku alkanów o rozgałęzionym łańcuchu, łańcuch węglowy jest preferencyjnie rozszczepiany na węglach trzeciorzędowych lub czwartorzędowych ze względu na względną stabilność powstałych wolnych rodników . Fragment związana z utratą jednej grupy metylowej ( M - 15) często jest nieobecne, a pozostałe fragmenty są często rozmieszczonych w odstępach czternastu jednostek masowych, odpowiadającej sekwencyjnej utraty CH 2 grupach.
Właściwości chemiczne
Alkany słabo reagują z większością związków chemicznych. W moc kwasu (P K ) wartości wszystkich alkanów ocenia się w zakresie od 50 do 70, w zależności od sposobu ekstrapolacji, a więc są bardzo słabe kwasy, które są praktycznie obojętny w stosunku do zasad (patrz kwasy węglowe ). Są również niezwykle słabymi zasadami, nie ulegającymi zauważalnemu protonowaniu w czystym kwasie siarkowym ( H 0 ~ –12), chociaż wiadomo , że superkwasy, które są co najmniej miliony razy silniejsze, protonują je, dając hiperkoordynacyjne jony alkaniowe (patrz: jon metanu ). . Podobnie wykazują one reaktywność tylko z najsilniejszymi odczynnikami elektrofilowymi (np. dioksiranami i solami zawierającymi kation NF 4 + ). Ze względu na ich silne wiązania C–H (~100 kcal/mol) i wiązania C–C (~90 kcal/mol, ale zwykle mniej dostępne sterycznie), są one również stosunkowo niereaktywne wobec wolnych rodników, chociaż wiele rodników z niedoborem elektronów będzie reagował z alkanami przy braku innych wiązań bogatych w elektrony (patrz poniżej). Ta bezwładność jest źródłem terminu parafiny (w znaczeniu „brak powinowactwa”). W ropie naftowej cząsteczki alkanu pozostają chemicznie niezmienione od milionów lat.
Wolne rodniki , cząsteczki z niesparowanymi elektronami, odgrywają dużą rolę w większości reakcji alkanów, takich jak kraking i reformacja, w których alkany o długim łańcuchu są przekształcane w alkany o krótszych łańcuchach, a alkany o prostym łańcuchu w izomery o rozgałęzionym łańcuchu. Ponadto możliwe są reakcje redoks alkanów z udziałem wolnorodnikowych związków pośrednich, w szczególności z tlenem i halogenami, ponieważ atomy węgla są w stanie silnie zredukowanym; w przypadku metanu węgiel znajduje się na najniższym możliwym stopniu utlenienia (-4). Reakcja z tlenem ( jeśli jest obecny w ilości wystarczającej do zaspokojenia stechiometrii reakcji ) prowadzi do spalania bez jakiegokolwiek dymu, wytwarzając dwutlenek węgla i wodę. Reakcje halogenowania wolnorodnikowego zachodzą z halogenami, prowadząc do produkcji haloalkanów . Ponadto wykazano, że alkany oddziałują i wiążą się z pewnymi kompleksami metali przejściowych w reakcjach aktywacji wiązaniami C–H .
W silnie rozgałęzionych alkanach kąt wiązania może znacznie różnić się od optymalnej wartości (109,5°), aby pomieścić duże grupy. Takie zniekształcenia wprowadzają w cząsteczce napięcie zwane przeszkodą steryczną lub naprężeniem. Szczep znacznie zwiększa reaktywność.
Jednak ogólnie i być może zaskakująco, gdy rozgałęzienia nie są wystarczająco rozległe, aby wywołać wysoce niekorzystne oddziaływania 1,2- i 1,3-alkilo-alkilosteryczne (warte ~3,1 kcal/mol i ~3,7 kcal/mol w przypadku rozgałęzione alkany są w rzeczywistości bardziej stabilne termodynamicznie niż ich liniowe (lub mniej rozgałęzione) izomery. Na przykład silnie rozgałęziony 2,2,3,3-tetrametylobutan jest o około 1,9 kcal/mol bardziej stabilny niż jego liniowy izomer, n- oktan. Ze względu na subtelność tego efektu, dokładne powody tej zasady były energicznie dyskutowane w literaturze chemicznej i są jeszcze nierozstrzygnięte. Jako możliwości wysunięto kilka wyjaśnień, w tym stabilizację rozgałęzionych alkanów przez korelację elektronową, destabilizację liniowych alkanów przez odpychanie steryczne, stabilizację przez obojętną hiperkoniugację i/lub efekty elektrostatyczne. Kontrowersje dotyczą pytania, czy tradycyjne wyjaśnienie hiperkoniugacji jest głównym czynnikiem decydującym o stabilności rodników alkilowych.
Reakcje z tlenem (reakcja spalania)
Wszystkie alkany reagują z tlenem w reakcji spalania , chociaż ich zapłon staje się coraz trudniejszy wraz ze wzrostem liczby atomów węgla. Ogólne równanie całkowitego spalania to:
- C n H 2 n +2 + (3/2n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
- lub C n H 2 n +2 + (3 n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
W przypadku braku wystarczającej ilości tlenu może powstać tlenek węgla, a nawet sadza , jak pokazano poniżej:
Na przykład metan :
- 2 CH 4 + 3 O 2 → 4 H 2 O + 2 CO
- CH 4 + O 2 → 2 H 2 O + C
Szczegółowe dane można znaleźć w tabeli ciepła formowania alkanu . Średnia entalpia spalania , Δ C H ⊖ na alkanów zwiększa się o około 650 kJ / mol i na CH 2 grupy. Alkany o rozgałęzionym łańcuchu mają niższe wartości Δ c H ⊖ niż alkany o łańcuchu prostym o tej samej liczbie atomów węgla, a zatem mogą być postrzegane jako nieco bardziej stabilne.
Reakcje z halogenami
Alkany reagują z halogenami w tak zwanej reakcji halogenowania wolnorodnikowego . Atomy wodoru alkanu są stopniowo zastępowane przez atomy halogenu. Wolne rodniki to reaktywne formy, które biorą udział w reakcji, która zwykle prowadzi do mieszaniny produktów. Reakcja jest silnie egzotermiczna z fluorowcem i może prowadzić do wybuchu.
Reakcje te są ważną drogą przemysłową prowadzącą do chlorowcowanych węglowodorów. Istnieją trzy kroki:
- Inicjacja rodników halogenowych tworzy się przez homolizę . Zwykle potrzebna jest energia w postaci ciepła lub światła.
- Następnie zachodzi reakcja łańcuchowa lub propagacja - rodnik halogenowy odrywa wodór od alkanu, dając rodnik alkilowy. To dalej reaguje.
- Zakończenie łańcucha, w którym rodniki rekombinują.
Eksperymenty wykazały, że wszelkie halogenowanie daje mieszaninę wszystkich możliwych izomerów, co wskazuje, że wszystkie atomy wodoru są podatne na reakcję. Wytworzona mieszanina nie jest jednak mieszaniną statystyczną: drugorzędowe i trzeciorzędowe atomy wodoru są preferencyjnie zastępowane ze względu na większą stabilność drugorzędowych i trzeciorzędowych wolnych rodników. Przykładem może być monobromowanie propanu:
Pękanie
Pękanie rozbija większe cząsteczki na mniejsze. Można to zrobić metodą termiczną lub katalityczną. Proces krakingu termicznego przebiega zgodnie z mechanizmem homolitycznym z powstawaniem wolnych rodników . Proces krakingu katalitycznego obejmuje obecność katalizatorów kwasowych (zwykle stałych kwasów, takich jak krzemionka-tlenek glinu i zeolity ), które sprzyjają heterolitycznemu (asymetrycznemu) zerwaniu wiązań, w wyniku czego powstają pary jonów o przeciwnych ładunkach, zwykle karbokation i bardzo niestabilny anion wodorkowy . Wolne rodniki i kationy zlokalizowane na węglu są zarówno wysoce niestabilne, jak i ulegają procesom przegrupowania łańcucha, rozerwania węgla w pozycji beta (tj. pękania) oraz wewnątrz- i międzycząsteczkowego przeniesienia wodoru lub przeniesienia wodorku . W obu typach procesów, odpowiednie reaktywne produkty pośrednie (rodniki, jony) ulegają trwałej regeneracji, a zatem przebiegają w mechanizmie samopowielającego się łańcucha. Łańcuch reakcji jest ostatecznie zakończony przez rekombinację rodników lub jonów.
Izomeryzacja i reformacja
Dragan i jego kolega jako pierwsi donieśli o izomeryzacji w alkanach. Izomeryzacja i reformacja to procesy, w których prostołańcuchowe alkany są ogrzewane w obecności katalizatora platynowego . W izomeryzacji alkany stają się izomerami rozgałęzionymi. Innymi słowy, nie traci żadnych węgli ani wodorów, zachowując tę samą masę cząsteczkową. Podczas reformacji alkany stają się cykloalkanami lub węglowodorami aromatycznymi , wydzielając wodór jako produkt uboczny. Oba te procesy podnoszą liczbę oktanową substancji. Butan jest najpowszechniejszym alkanem poddawanym procesowi izomeryzacji, ponieważ tworzy wiele rozgałęzionych alkanów o wysokiej liczbie oktanowej.
Inne reakcje
Alkany będą reagować z parą wodną w obecności katalizatora niklowego, dając wodór . Alkany mogą być chlorosulfonowane i nitrowane , chociaż obie reakcje wymagają specjalnych warunków. Fermentacji alkanów do kwasów karboksylowych ma pewne znaczenie techniczne. W reakcji Reed , dwutlenku siarki , chloru i lekkie węglowodory Konwersja na chlorków sulfonylowych . Abstrakcję nukleofilową można wykorzystać do oddzielenia alkanu od metalu. Grupy alkilowe mogą być przenoszone z jednego związku do drugiego w reakcjach transmetalacji . Mieszanina pentafluorku antymonu (SbF 5 ) i kwasu fluorosulfonowego (HSO 3 F), zwanego kwasem magicznym , może protonować alkany.
Występowanie
Występowanie alkanów we Wszechświecie

Alkany tworzą niewielką część atmosfer zewnętrznych planet gazowych, takich jak Jowisz (0,1% metanu, 2 ppm etan), Saturn (0,2% metanu, 5 ppm etan), Uran (1,99% metanu, 2,5 ppm etan) i Neptun ( 1,5% metan, 1,5 ppm etan). Tytan (1,6% metanu), satelita Saturna, został zbadany przez sondę Huygens , która wykazała, że atmosfera Tytana okresowo spływa ciekłym metanem na powierzchnię Księżyca. Również na Tytanie misja Cassini wykonała zdjęcia sezonowych jezior metanu/etanu w pobliżu polarnych regionów Tytana. Metan i etan wykryto również w ogonie komety Hyakutake . Analiza chemiczna wykazała, że obfitość etanu i metanu była w przybliżeniu równa, co sugeruje, że jego lody utworzyły się w przestrzeni międzygwiazdowej, z dala od Słońca, co spowodowałoby odparowanie tych lotnych molekuł. Alkany wykryto również w meteorytach, takich jak chondryty węglowe .
Występowanie alkanów na Ziemi
W atmosferze ziemskiej występują śladowe ilości metanu (około 0,0002% lub 1745 ppb), wytwarzanego głównie przez mikroorganizmy metanogenne , takie jak Archaea w jelitach przeżuwaczy.
Najważniejszymi komercyjnymi źródłami alkanów są gaz ziemny i ropa naftowa . Gaz ziemny zawiera głównie metan i etan, trochę propanu i butanu : olej jest mieszaniną ciekłych alkanów i innych węglowodorów . Węglowodory te powstały, gdy zwierzęta i rośliny morskie (zooplankton i fitoplankton) wymarły i opadły na dno pradawnych mórz i zostały pokryte osadami w beztlenowym środowisku i przekształcone przez wiele milionów lat w wysokich temperaturach i wysokim ciśnieniu do obecnej formy. Gaz ziemny powstał przy tym m.in. z następującej reakcji:
- C 6 H 12 O 6 → 3 CH 4 + 3 CO 2
Te złoża węglowodorów, gromadzone w porowatych skałach uwięzionych pod nieprzepuszczalnymi skałami przykrywkowymi, tworzą komercyjne pola naftowe . Powstawały przez miliony lat i po wyczerpaniu nie można ich łatwo zastąpić. Wyczerpanie się tych zasobów węglowodorów jest podstawą tak zwanego kryzysu energetycznego .
Metan występuje również w tzw. biogazie , wytwarzanym przez zwierzęta i rozkładającej się materii, która jest możliwym odnawialnym źródłem energii .
Alkany mają niską rozpuszczalność w wodzie, więc zawartość w oceanach jest znikoma; jednak pod wysokim ciśnieniem i w niskich temperaturach (takich jak na dnie oceanów) metan może współkrystalizować z wodą, tworząc stały klatrat metanu (hydrat metanu). Chociaż obecnie nie można tego wykorzystać komercyjnie, ilość energii palnej znanych pól klatratu metanu przewyższa zawartość energii wszystkich złóż gazu ziemnego i ropy naftowej razem wziętych. Metan pozyskiwany z klatratu metanu jest zatem kandydatem na przyszłe paliwa.
Zjawisko biologiczne
Alkany acykliczne występują w przyrodzie na różne sposoby.
- Bakterie i archeony

Niektóre typy bakterii mogą metabolizować alkany: preferują łańcuchy węglowe o numerach parzystych, ponieważ są one łatwiejsze do degradacji niż łańcuchy o numerach nieparzystych.
Z drugiej strony, niektóre archeony , metanogeny , produkują duże ilości metanu poprzez metabolizm dwutlenku węgla lub innych utlenionych związków organicznych. Energia jest uwalniana przez utlenianie wodoru :
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
Metanogeny są również producentem gazu bagiennego na terenach podmokłych . Produkcja metanu bydła i innych roślinożerców , które mogą uwalniać od 30 do 50 galonów dziennie, oraz termitów , jest również spowodowana metanogenami. Wytwarzają również ten najprostszy ze wszystkich alkanów w jelitach ludzi. Archeony metanogenne znajdują się zatem pod koniec cyklu węglowego , kiedy węgiel jest uwalniany z powrotem do atmosfery po utrwaleniu w procesie fotosyntezy . Jest prawdopodobne, że w podobny sposób powstały nasze obecne złoża gazu ziemnego.
- Grzyby i rośliny
Alkany odgrywają również niewielką rolę w biologii trzech eukariotycznych grup organizmów: grzybów , roślin i zwierząt. Niektóre wyspecjalizowane drożdże, np. Candida tropicale , Pichia sp., Rhodotorula sp., mogą wykorzystywać alkany jako źródło węgla lub energii. Grzyb Amorphotheca resinae preferuje dłuższe łańcuchy alkanów w paliwie lotniczym i może powodować poważne problemy dla samolotów w regionach tropikalnych.
W roślinach stałe długołańcuchowe alkany znajdują się w naskórku roślin i wosku epikutykularnym wielu gatunków, ale rzadko są głównymi składnikami. Chronią roślinę przed utratą wody, zapobiegają wypłukiwaniu ważnych minerałów przez deszcz, chronią przed bakteriami, grzybami i szkodliwymi owadami. Łańcuchy węglowe w roślinnych alkanach są zwykle nieparzyste, mają długość od 27 do 33 atomów węgla i są wytwarzane przez rośliny przez dekarboksylację parzystych kwasów tłuszczowych . Dokładny skład warstwy wosku zależy nie tylko od gatunku, ale zmienia się również wraz z porą roku i czynnikami środowiskowymi, takimi jak oświetlenie, temperatura czy wilgotność.
Bardziej lotne krótkołańcuchowe alkany są również wytwarzane i znajdowane w tkankach roślinnych. Jeffrey sosna zauważyć wytwarzania niezwykle wysokich poziomów n - heptanu w jego żywicy, w związku z czym jego Destylat wyznaczony jako punkt zerowy dla jednego oktanowej . Od dawna wiadomo, że kwiatowe zapachy zawierają lotne składniki alkany, a n - nonan jest istotnym składnikiem zapachu niektórych róż . Emisja gazowych i lotnych alkanów, takich jak etan , pentan i heksan , została również udokumentowana przez rośliny na niskim poziomie, chociaż nie są one ogólnie uważane za główny składnik biogennego zanieczyszczenia powietrza.
Jadalne oleje roślinne również zazwyczaj zawierają małe frakcje biogenicznych alkanów o szerokim spektrum liczby atomów węgla, głównie od 8 do 35, zwykle osiągając maksimum w dolnej do górnej 20., o stężeniach dochodzących do kilkudziesięciu miligramów na kilogram (części na milion wagowo) i czasami ponad sto dla całkowitej frakcji alkanów.
- Zwierząt
Alkany znajdują się w produktach pochodzenia zwierzęcego, chociaż są mniej ważne niż węglowodory nienasycone. Jednym z przykładów jest olej z wątroby rekina, która jest o około 14% pristan (2,6,10,14-tetramethylpentadecane C 19 H 40 ). Są ważne jako feromony , chemiczne materiały przekaźnikowe, od których owady zależą w komunikacji. U niektórych gatunków, np. chrząszcza podporowego Xylotrechus colonus , pentakozan (C 25 H 52 ), 3-metylopentaikozan (C 26 H 54 ) i 9-metylopentaikozan (C 26 H 54 ) są przenoszone przez kontakt z ciałem. Z innymi, takimi jak mucha tse - tse Glossina morsitans morsitans , feromon zawiera cztery alkany 2-metyloheptadekan (C 18 H 38 ), 17,21-dimetyloheptatriakontan (C 39 H 80 ), 15,19-dimetyloheptatriakontan (C 39 H 80 ) i 15,19,23-trimetyloheptatrikontan (C 40 H 82 ) i działa zapachowo na większe odległości. Tańczące pszczoły miodne produkują i uwalniają dwa alkany, trikozan i pentakozan.
Relacje ekologiczne

Jednym z przykładów, w którym rolę odgrywają zarówno alkany roślinne, jak i zwierzęce, jest związek ekologiczny między pszczołą piaskową ( Andrena nigroaenea ) a wczesną orchideą pająkowatą ( Ophrys sphegodes ); ta ostatnia jest zależna pod względem zapylenia od tego pierwszego. Pszczoły piaskowe używają feromonów w celu identyfikacji partnera; w przypadku A. nigroaenea samice emitują mieszaninę trikozanu (C 23 H 48 ), pentakozanu (C 25 H 52 ) i heptakozanu (C 27 H 56 ) w stosunku 3:3:1, a samce są przyciągane konkretnie przez ten zapach. Orchidea wykorzystuje ten układ godowy, aby skłonić samca pszczoły do zbierania i rozsiewania pyłku; części jej kwiatu nie tylko przypominają wyglądem pszczoły piaskowe, ale także produkują duże ilości trzech alkanów w takiej samej proporcji jak samice pszczół piaskowych. W efekcie liczne samce są zwabione na zakwity i próbują kopulować ze swoim wyimaginowanym partnerem: choć ta próba nie kończy się dla pszczoły sukcesem, pozwala storczykowi przenieść swój pyłek, który zostanie rozproszony po odejściu pszczoły. sfrustrowany mężczyzna na inne kwiaty.
Produkcja
Rafinacja ropy naftowej
Jak wspomniano wcześniej, najważniejszym źródłem alkanów jest gaz ziemny i ropa naftowa . Alkany są oddzielane w rafinerii ropy naftowej przez destylację frakcyjną i przetwarzane na wiele produktów.
Fischera-Tropscha
Proces Fischera-Tropscha to metoda syntezy ciekłych węglowodorów, w tym alkanów, z tlenku węgla i wodoru. Metoda ta służy do wytwarzania substytutów destylatów ropy naftowej .
Przygotowanie laboratoryjne
Zwykle nie ma potrzeby syntezy alkanów w laboratorium, ponieważ są one zwykle dostępne w handlu. Ponadto, alkany są generalnie niereaktywne chemicznie lub biologicznie i nie ulegają czystym wzajemnym przekształceniom grup funkcyjnych . Kiedy alkany są produkowane w laboratorium, często jest to produkt uboczny reakcji. Na przykład zastosowanie n- butylolitu jako mocnej zasady daje sprzężony kwas, n- butan, jako produkt uboczny:
- C 4 H 9 Li + H 2 O → C 4 H 10 + LiOH
Jednak czasami może być pożądane przekształcenie fragmentu cząsteczki w grupę funkcyjną podobną do alkanu ( grupa alkilowa ) przy użyciu powyższych lub podobnych metod. Na przykład grupa etylowa jest grupą alkilową; gdy jest przyłączony do grupy hydroksylowej , daje etanol , który nie jest alkanem. Aby to zrobić, najbardziej znane są metody uwodornienia z alkenów :
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alkil )
Alkany lub grupy alkilowe można również wytwarzać bezpośrednio z halogenków alkilowych w reakcji Corey-House-Posner-Whitesides . Barton McCombie deoksygenacji usunięcie grupy hydroksylowej z alkoholami, np
a redukcja Clemmensena usuwa grupy karbonylowe z aldehydów i ketonów, tworząc alkany lub związki podstawione alkilem, np.:
Otrzymywanie alkanów z innych związków organicznych
Alkany można wytwarzać z różnych związków organicznych. Obejmują one alkeny, alkiny, haloalkany, alkohole, aldehydy i ketony oraz kwasy karboksylowe.
Z alkenów i alkinów
Gdy alkeny i alkiny poddaje się reakcji uwodornienia przez traktowanie ich wodorem w obecności katalizatora palladowego, platynowego lub niklowego, tworzą alkany. W tej reakcji sproszkowany katalizator jest korzystny w celu zwiększenia pola powierzchni tak, że wzrasta adsorpcja wodoru na katalizatorze. W tej reakcji wodór przyłącza się do katalizatora, tworząc wiązanie wodoro-katalizator, co prowadzi do osłabienia wiązania HH, co prowadzi do dodania wodoru do alkenów i alkinów. Reakcja jest egzotermiczna, ponieważ produkt alkanowy jest stabilny, ponieważ ma więcej wiązań sigma niż reagujące alkeny i alkiny z powodu konwersji wiązania pi do wiązań sigma.
Z haloalkanów
Alkany można wytwarzać z haloalkanów różnymi metodami.
Reakcja Wurtza
Gdy haloalkan traktuje się sodem w suchym eterze, otrzymuje się alkan o podwójnej liczbie atomów węgla. Reakcja ta przebiega przez pośrednie wolne rodniki i ma możliwość tworzenia alkenów w przypadku trzeciorzędowych haloalkanów i dihalogenków wicynalnych.np.
2 R−X + 2 Na → R−R + 2 Na+X.(w obecności suchego eteru
Corey-House-Synteza
Gdy haloalkan traktuje się kuprytem dialkilolitowym, który jest inaczej znany jako odczynnik Gilmana, otrzymuje się każdy wyższy alkan. np.
Li+[R–Cu–R]– + R’–X → R–R’ + „RCu” + Li+X
Reakcja z wodorkiem metalu
Gdy haloalkany traktuje się wodorkiem metalu, np. wodorkiem sodu i glinowodorkiem litu.
reakcja Franklanda
Gdy haloalkan traktuje się cynkiem w estrze, otrzymuje się alkan.
Reakcja Fittiga
Gdy halogenek arylu traktuje się sodem w suchym eterze, tworzy bifenyl.
Synteza biarylu Ullmanna
Gdy halogenek arylu traktuje się miedzią, tworzy bifenyl.
Reakcja Wurtza-Fittiga
Gdy halogenek arylu traktuje się haloalkanem, otrzymujemy alkilobenzen.
Aplikacje
Zastosowania alkanów zależą od liczby atomów węgla. Pierwsze cztery alkany są wykorzystywane głównie do ogrzewania i gotowania, aw niektórych krajach do wytwarzania energii elektrycznej. Metan i etan to główne składniki gazu ziemnego; są zwykle przechowywane jako gazy pod ciśnieniem. Jednak łatwiej jest je transportować jako płyny: wymaga to zarówno sprężania, jak i chłodzenia gazu.
Propan i butan to gazy o ciśnieniu atmosferycznym, które mogą być skroplone pod dość niskim ciśnieniem i są powszechnie znane jako gaz płynny (LPG). Propan stosuje się w palnikach na propan oraz jako paliwo do pojazdów drogowych, butan w ogrzewaczach pomieszczeń i jednorazowych zapalniczkach. Oba są używane jako propelenty w aerozolach .
Od pentanu do oktanu alkany są wysoce lotnymi cieczami. Stosowane są jako paliwa w silnikach spalinowych , gdyż łatwo odparowują po wejściu do komory spalania, nie tworząc kropel, które mogłyby zakłócić równomierność spalania. Alkany o rozgałęzionych łańcuchach są preferowane, ponieważ są znacznie mniej podatne na przedwczesny zapłon, który powoduje stukanie , niż ich homologi o łańcuchu prostym. Ta skłonność do przedwczesnego zapłonu jest mierzona liczbą oktanową paliwa, gdzie 2,2,4-trimetylopentan ( izooktan ) ma arbitralną wartość 100, a heptan ma wartość zero. Oprócz zastosowania jako paliw, środkowe alkany są również dobrymi rozpuszczalnikami substancji niepolarnych.
Alkany od nonanu do np. heksadekanu (alkan o szesnastu atomach węgla) to ciecze o wyższej lepkości , coraz mniej odpowiednie do stosowania w benzynie. Stanowią one natomiast główną część oleju napędowego i paliwa lotniczego . Oleje napędowe charakteryzują się liczbą cetanową, przy czym cetan jest starą nazwą heksadekanu. Jednak wyższe temperatury topnienia tych alkanów mogą powodować problemy w niskich temperaturach iw regionach polarnych, gdzie paliwo staje się zbyt gęste, aby prawidłowo płynąć.
Alkany od heksadekanu wzwyż są najważniejszymi składnikami oleju opałowego i smarowego . W tej ostatniej funkcji działają jednocześnie jako środki antykorozyjne, ponieważ ich hydrofobowy charakter sprawia, że woda nie może dotrzeć do powierzchni metalu. Wiele stałych alkanów znajduje zastosowanie jako wosk parafinowy , na przykład w świecach . Nie należy tego jednak mylić z prawdziwym woskiem , który składa się głównie z estrów .
Alkany o długości łańcucha około 35 lub więcej atomów węgla znajdują się w bitumie , stosowanym np. w nawierzchniach drogowych. Jednak wyższe alkany mają niewielką wartość i są zwykle rozbijane na niższe alkany przez kraking .
Niektóre syntetyczne polimery, takie jak polietylen i polipropylen, to alkany z łańcuchami zawierającymi setki lub tysiące atomów węgla. Materiały te są wykorzystywane w niezliczonych zastosowaniach, a każdego roku produkuje się i wykorzystuje miliardy kilogramów tych materiałów.
Przekształcenia środowiskowe
Alkany są chemicznie bardzo obojętnymi, apolarnymi cząsteczkami, które nie są zbyt reaktywne jako związki organiczne. Ta bezwładność powoduje poważne problemy ekologiczne, jeśli zostaną uwolnione do środowiska. Ze względu na brak grup funkcyjnych i niską rozpuszczalność w wodzie, alkany wykazują słabą biodostępność dla mikroorganizmów.
Istnieją jednak pewne mikroorganizmy posiadające zdolność metaboliczną do wykorzystywania n -alkanów zarówno jako źródła węgla, jak i energii. Niektóre gatunki bakterii są wysoce wyspecjalizowane w rozkładaniu alkanów; są one określane jako bakterie węglowodoroklastyczne.
Zagrożenia
Metan jest łatwopalny, wybuchowy i niebezpieczny do wdychania; ponieważ jest to gaz bezbarwny, bezwonny, należy zachować szczególną ostrożność w przypadku metanu. Etan jest również niezwykle łatwopalny, wybuchowy i niebezpieczny do wdychania. Oba mogą spowodować uduszenie. Również propan jest łatwopalny i wybuchowy, a jego wdychanie może powodować senność lub utratę przytomności. Butan stwarza takie same zagrożenia jak propan.
Alkany stanowią również zagrożenie dla środowiska. Alkany rozgałęzione mają mniejszą biodegradowalność niż alkany nierozgałęzione. Metan uważany jest za gaz cieplarniany najbardziej niebezpieczny dla środowiska, chociaż ilość metanu w atmosferze jest stosunkowo niewielka.