Stereochemia alkanowa - Alkane stereochemistry
Alkan stereochemia dotyczy stereochemii z alkanów . Alkanosulfoniany konformery są jednym z przedmiotów alkanu stereochemii.
Konformacja alkanu
Konformery alkanu powstają w wyniku rotacji wokół zhybrydyzowanych wiązań węgiel-węgiel sigma sp 3 . Najmniejszy alkan z takim wiązaniem chemicznym, etan , istnieje jako nieskończona liczba konformacji w odniesieniu do rotacji wokół wiązania C–C. Dwie z nich to formy minimum energii ( konformacja przesunięta ) i maksimum energii ( konformacja zaćmiona ). Istnienie określonych konformacji wynika z utrudnionej rotacji wokół wiązań sigma, chociaż rolę hiperkoniugacji proponuje konkurująca teoria.
Znaczenie minimów energii i maksimów energii widać po rozszerzeniu tych koncepcji na bardziej złożone cząsteczki, dla których stabilne konformacje można przewidzieć jako formy o minimalnej energii. Określenie stabilnych konformacji odegrało również dużą rolę w ustaleniu koncepcji indukcji asymetrycznej i możliwości przewidywania stereochemii reakcji kontrolowanych przez efekty steryczne.
W przykładzie przesuniętego etanu w projekcji Newmana , atom wodoru na jednym atomie węgla ma kąt skręcania 60° lub kąt skręcania w stosunku do najbliższego atomu wodoru na drugim węglu, dzięki czemu przeszkoda przestrzenna jest zminimalizowana. Konformacja przesunięta jest bardziej stabilna o 12,5 kJ / mol niż konformacja zaćmiona , która stanowi maksimum energii dla etanu. W konformacji zaćmionej kąt skręcania jest zminimalizowany.


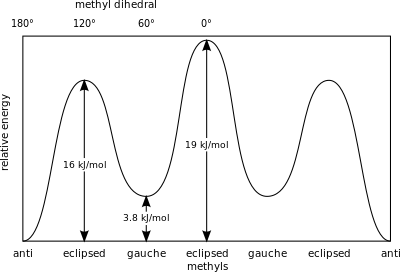
W butanie , dwie przesunięte konformacje nie są już równoważne i reprezentują dwa różne konformery: antykonformację (najbardziej z lewej, poniżej) i konformację Gauche (najbardziej z prawej, poniżej).



Obie konformacje są wolne od naprężeń skrętnych, ale w konformacji Gauche dwie grupy metylowe są bliżej siebie niż suma ich promieni van der Waalsa. Interakcja między dwiema grupami metylowymi jest odpychająca ( szczep van der Waalsa ) i powstaje bariera energetyczna.
Miarą energii potencjalnej zmagazynowanej w konformerach butanu z większą przeszkodą steryczną niż stan podstawowy „antykonformera” są następujące wartości:
- Gauche, konformer – 3,8 kJ/mol
- Eclipsed H i CH 3 – 16 kJ/mol
- Zaćmione CH 3 i CH 3 – 19 kJ/mol.
Zaćmione grupy metylowe wywierają większe napięcie steryczne ze względu na ich większą gęstość elektronową w porównaniu z pojedynczymi atomami wodoru .
Podręcznikowe wyjaśnienie istnienia maksimum energii dla konformacji zaćmionej w etanie jest przeszkodą steryczną , ale przy długości wiązania CC 154 μm i promieniu Van der Waalsa dla wodoru 120 μm atomy wodoru w etanie nigdy nie są w się nawzajem. Kwestia, czy zawada steryczna jest odpowiedzialna za maksimum energii zaćmienia, jest tematem debaty do dnia dzisiejszego. Jedna alternatywa dla wyjaśnienia przeszkody sterycznej opiera się na hiperkoniugacji, analizowanej w ramach Natural Bond Orbital. W konformacji przesuniętej jeden orbital wiążący sigma CH przekazuje gęstość elektronową orbitalowi przeciwwiążącemu drugiego wiązania CH. Stabilizacja energetyczna tego efektu jest maksymalizowana, gdy dwa orbitale mają maksymalne zachodzenie na siebie, występujące w konformacji przesuniętej. W zaćmionej konformacji nie zachodzi nakładanie się, co prowadzi do niekorzystnego maksimum energii. Z drugiej strony analiza w ramach ilościowej teorii orbitali molekularnych pokazuje, że odpychanie 2-orbital-4-elektronowe (steryczne) jest dominujące nad hiperkoniugacją. Badanie teorii wiązań walencyjnych również podkreśla znaczenie efektów sterycznych.
Nomenklatura
Nazewnictwo alkanów według standardów wymienionych w Złotej Księdze IUPAC odbywa się zgodnie z systemem Klyne-Prelog do określania kątów (zwanych kątami skrętnymi lub dwuściennymi ) między podstawnikami wokół pojedynczego wiązania:
- kąt skręcania od 0° do ± 90° nazywa się syn (s)
- kąt skręcania między ± 90° a 180° nazywany jest anty (a)
- kąt skręcania od 30° do 150° lub od –30° do –150° nazywa się klinalnym (c)
- kąt skręcania od 0° do ± 30° lub od ± 150° do 180° nazywa się periplanar (p)
- kąt skręcania między 0° a ± 30° nazywany jest synperiplanarnym (sp), zwanym również konformacją syn- lub cis-
- kąt skręcania od 30° do 90° i od –30° do –90° nazywany jest synchronicznym (sc), zwanym również gauche lub skośnym
- kąt skręcania od 90° do 150° lub od –90° do –150° nazywany jest antyklinalnym (ac)
- kąt skręcania między ± 150° a 180° nazywany jest antyperiplanarnym (ap), zwanym także anty- lub trans- konformacją
Odkształcenie przy skręcaniu lub „Pitzer naprężeniu” odnosi się do odporności na skręcanie wokół wiązania.
Przypadki specjalne
W n- pentanie końcowe grupy metylowe doświadczają dodatkowej interferencji pentanowej .
Zastąpienie wodoru fluorem w politetrafluoroetylenie zmienia stereochemię z geometrii zygzaka na helisę z powodu elektrostatycznego odpychania atomów fluoru w pozycjach 1,3. Dowody na strukturę helisy w stanie krystalicznym pochodzą z krystalografii rentgenowskiej oraz spektroskopii NMR i dichroizmu kołowego w roztworze.
Zobacz też
- Więcej konformacji alkanów istnieje w cyklicznych alkanach; patrz konformacje cykloheksanu .
- Więcej o wpływie gauche interakcji; zobacz efekt Gauche'a .