Pentatlenek arsenu - Arsenic pentoxide

|
|
| Nazwy | |
|---|---|
| Inne nazwy
Tlenek arsenu (V)
Tlenek arsenu Bezwodnik arsenu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA |
100.013.743 |
| Numer WE | |
|
PubChem CID
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 1559 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Jak 2 O 5 | |
| Masa cząsteczkowa | 229,8402 g/mol |
| Wygląd | biały higroskopijny proszek |
| Gęstość | 4,32 g / cm 3 |
| Temperatura topnienia | 315 ° C (599 ° F, 588 K) (rozkłada się) |
| 59,5 g/100 ml (0 °C) 65,8 g/100 ml (20 °C) 8,20 g/100 ml (100 °C) |
|
| Rozpuszczalność | rozpuszczalny w alkoholu |
| Kwasowość (p K a ) | 7 |
| Zagrożenia | |
| Piktogramy GHS |
  
|
| Hasło ostrzegawcze GHS | Niebezpieczeństwo |
| H301 , H331 , H350 , H400 , H410 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P281 , P301 + 310 , P304 + 340 , P308 + 313 , P311 , P321 , P330 , P391 , P403 + 233 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LD 50 ( mediana dawki )
|
8 mg / kg (szczur, doustnie) |
| NIOSH (limity narażenia zdrowotnego w USA): | |
|
PEL (dopuszczalny)
|
[1910.1018] TWA 0,010 mg / m 3 |
|
REL (zalecane)
|
Ca C 0,002 mg / m 3 [15 minut] |
|
IDLH (bezpośrednie zagrożenie)
|
Ca [5 mg/m 3 (jako As)] |
| Związki pokrewne | |
|
Inne kationy
|
Pięciotlenek fosforu Pentatlenek antymonu |
|
Związki pokrewne
|
Trójtlenek arsenu Kwas arsenu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencje Infobox | |
Pentatlenek arsenu jest związkiem nieorganicznym o wzorze As 2 O 5 . Ta szklista, biała, rozpływająca się substancja stała jest stosunkowo niestabilna, co jest zgodne z rzadkością stopnia utlenienia As (V). Bardziej powszechny i znacznie ważniejszy komercyjnie jest tlenek arsenu(III) (As 2 O 3 ). Wszystkie związki arsenu są silnie toksyczne i dlatego mają ograniczone zastosowania komercyjne.
Struktura
Struktura składa się z czterościennych centrów {AsO 4 } i ośmiościennych {AsO 6 } połączonych wspólnymi narożnikami. Struktura różni się od struktury odpowiedniego tlenku fosforu (V) ; w rezultacie, chociaż nadal istnieje stały roztwór z tym tlenkiem, przechodzi on tylko do punktu równomolowego, w którym to momencie fosfor zastąpił arsen we wszystkich jego miejscach czworościennych. Podobnie, pięciotlenek arsenu może również rozpuszczać się do równomolowej ilości pięciotlenku antymonu , jako substytut antymonu dla arsenu tylko w jego miejscach oktaedrycznych.
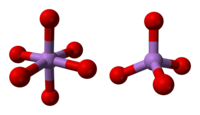 |
 |
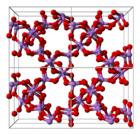
|
| Jak koordynacja | komórka elementarna | pakowanie komórek |
Synteza
Historyczny
Paracelsus Macquer znalazł krystalizującą sól, którą nazwał „selneutre arszenikiem”. Sól ta była pozostałością otrzymaną po destylacji kwasu azotowego z mieszaniny azotanu potasu i trójtlenku arsenu . Wcześniej Paracelsus ogrzewał mieszaninę trójtlenku arsenu i azotanu potasu. Do produktu zastosował określenie „arsenicum fixum”. A. Libavius nazwał ten sam produkt „butyrum arsenici” (masło arsenowe), chociaż w rzeczywistości termin ten był używany dla trichlorku arsenu. Wszystkie produkty znalezione przez Paracelsusa i Libaviusa były nieczystymi arsenianami alkalicznymi. Scheele przygotował szereg arsenianów poprzez działanie kwasu arsenowego na zasady. Jednym z przygotowanych przez niego arsenianów był pięciotlenek arsenu. Woda w alkaliach odparowała w 180˚C, a pentatlenek arsenu był stabilny poniżej 400˚C.
Nowoczesne metody
Pięciotlenek arsenu można krystalizować przez ogrzewanie As 2 O 3 w atmosferze tlenu. Ta reakcja jest odwracalna:
- Jak 2 O 5 ⇌ Jak 2 O 3 + O 2
Silne utleniacze, takie jak ozon , nadtlenek wodoru i kwas azotowy, przekształcają trójtlenek arsenu w pięciotlenek.
Kwas arsenowy można wytwarzać poprzez rutynowe przetwarzanie związków arsenu, w tym przez utlenianie arsenu i minerałów zawierających arsen w powietrzu. Przykładem jest prażenie orpimentu , typowej rudy siarczku arsenu:
- 2 Jak 2 S 3 + 11 O 2 → 2 Jak 2 O 5 + 6 SO 2
Bezpieczeństwo
Jak wszystkie związki arsenu, pięciotlenek jest silnie toksyczny. Jego zredukowana pochodna arseninowa, będąca związkiem As (III), jest jeszcze bardziej toksyczna, ponieważ ma wysokie powinowactwo do grup tiolowych reszt cysteiny w białkach.
Jest klasyfikowana jako substancja wyjątkowo niebezpieczna w Stanach Zjednoczonych zgodnie z definicją w sekcji 302 amerykańskiej ustawy o planowaniu awaryjnym i prawie do wiedzy społeczności (42 USC 11002) i podlega surowym wymogom sprawozdawczym przez zakłady, które produkują, przechowują, lub używaj go w znacznych ilościach.
Bibliografia
- ^ a b c Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych. „# 0038” . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ a b Martin Jansen (1977). „Struktura krystaliczna As 2 O 5 ”. Angewandte Chemie International Edition w języku angielskim . 16 (5): 314–315. doi : 10.1002/anie.197703142 .
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ B J.W. Mellor. „Kompleksowy traktat o chemii nieorganicznej i teoretycznej” . Zarchiwizowane od oryginału w dniu 2012-05-11 . Źródło 2013-03-30 .
- ^ CW Zenger; et al. „Arsen 149” . Zarchiwizowane od oryginału w dniu 2013-04-09.
- ^ Grund, SC; Hanusch, K .; Wolf, HU „Arsen i związki arsenu”. Encyklopedia chemii przemysłowej Ullmanna . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a03_113.pub2 .
-
^ „40 CFR: Załącznik A do części 355 - Lista skrajnie niebezpiecznych substancji i ich progowe ilości do planowania” (PDF) (wyd. 1 lipca 2008). Drukarnia rządowa . Zarchiwizowane z oryginału (PDF) 25 lutego 2012 . Źródło 29 października 2011 r . Cite Journal wymaga
|journal=( pomoc )
Linki zewnętrzne
- Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych
- Monografia IARC - Arsen i związki arsenu
- Raport NTP na temat czynników rakotwórczych – nieorganicznych związków arsenu
- ESIS: Europejski system informacji o substancjach chemicznych
- Linstrom, Peter J .; Mallard, William G. (red.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov

