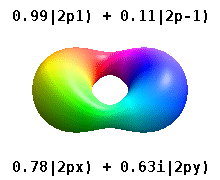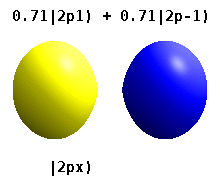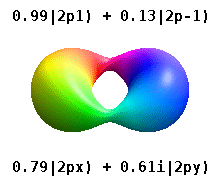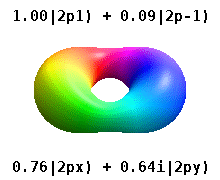Orbital atomowy - Atomic orbital

W atomowych teorii i mechaniki kwantowej An orbitali atomowych jest funkcją matematyczną, opisujące lokalizację i falistą zachowania się elektronu w sposób atomu . Ta funkcja może być używana do obliczania prawdopodobieństwa znalezienia dowolnego elektronu atomu w dowolnym określonym obszarze wokół jądra atomu . Termin orbital atomowy może również odnosić się do obszaru fizycznego lub przestrzeni, w której można obliczyć, że elektron jest obecny, jak przewiduje konkretna matematyczna forma orbitalu.
Każdy orbitalnej w atomie charakteryzuje unikatowy zestaw wartości z trzech liczb kwantowych n , £ -l , a m l , które odpowiadają odpowiednio elektronu energii , pędu , a moment pędu składowej wektora (The liczbą kwantową magnetyczne ). Każdy taki orbital może być zajęty przez maksymalnie dwa elektrony, każdy z własnym rzutem spinu . Proste nazwy s orbital , p orbital , d orbital i f orbital odnoszą się do orbitali o liczbie kwantowej momentu pędu ℓ = odpowiednio 0, 1, 2 i 3 . Nazwy te, wraz z wartością n , służą do opisu konfiguracji elektronowych atomów. Pochodzą one z opisu przez pierwszych spektroskopowe niektórych szeregu metali alkalicznych linii spektralnych jako y HARP , str rincipal , d iffuse , i f undamental . Orbitale dla ℓ > 3 kontynuują alfabetycznie, pomijając j (g, h, i, k, ...), ponieważ niektóre języki nie rozróżniają liter „i” i „j”.
Orbitale atomowe są podstawowymi elementami modelu orbity atomowej (zwanej alternatywnie chmurą elektronów lub modelem mechaniki falowej), nowoczesnymi ramami do wizualizacji submikroskopowego zachowania elektronów w materii. W tym modelu chmura elektronów atomu wieloelektronowego może być postrzegana jako zbudowana (w przybliżeniu) w konfiguracji elektronowej, która jest produktem prostszych orbitali atomowych podobnych do wodoru . Powtarzająca się okresowość bloków 2, 6, 10 i 14 pierwiastków w sekcjach układu okresowego wynika naturalnie z całkowitej liczby elektronów, które zajmują pełny zestaw orbitali atomowych odpowiednio s , p , d i f , chociaż dla wyższych wartości liczby kwantowej n , szczególnie gdy dany atom ma ładunek dodatni, energie niektórych podpowłok stają się bardzo podobne, a więc kolejność, w której mówi się, że są wypełnione elektronami (np. Cr = [Ar ]4s 1 3d 5 i Cr 2+ = [Ar]3d 4 ) można zracjonalizować tylko nieco arbitralnie.
Właściwości elektronów
Wraz z rozwojem mechaniki kwantowej i odkryciami eksperymentalnymi (takimi jak dyfrakcja elektronów na dwóch szczelinach) odkryto, że orbitujące elektrony wokół jądra nie mogą być w pełni opisane jako cząstki, ale muszą być wyjaśnione przez dualizm falowo-cząsteczkowy . W tym sensie elektrony mają następujące właściwości:
Właściwości falopodobne:
- Elektrony nie krążą wokół jądra tak, jak planeta krążąca wokół Słońca, ale istnieją jako fale stojące . Zatem najniższa możliwa energia, jaką może przyjąć elektron, jest zbliżona do podstawowej częstotliwości fali na strunie. Wyższe stany energetyczne są podobne do harmonicznych tej częstotliwości podstawowej.
- Elektrony nigdy nie znajdują się w jednym punkcie, chociaż prawdopodobieństwo interakcji z elektronem w jednym punkcie można znaleźć na podstawie funkcji falowej elektronu. Ładunek elektronu działa tak, jakby był rozmazany w przestrzeni w ciągłym rozkładzie, proporcjonalnym w każdym punkcie do kwadratu wielkości funkcji falowej elektronu .
Właściwości cząsteczkowe:
- Liczba elektronów krążących wokół jądra może być tylko liczbą całkowitą.
- Elektrony przeskakują między orbitalami jak cząsteczki. Na przykład, jeśli pojedynczy foton uderza w elektrony, tylko jeden elektron zmienia stan w odpowiedzi na foton.
- Elektrony zachowują właściwości podobne do cząstek, takie jak: każdy stan falowy ma taki sam ładunek elektryczny jak jego cząstka elektronowa. Każdy stan fali ma pojedynczy dyskretny spin (spin up lub spin down) w zależności od jego superpozycji .
Tak więc elektronów nie można opisać po prostu jako cząstki stałe. Analogią może być duża i często dziwnie ukształtowana „atmosfera” (elektron), rozmieszczona wokół stosunkowo małej planety (jądra atomowego). Orbitale atomowe dokładnie opisują kształt tej „atmosfery” tylko wtedy, gdy w atomie występuje pojedynczy elektron. Kiedy więcej elektronów jest dodawanych do jednego atomu, dodatkowe elektrony mają tendencję do bardziej równomiernego wypełniania przestrzeni wokół jądra, tak że powstały zbiór (czasami nazywany „chmurą elektronów” atomu) zmierza w kierunku ogólnie kulistej strefy prawdopodobieństwa opisującej położenie elektronu, ze względu na zasadę nieoznaczoności .
Formalna definicja mechaniki kwantowej
Orbitale atomowe można dokładniej zdefiniować w formalnym języku mechaniki kwantowej . Są przybliżonym rozwiązaniem równania Schrodingera dla elektronów związanych z atomem przez pole elektryczne jądra atomu . W szczególności w mechanice kwantowej stan atomu, tj. stan własny atomowego hamiltonianu , jest przybliżany przez rozwinięcie (patrz rozwinięcie konfiguracji interakcji i zbiór baz ) na liniowe kombinacje produktów antysymetryzowanych ( wyznaczniki Slatera ) jedno- funkcje elektronowe. Przestrzenne składniki tych funkcji jednoelektronowych nazywane są orbitalami atomowymi. (Gdy weźmie się pod uwagę również ich wirowania składnik, mówi się o atomowych orbitali wirowania ). Stan jest w rzeczywistości jest funkcją współrzędnych wszystkich elektronów, tak, że ich ruch jest skorelowane, ale często jest to w przybliżeniu przez ten wzór niezależnie cząstek o produkty funkcji falowych pojedynczych elektronów. (Na przykład siła dyspersyjna Londona zależy od korelacji ruchu elektronów.)
W fizyce atomowej , że atomowe linie widmowe odpowiadają przejściom ( kwantowych skoków ) pomiędzy stanów kwantowych atomu. Stany te są oznaczone zbiorem liczb kwantowych podsumowanych terminem symbol i zwykle związanych z określonymi konfiguracjami elektronów, tj. schematami zajętości orbitali atomowych (na przykład 1s 2 2s 2 2p 6 dla stanu podstawowego neonu -termin symbol : 1 S 0 ).
Ten zapis oznacza, że odpowiednie wyznaczniki Slatera mają wyraźnie wyższą wagę w rozwinięciu interakcji konfiguracji . Koncepcja orbity atomowej jest zatem kluczową koncepcją do wizualizacji procesu wzbudzania związanego z danym przejściem . Na przykład można powiedzieć, że dla danego przejścia odpowiada ono wzbudzeniu elektronu z orbitalu zajętego na orbital niezajęty. Niemniej jednak należy pamiętać, że elektrony są fermionami rządzonymi przez zasadę wykluczania Pauliego i nie można ich od siebie odróżnić. Co więcej, czasami zdarza się, że rozwinięcie interakcji konfiguracji zbiega się bardzo powoli i że w ogóle nie można mówić o prostej jednowymiarowej funkcji falowej. Dzieje się tak w przypadku dużej korelacji elektronowej .
Zasadniczo orbital atomowy jest funkcją falową jednego elektronu, mimo że większość elektronów nie istnieje w atomach jednoelektronowych, a więc widok jednego elektronu jest przybliżeniem. Myśląc o orbitalach, często otrzymujemy wizualizację orbitali, na którą duży wpływ ma przybliżenie Hartree-Fock , które jest jednym ze sposobów zmniejszenia złożoności teorii orbitali molekularnych .
Rodzaje orbitali

Orbitale atomowe mogą być "orbitalami" podobnymi do wodoru, które są dokładnymi rozwiązaniami równania Schrödingera dla "atomu" podobnego do wodoru (tj. atomu z jednym elektronem). Alternatywnie, orbitale atomowe odnoszą się do funkcji, które zależą od współrzędnych jednego elektronu (tj. orbitali), ale są używane jako punkty wyjścia do przybliżania funkcji falowych, które zależą od równoczesnych współrzędnych wszystkich elektronów w atomie lub cząsteczce. Układy współrzędnych wybrane dla orbitali atomowych to zwykle współrzędne sferyczne ( r , θ, φ) w atomach i kartezjany (x, y, z) w cząsteczkach wieloatomowych. Zaletą współrzędnych sferycznych (atomów) jest to, że funkcja fal orbitalnych jest iloczynem trzech czynników, z których każdy zależy od jednej współrzędnej: ψ( r , θ, φ) = R ( r ) Θ(θ) Φ(φ) . Kątowe czynniki orbitali atomowych Θ (θ) Φ (φ) generowania S, P, D, itd funkcje jak rzeczywistych kombinacji z sferycznych harmonicznych Y ℓm (θ, N) (gdzie ℓ i m są liczbami kwantowe). Istnieją zazwyczaj trzy formy matematyczne funkcji radialnych R ( r ), które można wybrać jako punkt wyjścia do obliczenia właściwości atomów i cząsteczek o wielu elektronach:
- Wodór jak orbitali atomowych pochodzą od dokładnej roztworu Schrödinger'a równanie jednego elektronu i jądra na wodór jak atom . Część funkcji zależna od odległości r od jądra ma węzły (węzły promieniowe) i zanika jako e −(stała × odległość) .
- Slater typu orbitalne (STO) jest forma bez węzłów promieniowych i rozpada od jądra podobnie jak wodór, jak orbitalnej.
- Forma orbitali typu Gaussa (Gaussowie) nie ma węzłów promieniowych i rozpadów jak .
Chociaż orbitale wodorowe są nadal używane jako narzędzia pedagogiczne, pojawienie się komputerów sprawiło, że STO są preferowane dla atomów i cząsteczek dwuatomowych, ponieważ kombinacje STO mogą zastąpić węzły w orbitalu atomowym podobnym do wodoru. Gaussy są zwykle używane w cząsteczkach z trzema lub więcej atomami. Chociaż same w sobie nie są tak dokładne jak STO, kombinacje wielu Gaussów mogą osiągnąć dokładność orbitali podobnych do wodoru.
Historia
Termin „orbital” został ukuty przez Roberta Mullikena w 1932 roku jako skrót od jednoelektronowej funkcji falowej orbitalnej . Jednak pomysł, że elektrony mogą krążyć wokół zwartego jądra o określonym momencie pędu, został przekonująco argumentowany co najmniej 19 lat wcześniej przez Nielsa Bohra , a japoński fizyk Hantaro Nagaoka już w 1904 roku opublikował opartą na orbicie hipotezę dotyczącą zachowania elektronów. zachowanie tych „orbit” elektronowych było jedną z sił napędowych rozwoju mechaniki kwantowej .
Wczesne modele
Wraz z odkryciem elektronu przez JJ Thomsona w 1897 r. stało się jasne, że atomy nie są najmniejszymi elementami budulcowymi natury, ale raczej cząsteczkami złożonymi. Nowo odkryta struktura w atomach skusiła wielu do wyobrażenia sobie, w jaki sposób części składowe atomu mogą ze sobą oddziaływać. Thomson wysunął teorię, że wiele elektronów krąży po orbitopodobnych pierścieniach w dodatnio naładowanej galaretowatej substancji, a między odkryciem elektronu a 1909 r. ten „ model śliwkowy ” był najszerzej akceptowanym wyjaśnieniem budowy atomu.
Wkrótce po odkryciu Thomsona Hantaro Nagaoka przewidział inny model struktury elektronowej. W przeciwieństwie do modelu „Pudding śliwkowy”, ładunek dodatni w „Modelu Saturna” Nagaoki został skoncentrowany w centralnym jądrze, wciągając elektrony na kołowe orbity przypominające pierścienie Saturna. Niewielu ludzi zwróciło wówczas uwagę na pracę Nagaoki, a sam Nagaoka rozpoznał fundamentalną wadę tej teorii już w momencie jej poczęcia, a mianowicie, że klasyczny naładowany obiekt nie może utrzymać ruchu orbitalnego, ponieważ przyspiesza i dlatego traci energię z powodu promieniowania elektromagnetycznego. Niemniej jednak model Saturna okazał się mieć więcej wspólnego z teorią współczesną niż którakolwiek z jej współczesnych.
atom Bohra
W 1909 roku Ernest Rutherford odkrył, że większość masy atomowej jest ciasno skondensowana w jądro, które również jest naładowane dodatnio. Z jego analizy w 1911 r. stało się jasne, że model budyniu śliwkowego nie mógł wyjaśnić budowy atomowej. W 1913 roku doktorant Rutherforda, Niels Bohr , zaproponował nowy model atomu, w którym elektrony krążą wokół jądra z klasycznymi okresami, ale wolno im było mieć jedynie dyskretne wartości momentu pędu, skwantowane w jednostkach h /2π . To ograniczenie automatycznie dopuszczało tylko pewne wartości energii elektronów. Bohra modelu atomu rozwiązaniu problemu utraty energii z promieniowania od stanu podstawowego (o stwierdzając, że nie ma to stan poniżej) oraz, co ważniejsze wyjaśnione pochodzenia linii widmowych.

Po zastosowaniu przez Bohra wyjaśnienia Einsteina dotyczącego efektu fotoelektrycznego do powiązania poziomów energii w atomach z długością fali emitowanego światła, związek między strukturą elektronów w atomach a widmami emisyjnymi i absorpcyjnymi atomów stał się coraz bardziej użytecznym narzędziem w zrozumieniu elektronów w atomach. Najważniejszą cechą widm emisyjnych i absorpcyjnych (znanych doświadczalnie od połowy XIX wieku) było to, że te widma atomowe zawierały dyskretne linie. Znaczenie modelu Bohra polegało na tym, że powiązał linie w widmach emisyjnych i absorpcyjnych z różnicami energii między orbitami, które elektrony mogą przyjąć wokół atomu. Zostało to jednak nie osiąga się przez Bohra elektrony przez dając jakąś falą podobny właściwości, ponieważ myślą, że elektrony mogły zachowywać się jak fale materii nie było sugerowane dopiero jedenaście lat później. Mimo to wykorzystanie przez model Bohra skwantowanego pędu kątowego, a zatem skwantowanych poziomów energii, było znaczącym krokiem w kierunku zrozumienia elektronów w atomach, a także znaczącym krokiem w kierunku rozwoju mechaniki kwantowej, sugerując, że skwantowane ograniczenia muszą uwzględniać wszystkie nieciągłe poziomy energii i widma w atomach.
Dzięki sugestii de Broglie o istnieniu fal materii elektronowej w 1924 roku i na krótki czas przed pełnym potraktowaniem atomów wodoropodobnych równaniem Schrödingera z 1926 roku , "długość fali" elektronu Bohra mogła być postrzegana jako funkcja jego pędu. , a zatem zaobserwowano, że orbitujący elektron Bohra krąży po okręgu z wielokrotnością swojej połowy długości fali. Model Bohra przez krótki czas mógł być postrzegany jako model klasyczny z dodatkowym ograniczeniem wynikającym z argumentu „długości fali”. Jednak okres ten został natychmiast zastąpiony przez pełną trójwymiarową mechanikę falową z 1926 roku. W naszym obecnym rozumieniu fizyki model Bohra jest nazywany modelem półklasycznym ze względu na jego kwantyzację momentu pędu, a nie głównie ze względu na jego związek z długość fali elektronowej, która pojawiła się z perspektywy czasu kilkanaście lat po zaproponowaniu modelu Bohra.
Model Bohra był w stanie wyjaśnić widma emisyjne i absorpcyjne wodoru . Energie elektronów w stanach n = 1, 2, 3 itd. w modelu Bohra odpowiadają energiom obecnej fizyki. Nie wyjaśniało to jednak podobieństw między różnymi atomami, wyrażonych w układzie okresowym, takich jak fakt, że hel (dwa elektrony), neon (10 elektronów) i argon (18 elektronów) wykazują podobną obojętność chemiczną. Współczesna mechanika kwantowa wyjaśnia to za pomocą powłok elektronowych i podpowłok, z których każda może zawierać pewną liczbę elektronów określoną przez zasadę wykluczania Pauliego . Zatem stan n = 1 może pomieścić jeden lub dwa elektrony, podczas gdy stan n = 2 może pomieścić do ośmiu elektronów w podpowłokach 2s i 2p. W helu wszystkie stany n = 1 są w pełni zajęte; to samo dotyczy n = 1 i n = 2 w neonach. W argonie podpowłoki 3s i 3p są podobnie całkowicie zajęte przez osiem elektronów; mechanika kwantowa również dopuszcza podpowłokę 3d, ale ta ma wyższą energię niż 3s i 3p w argonie (w przeciwieństwie do sytuacji w atomie wodoru) i pozostaje pusta.
Współczesne koncepcje i związki z zasadą nieoznaczoności Heisenberga
Natychmiast po tym, jak Heisenberg odkrył swoją zasadę nieoznaczoności , Bohr zauważył, że istnienie dowolnego rodzaju pakietu falowego implikuje niepewność co do częstotliwości i długości fali, ponieważ do stworzenia samego pakietu potrzebny jest rozrzut częstotliwości. W mechanice kwantowej, gdzie wszystkie pędy cząstek są powiązane z falami, jest to formowanie takiej paczki falowej, która lokalizuje falę, a tym samym cząstkę, w przestrzeni. W stanach, w których wiązana jest cząstka mechaniki kwantowej, musi być ona zlokalizowana jako paczka falowa, a istnienie paczki i jej minimalny rozmiar implikuje rozrzut i minimalną wartość długości fali cząstki, a więc także pędu i energii. W mechanice kwantowej, ponieważ cząsteczka jest zlokalizowana w mniejszym obszarze przestrzeni, związany z nią skompresowany pakiet falowy wymaga coraz większego zakresu pędów, a tym samym coraz większej energii kinetycznej. W ten sposób energia wiązania do zatrzymywania lub uwięzienia cząstki w mniejszym obszarze przestrzeni wzrasta bez wiązania, gdy obszar przestrzeni staje się mniejszy. Cząstek nie można ograniczyć do punktu geometrycznego w przestrzeni, ponieważ wymagałoby to nieskończonego pędu cząstki.
W chemii Schrödinger , Pauling , Mulliken i inni zauważyli, że konsekwencją relacji Heisenberga było to, że elektron jako paczka fal nie może być uważany za posiadający dokładne położenie na swojej orbicie. Max Born zasugerował, że położenie elektronu należy opisać rozkładem prawdopodobieństwa, który wiązał się ze znalezieniem elektronu w pewnym punkcie funkcji falowej, która opisuje skojarzoną z nim paczkę falową. Nowa mechanika kwantowa nie dała dokładnych wyników, a jedynie prawdopodobieństwa wystąpienia różnych możliwych takich wyników. Heisenberg utrzymywał, że droga poruszającej się cząstki nie ma znaczenia, jeśli nie możemy jej obserwować, tak jak nie możemy tego zrobić w przypadku elektronów w atomie.
W kwantowym obrazie Heisenberga, Schrödingera i innych liczba atomów Bohra n dla każdego orbitalu stała się znana jako n-sfera w trójwymiarowym atomie i została przedstawiona jako najbardziej prawdopodobna energia chmury prawdopodobieństwa pakietu falowego elektronu, która otoczył atom.
Nazwy orbitalne
Notacja orbitalna i podpowłoki
Orbitale otrzymały nazwy, które zazwyczaj podaje się w postaci:
gdzie X jest poziomem energii odpowiadającym głównej liczbie kwantowej n ; type jest małą literą oznaczającą kształt lub podpowłokę orbitalu, odpowiadającą liczbie kwantowej momentu pędu ℓ .
Na przykład orbital 1s (wymawiany jako pojedyncze cyfry i litery: „jeden” ess”) jest najniższym poziomem energii ( n = 1 ) i ma kątową liczbę kwantową ℓ = 0 , oznaczoną jako s. Orbitale z ℓ = 1, 2 i 3 są oznaczone odpowiednio jako p, d i f.
Zbiór orbitali dla danego n i ℓ nazywamy podpowłoką , oznaczoną
- .
Wykładnik y pokazuje liczbę elektronów w podpowłoce. Na przykład notacja 2p 4 wskazuje, że podpowłoka 2p atomu zawiera 4 elektrony. Ta podpowłoka ma 3 orbitale, każdy z n = 2 i ℓ = 1.
Notacja rentgenowska
Istnieje również inny, mniej powszechny system, nadal używany w nauce rentgenowskiej, znany jako notacja rentgenowska , który jest kontynuacją notacji używanych przed dobrze zrozumianą teorią orbitalną. W tym systemie główna liczba kwantowa otrzymuje powiązaną z nią literę. Dla n = 1, 2, 3, 4, 5, … litery związane z tymi liczbami to odpowiednio K, L, M, N, O, ….
Orbitale wodoropodobne
Najprostsze orbitale atomowe to te, które są obliczane dla układów z pojedynczym elektronem, takich jak atom wodoru . Atom dowolnego innego pierwiastka zjonizowany do pojedynczego elektronu jest bardzo podobny do wodoru, a orbitale przyjmują tę samą formę. W równaniu Schrödingera w tym systemie jeden ujemny i jeden pozytywny cząstek stałych, orbitali atomowych są stany własne według Hamiltona operatora na energię. Można je otrzymać analitycznie, co oznacza, że powstałe orbitale są produktami szeregu wielomianowego oraz funkcji wykładniczych i trygonometrycznych. (patrz atom wodoru ).
W przypadku atomów z dwoma lub więcej elektronami, równania rządzące można rozwiązać jedynie metodami przybliżenia iteracyjnego. Orbitale atomów wieloelektronowych są jakościowo podobne do orbitali wodoru, aw najprostszych modelach przyjmuje się, że mają tę samą formę. Aby uzyskać bardziej rygorystyczną i precyzyjną analizę, należy zastosować przybliżenia liczbowe.
Dany (podobny do wodoru) orbital atomowy jest identyfikowany przez unikalne wartości trzech liczb kwantowych: n , ℓ , i m ℓ . Reguły ograniczające wartości liczb kwantowych i ich energie (patrz niżej) wyjaśniają konfigurację elektronową atomów i układ okresowy pierwiastków .
Stany stacjonarne (stany kwantowe ) atomów wodoropodobnych są jego orbitalami atomowymi. Jednak ogólnie zachowanie elektronu nie jest w pełni opisane przez pojedynczy orbital. Stany elektronowe są najlepiej reprezentowane przez zależne od czasu „mieszaniny” ( kombinacje liniowe ) wielu orbitali. Zobacz Liniowa kombinacja orbitali atomowych metoda orbitali molekularnych .
Liczba kwantowa n pojawiła się po raz pierwszy w modelu Bohra, gdzie określa promień każdej kołowej orbity elektronowej. Jednak we współczesnej mechanice kwantowej n określa średnią odległość elektronu od jądra; wszystkie elektrony o tej samej wartości n leżą w tej samej średniej odległości. Z tego powodu mówi się , że orbitale o tej samej wartości n zawierają „ powłokę ”. Orbitale o tej samej wartości n, a także o tej samej wartości ℓ są jeszcze ściślej spokrewnione i mówi się, że zawierają „ podpowłokę ”.
Liczby kwantowe
Ze względu na kwantowo-mechaniczny charakter elektronów wokół jądra, orbitale atomowe można jednoznacznie zdefiniować za pomocą zestawu liczb całkowitych zwanych liczbami kwantowymi. Te liczby kwantowe występują tylko w pewnych kombinacjach wartości, a ich fizyczna interpretacja zmienia się w zależności od tego, czy wykorzystywane są prawdziwe, czy złożone wersje orbitali atomowych.
Złożone orbitale
W fizyce najczęstsze opisy orbitali opierają się na rozwiązaniach atomu wodoru, gdzie orbitale są podane przez iloczyn funkcji radialnej i czystej harmonicznej sferycznej. Liczby kwantowe wraz z regułami rządzącymi ich możliwymi wartościami przedstawiają się następująco:
Główny liczbą kwantową n opisuje energia elektronu i zawsze jest dodatnią liczbą całkowitą . W rzeczywistości może to być dowolna dodatnia liczba całkowita, ale z powodów omówionych poniżej rzadko spotyka się duże liczby. Każdy atom ma na ogół wiele orbitali związanych z każdą wartością n ; te orbitale razem są czasami nazywane powłokami elektronowymi .
Azymutalny liczbą kwantową ℓ opisuje orbitalny pędu poszczególnych elektronów i nieujemną liczbą całkowitą. Wewnątrz powłoki, gdzie n jest liczbą całkowitą n 0 , ℓ obejmuje wszystkie (całkowite) wartości spełniające relację . Na przykład powłoka n = 1 ma tylko orbitale z , a powłoka n = 2 ma tylko orbitale z , i . Zbiór orbitali związanych z określoną wartością ℓ jest czasami zbiorczo nazywany podpowłoką .
Liczbą kwantową magnetyczne , opisuje moment magnetyczny elektronu w dowolnym kierunku, a także zawsze liczbą całkowitą. W podpowłoce, gdzie jest pewna liczba całkowita , zakresy w ten sposób: .
Powyższe wyniki można podsumować w poniższej tabeli. Każda komórka reprezentuje podpowłokę i zawiera listę wartości dostępnych w tej podpowłoce. Puste komórki reprezentują podpowłoki, które nie istnieją.
| ℓ = 0 ( s ) | ℓ = 1 ( p ) | ℓ = 2 ( d ) | ℓ = 3 ( f ) | ℓ = 4 ( g ) | ... | |
|---|---|---|---|---|---|---|
| n = 1 | ... | |||||
| n = 2 | 0 | -1, 0, 1 | ... | |||
| n = 3 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | ... | ||
| n = 4 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | -3, -2, -1, 0, 1, 2, 3 | ... | |
| n = 5 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | -3, -2, -1, 0, 1, 2, 3 | -4, -3, -2, -1, 0, 1, 2, 3, 4 | ... |
| ... | ... | ... | ... | ... | ... | ... |
Podpowłoki są zwykle identyfikowane przez ich - i - wartości. jest reprezentowany przez jego wartość liczbową, ale jest reprezentowany przez literę w następujący sposób: 0 jest reprezentowane przez 's', 1 przez 'p', 2 przez 'd', 3 przez 'f', a 4 przez 'g'. Na przykład można mówić o podpowłoce za pomocą i jako o „podpowłoce dwójek”.
Każdy elektronów ma również liczbę kwantową wirowania , S , co opisuje wirowania każdego elektronów (wirowanie w górę lub w dół) wirowania. Liczba s może być +1/2 lub −1/2.
W Zakaz Pauliego stwierdza, że żadne dwa elektrony w atomie może mieć te same wartości wszystkich czterech liczb kwantowych. Jeśli na orbicie znajdują się dwa elektrony o danych wartościach dla trzech liczb kwantowych ( n , ℓ , m ), te dwa elektrony muszą różnić się spinem.
Powyższe konwencje implikują preferowaną oś (na przykład kierunek z we współrzędnych kartezjańskich), a także preferują kierunek wzdłuż tej preferowanej osi. W przeciwnym razie nie byłoby sensu rozróżniać m = +1 od m = −1 . W związku z tym model jest najbardziej przydatny w przypadku zastosowania do systemów fizycznych, które współdzielą te symetrie. Doświadczenie Sterna-Gerlacha — w którym atom jest wystawiony na działanie pola magnetycznego — stanowi jeden z takich przykładów.
Prawdziwe orbitale
Atom osadzony w krystalicznym ciele stałym ma wiele preferowanych osi, ale często nie ma preferowanego kierunku. Zamiast budować orbitale atomowe z iloczynu funkcji promieniowych i pojedynczej harmonicznej sferycznej , zwykle stosuje się liniowe kombinacje harmoniki sferycznej, zaprojektowane tak, aby urojona część harmoniki sferycznej znosiła się. Te prawdziwe orbitale są najczęściej przedstawianymi elementami budulcowymi na wizualizacjach orbitalnych.
Na przykład w rzeczywistych orbitalach wodoropodobnych n i ℓ mają taką samą interpretację i znaczenie jak ich złożone odpowiedniki, ale m nie jest już dobrą liczbą kwantową (chociaż jej wartość bezwzględna jest). Orbitale otrzymują nowe nazwy w oparciu o ich kształt w stosunku do znormalizowanej bazy kartezjańskiej. Prawdziwe wodoropodobne orbitale p są podane przez:
gdzie p 0 = R n 1 Y 1 0 , p 1 = R n 1 Y 1 1 i p -1 = R n 1 Y 1 -1 , są orbitalami zespolonymi odpowiadającymi ℓ = 1 .
Równania dla orbitali p x i p y zależą od konwencji fazowej stosowanej dla harmonicznej sferycznej. Powyższe równania zakładają, że sferyczne harmoniczne są zdefiniowane przez . Jednak niektórzy fizycy kwantowi uwzględniają w tych definicjach współczynnik fazowy (-1) m , który powoduje powiązanie orbitalu p x z różnicą sferycznych harmonicznych, a orbitalu p y z odpowiednią sumą . (Aby uzyskać więcej informacji, zobacz Harmoniki sferyczne#Konwencje ).
Kształty orbitali
Proste obrazy przedstawiające kształty orbitalne mają opisywać formy kątowe obszarów w przestrzeni, w których prawdopodobnie znajdują się elektrony zajmujące orbitę. Diagramy nie mogą pokazać całego obszaru, w którym można znaleźć elektron, ponieważ zgodnie z mechaniką kwantową istnieje niezerowe prawdopodobieństwo znalezienia elektronu (prawie) w dowolnym miejscu w przestrzeni. Zamiast tego diagramy są przybliżonymi reprezentacjami powierzchni granicznych lub konturowych, gdzie gęstość prawdopodobieństwa | ψ( r , θ, φ) | 2 ma stałą wartość, dobraną tak, aby istniało pewne prawdopodobieństwo (na przykład 90%) znalezienia elektronu w obrębie konturu. Chociaż | | 2 ponieważ kwadrat wartości bezwzględnej jest wszędzie nieujemny, znak funkcji falowej ψ( r , θ, φ) jest często wskazywany w każdym podregionie obrazu orbitalnego.
Czasami funkcja ψ będzie przedstawiana na wykresie, aby pokazać jej fazy, a nie | ψ( r , θ, φ) | 2, który pokazuje gęstość prawdopodobieństwa, ale nie ma faz (które zostały utracone w procesie przyjmowania wartości bezwzględnej, ponieważ ψ( r , θ, φ) jest liczbą zespoloną). | ψ( r , θ, φ) | 2 grafy orbitalne mają zwykle mniej kuliste, cieńsze płatki niż grafy ψ( r , θ, φ) , ale mają taką samą liczbę płatów w tych samych miejscach, a poza tym są rozpoznawalne. Ten artykuł, w celu pokazania faz funkcji falowych, pokazuje głównie wykresy ψ( r , θ, φ) .
Płaty można traktować jako fala stojąca zakłóceń wzorce pomiędzy dwa przeciwbieżne, pierścień rezonansowy o fali „ m ” i „ - m ” tryb z występem orbitalnego na płaszczyźnie xy o rezonansowy „ m ” długości fal wokół obwodu . Choć rzadko przedstawiane, rozwiązania fali biegnącej mogą być postrzegane jako obracające się torusy z pasmami, z pasmami reprezentującymi informacje o fazie. Dla każdego m istnieją dwa rozwiązania fali stojącej ⟨ m ⟩+⟨− m ⟩ i ⟨ m ⟩−⟨− m ⟩ . W przypadku, gdy m = 0 orbital jest pionowy, informacje o obrocie w przeciwnych kierunkach są nieznane, a orbital jest symetryczny względem osi z . W przypadku, gdy ℓ = 0 nie ma trybów przeciwbieżnych. Istnieją tylko mody radialne, a kształt jest sferycznie symetryczny. Dla dowolnego danego n , im mniejsze ℓ , tym więcej jest węzłów promieniowych. Dla dowolnego danego ℓ , im mniejsze n , tym mniej jest węzłów promieniowych (zero dla tego, który n pierwszy ma ten orbital ℓ ). Mówiąc ogólnie, n to energia, ℓ jest analogiczna do ekscentryczności , a m to orientacja. W klasycznym przypadku, ruchoma fala rezonansowa pierścieniowa, na przykład w kołowej linii transmisyjnej, o ile nie zostanie aktywnie wymuszona, spontanicznie rozpadnie się na rezonansową falę stojącą, ponieważ odbicia będą narastać z czasem nawet przy najmniejszej niedoskonałości lub nieciągłości.
Ogólnie rzecz biorąc, liczba n określa rozmiar i energię orbitalu dla danego jądra: wraz ze wzrostem n, zwiększa się rozmiar orbitalu. Porównując różne pierwiastki, wyższy ładunek jądrowy Z cięższych pierwiastków powoduje kurczenie się ich orbitali w porównaniu z lżejszymi, tak że ogólny rozmiar całego atomu pozostaje bardzo z grubsza stały, nawet gdy liczba elektronów w cięższych pierwiastkach (większe Z ) wzrasta.
Również ogólnie, ℓ określa kształt orbity, a m ℓ jego orientację. Ponieważ jednak niektóre orbitale są opisane równaniami w liczbach zespolonych , kształt czasami zależy również od m ℓ . Razem cały zestaw orbitali dla danego ℓ i n wypełnia przestrzeń tak symetrycznie, jak to możliwe, choć z coraz bardziej złożonymi zestawami płatów i węzłów.
Pojedyncze orbitale s ( ) mają kształt kul. Dla n = 1 jest to z grubsza lita kula (jest najbardziej gęsta w środku i zanika wykładniczo na zewnątrz), ale dla n = 2 lub więcej, każdy pojedynczy orbital s składa się z sferycznie symetrycznych powierzchni, które są zagnieżdżonymi skorupami (tj. "struktura falowa" jest promieniowa, również po sinusoidalnej składowej promieniowej). Zobacz ilustrację przekroju tych zagnieżdżonych muszli po prawej stronie. Orbitale s dla wszystkich liczb n są jedynymi orbitalami z anty-węzłem (obszar o wysokiej gęstości funkcji falowej) w centrum jądra. Wszystkie inne orbitale (p, d, f, itp.) mają moment pędu, a tym samym unikają jądra (mającego węzeł falowy w jądrze). Ostatnio podjęto próbę eksperymentalnego zobrazowania orbitali 1s i 2p w krysztale SrTiO 3 przy użyciu transmisyjnej mikroskopii elektronowej ze spektroskopią rentgenowską z dyspersją energii. Ponieważ obrazowanie przeprowadzono przy użyciu wiązki elektronów, w ostatecznym wyniku uwzględnia się oddziaływanie wiązki kulombowskiej z orbitą, które często określa się mianem efektu parametru uderzenia (patrz rysunek po prawej).
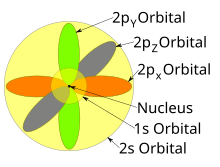
Kształty orbitali p, d i f są tutaj opisane werbalnie i pokazane graficznie w poniższej tabeli orbitali . Trzy orbitale p dla n = 2 mają postać dwóch elipsoid z punktem styczności do jądra (kształt dwupłatowy jest czasami określany jako „ hantle ” – są dwa płaty skierowane w przeciwnych kierunkach od siebie ). Trzy orbitale p w każdej powłoce są zorientowane względem siebie pod kątem prostym, co określa ich odpowiednia liniowa kombinacja wartości m ℓ . Ogólnym wynikiem jest płat skierowany wzdłuż każdego kierunku osi głównych.
Cztery z pięciu orbitali d dla n = 3 wyglądają podobnie, każdy z czterema płatami gruszkowatymi, każdy płatek styczny do dwóch innych, a środki wszystkich czterech leżą w jednej płaszczyźnie. Trzy z tych płaszczyzn to płaszczyzny xy, xz i yz — płaty znajdują się między parami głównych osi — a czwarta ma środek wzdłuż samych osi x i y. Piąty i ostatni orbital d składa się z trzech obszarów o dużej gęstości prawdopodobieństwa: torusa pomiędzy dwoma obszarami w kształcie gruszki umieszczonymi symetrycznie na jego osi z. Łącznie 18 kierunkowych listków wskazuje w każdym kierunku osi głównej i pomiędzy każdą parą.
Istnieje siedem orbitali f, z których każdy ma kształty bardziej złożone niż orbitale d.
Dodatkowo, podobnie jak w przypadku orbitali s, poszczególne orbitale p, d, f i g o wartości n większej od najmniejszej możliwej wartości wykazują dodatkową radialną strukturę węzłową przypominającą fale harmoniczne tego samego typu w porównaniu z najniższy (lub fundamentalny) mod fali. Podobnie jak w przypadku orbitali s, zjawisko to zapewnia orbitale p, d, f i g o kolejnej wyższej możliwej wartości n (na przykład orbitale 3p w porównaniu z podstawowym 2p), dodatkowy węzeł w każdym płatku. Jeszcze wyższe wartości n dodatkowo zwiększają liczbę węzłów radialnych dla każdego typu orbitali.
Kształty orbitali atomowych w atomie jednoelektronowym są związane z trójwymiarowymi harmonicznymi sferycznymi . Takie kształty nie są wyjątkowe, a kombinacja liniowa jest ważny, jak przekształceń harmonicznych sześciennych , w rzeczywistości nie jest możliwe wytworzenie zestawu, gdzie wszystkie d'y mają taki sam kształt, jak w p x , p y , i P oo są ten sam kształt.
Chociaż poszczególne orbitale są najczęściej pokazywane niezależnie od siebie, orbitale współistnieją w tym samym czasie wokół jądra. Również w 1927 roku Albrecht Unsöld udowodnił, że sumując gęstość elektronową wszystkich orbitali określonej liczby kwantowej azymutalnej ℓ tej samej powłoki n (np. wszystkich trzech orbitali 2p lub wszystkich pięciu orbitali 3d), gdzie każdy orbital jest zajęty przez elektron lub każdy jest zajęty przez parę elektronów, wtedy znika cała zależność kątowa; to znaczy, że uzyskana całkowita gęstość wszystkich orbitali atomowych w tej podpowłoce (tych z tym samym ℓ ) jest sferyczna. Jest to znane jako twierdzenie Unsölda .
Stół orbitalny
Ta tabela pokazuje wszystkie konfiguracje orbitalne dla rzeczywistych funkcji fal podobnych do wodoru do 7 s, a zatem obejmuje prostą konfigurację elektroniczną dla wszystkich pierwiastków w układzie okresowym aż do radu . Wykresy „ψ” są pokazane z fazami funkcji falowej − i + w dwóch różnych kolorach (dowolnie czerwonym i niebieskim). Orbital p z jest taki sam jak orbital p 0 , ale p x i p y są tworzone przez wzięcie liniowych kombinacji orbitali p +1 i p -1 (dlatego są one wymienione pod etykietą m = ± 1 ). Ponadto p +1 i p -1 nie mają takiego samego kształtu jak p 0 , ponieważ są one czystymi harmonicznymi sferycznymi .
* Nie odkryto jeszcze żadnych pierwiastków o tej magnetycznej liczbie kwantowej .
† Odkryto pierwiastki o tej magnetycznej liczbie kwantowej , ale ich konfiguracja elektronowa jest tylko przewidywaniem.
‡ konfiguracji elektronowej elementy z tym liczby kwantów magnetycznego tylko został potwierdzony przez liczbę wirowania kwantowej o +1/2 .
Jakościowe zrozumienie kształtów
Kształty orbitali atomowych można jakościowo zrozumieć, rozpatrując analogiczny przypadek fal stojących na okrągłym bębnie . Aby zobaczyć analogię, średnie przemieszczenie wibracyjne każdego kawałka membrany bębna od punktu równowagi przez wiele cykli (miara średniej prędkości i pędu membrany bębna w tym punkcie) musi być rozpatrywane w odniesieniu do odległości tego punktu od środka bębna głowa. Jeśli to przemieszczenie przyjmiemy jako analogiczne do prawdopodobieństwa znalezienia elektronu w określonej odległości od jądra, to widać, że wiele modów wibrującego dysku tworzy wzory, które śledzą różne kształty orbitali atomowych. Podstawowy powód tej korespondencji polega na tym, że rozkład energii kinetycznej i pędu w fali materii jest predyktorem tego, gdzie będzie skojarzona z falą cząstka. Oznacza to, że prawdopodobieństwo znalezienia elektronu w danym miejscu jest również funkcją średniego pędu elektronu w tym punkcie, ponieważ wysoki pęd elektronu w danej pozycji ma tendencję do „lokalizowania” elektronu w tej pozycji, poprzez właściwości elektronu pakiety falowe (patrz zasada nieoznaczoności Heisenberga dla szczegółów mechanizmu).
Ta zależność oznacza, że pewne kluczowe cechy można zaobserwować zarówno w trybach membran bębnowych, jak i orbitali atomowych. Na przykład we wszystkich trybach analogicznych do orbitali s (górny rząd na animowanej ilustracji poniżej) widać, że najsilniej drga sam środek membrany bębna, co odpowiada anty - węzłowi na wszystkich orbitalach s w atomie. . Ten anty-węzeł oznacza, że elektron najprawdopodobniej znajduje się w fizycznej pozycji jądra (przez którą przechodzi prosto bez rozpraszania lub uderzania w niego), ponieważ porusza się (średnio) najszybciej w tym punkcie, nadając mu maksymalny pęd.
Mentalny obraz „orbity planetarnej” najbliższy zachowaniu elektronów na orbitalach s , z których wszystkie nie mają momentu pędu, może być prawdopodobnie obrazem orbity Keplera z mimośrodem orbitalnym równym 1, ale skończoną osią wielką, co jest fizycznie niemożliwe (ponieważ cząstki miały się zderzyć), ale można to sobie wyobrazić jako granicę orbit o równych głównych osiach, ale zwiększającej się mimośrodowości.
Poniżej przedstawiono szereg trybów drgań membrany bębna i odpowiednie funkcje falowe atomu wodoru. Można rozważyć odpowiedniość, w której funkcje falowe wibrującej głowicy bębna są dla układu dwóch współrzędnych ( r , θ), a funkcje falowe dla wibrującej kuli mają trzy współrzędne ψ( r , θ, φ) .
- Tryby perkusyjne typu s i funkcje falowe
Żaden z pozostałych zestawów modów w membranie bębna nie ma centralnego antywęzła i we wszystkich nie porusza się środek bębna. Odpowiadają one węzłowi w jądrze dla wszystkich orbitali innych niż s w atomie. Wszystkie te orbitale mają pewien moment pędu, aw modelu planetarnym odpowiadają one cząsteczkom na orbicie o ekscentryczności mniejszej niż 1,0, tak że nie przechodzą one prosto przez środek głównego ciała, ale trzymają się nieco od niego.
Ponadto mody bębnowe analogiczne do modów p i d w atomie wykazują przestrzenną nieregularność wzdłuż różnych kierunków promieniowych od środka bębna, podczas gdy wszystkie mody analogiczne do modów s są doskonale symetryczne w kierunku promieniowym. Własności niepromienistej symetrii orbitali nie- s są niezbędne do zlokalizowania cząstki o pędzie kątowym i naturze falowej na orbicie, gdzie musi mieć tendencję do trzymania się z dala od centralnej siły przyciągania, ponieważ każda cząstka zlokalizowana jest w punkcie centralnego przyciągania nie mógł mieć momentu pędu. W tych trybach fale w głowicy bębna mają tendencję do unikania punktu centralnego. Takie cechy ponownie podkreślają, że kształty orbitali atomowych są bezpośrednią konsekwencją falowej natury elektronów.
- Tryby perkusyjne typu p i funkcje falowe
- Tryby bębna typu d
Energia orbitalna
W atomach z pojedynczym elektronem ( atomy wodoropodobne ) energia orbitalu (a co za tym idzie wszelkich elektronów na orbicie) jest określana głównie przez . Orbital najniższa energii w atomu. Każda kolejno wyższa wartość ma wyższy poziom energii, ale różnica maleje wraz ze wzrostem. Dla high poziom energii staje się tak wysoki, że elektron może łatwo uciec z atomu. W atomach jednoelektronowych wszystkie poziomy z różnymi w danym są zdegenerowane w przybliżeniu Schrödingera i mają taką samą energię. To przybliżenie jest w niewielkim stopniu złamane w rozwiązaniu równania Diraca (gdzie energia zależy od n i innej liczby kwantowej j ), oraz przez wpływ pola magnetycznego jądra i efekty elektrodynamiki kwantowej . Te ostatnie indukują niewielkie różnice w energii wiązania, szczególnie dla elektronów s, które zbliżają się do jądra, ponieważ czują one bardzo nieznacznie inny ładunek jądrowy, nawet w atomach jednoelektronowych; zobacz Przesunięcie baranka .
W atomach z wieloma elektronami energia elektronu zależy nie tylko od wewnętrznych właściwości jego orbity, ale także od jego interakcji z innymi elektronami. Oddziaływania te zależą od szczegółów rozkładu prawdopodobieństwa przestrzennego, a więc poziomy energetyczne orbitali zależą nie tylko od, ale również od . Wyższe wartości są związane z wyższymi wartościami energii; na przykład stan 2p jest wyższy niż stan 2s. Kiedy , wzrost energii orbitalu staje się tak duży, że wypycha energię orbitalu ponad energię orbitalu s w następnej wyższej powłoce; kiedy energia zostanie wepchnięta do powłoki dwa stopnie wyżej. Wypełnienie orbitali 3d nie następuje, dopóki orbitale 4s nie zostaną wypełnione.
Wzrost energii dla podpowłok o rosnącym momencie pędu w większych atomach wynika z efektów interakcji elektron-elektron i jest szczególnie związany ze zdolnością elektronów o niskim momencie pędu do bardziej efektywnej penetracji w kierunku jądra, gdzie podlegają one mniej ekranowaniu z ładunku interweniujących elektronów. Tak więc w atomach o większej liczbie atomowej coraz bardziej decydującym czynnikiem ich energii staje się liczba elektronów , a podstawowe liczby kwantowe elektronów stają się coraz mniej ważne w ich rozmieszczeniu energii.
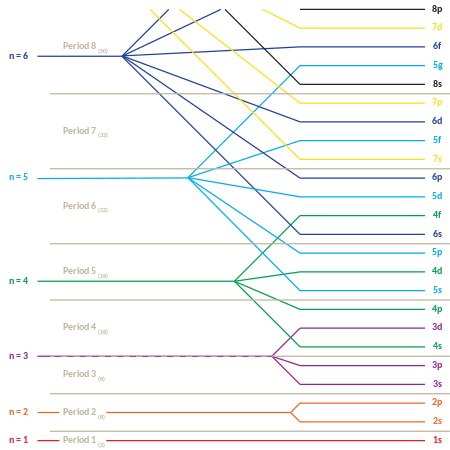
Sekwencja energetyczna pierwszych 35 podpowłok (np. 1s, 2p, 3d itd.) jest podana w poniższej tabeli. Każda komórka reprezentuje podpowłokę z i podaną odpowiednio przez jej indeksy wierszy i kolumn. Liczba w komórce to pozycja podpowłoki w sekwencji. Aby zapoznać się z liniową listą podpowłok pod względem rosnących energii w atomach wieloelektronowych, zobacz sekcję poniżej.
|
ja
n
|
s | P | D | F | g | h |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
Uwaga: puste komórki oznaczają nieistniejące podpoziomy, podczas gdy liczby zapisane kursywą wskazują podpoziomy, które mogłyby (potencjalnie) istnieć, ale które nie zawierają elektronów w żadnym obecnie znanym elemencie.
Umiejscowienie elektronów i układ okresowy pierwiastków

Umieszczanie elektronów na orbitalach reguluje kilka zasad ( konfiguracja elektronów ). Pierwsza mówi, że żadne dwa elektrony w atomie nie mogą mieć tego samego zestawu wartości liczb kwantowych (jest to zasada wykluczania Pauliego ). Te liczby kwantowe obejmują trzy, które definiują orbitale, a także s , czyli spinową liczbę kwantową . Zatem dwa elektrony mogą zajmować jeden orbital, o ile mają różne wartości s . Jednak tylko dwa elektrony, ze względu na ich spin, mogą być powiązane z każdym orbitalem.
Dodatkowo elektron zawsze ma tendencję do spadania do najniższego możliwego stanu energetycznego. Może zajmować dowolny orbital, o ile nie narusza zasady wykluczania Pauliego, ale jeśli dostępne są orbitale o niższej energii, stan ten jest niestabilny. Elektron w końcu straci energię (poprzez uwolnienie fotonu ) i spadnie na niższy orbital. W ten sposób elektrony wypełniają orbitale w kolejności określonej przez sekwencję energii podaną powyżej.
To zachowanie jest odpowiedzialne za strukturę układu okresowego . Tabela może być podzielona na kilka wierszy (zwanych „okresami”), ponumerowanych od 1 na górze. Obecnie znane elementy zajmują siedem okresów. Jeśli pewien okres ma liczbę i , składa się z pierwiastków, których skrajne elektrony padają w i- tej powłoce. Niels Bohr jako pierwszy zaproponował (1923), że okresowość właściwości pierwiastków można wyjaśnić okresowym wypełnianiem poziomów energetycznych elektronów, co skutkuje strukturą elektronową atomu.
Układ okresowy może być również podzielony na kilka ponumerowanych prostokątnych „ bloków ”. Pierwiastków należących do danego bloku mają tę wspólną cechę: elektronowej najwyższej energii, należą do tej samej £ -l -state (ale n związane z tym £ -l -state zależy od okresu). Na przykład dwie skrajne lewe kolumny tworzą „s-blok”. Najbardziej zewnętrzne elektrony Li i Be należą odpowiednio do podpowłoki 2s, a Na i Mg do podpowłoki 3s.
Poniżej znajduje się kolejność wypełniania orbitali „podpowłoki”, która również określa kolejność „bloków” w układzie okresowym:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
„Okresowy” charakter wypełniania orbitali, a także pojawianie się „bloków” s , p , d i f , jest bardziej oczywisty, jeśli ta kolejność wypełniania jest podana w formie macierzowej, przy czym wzrastające główne liczby kwantowe rozpoczynają nowe wiersze („okresy”) w macierzy. Następnie każda podpowłoka (złożona z dwóch pierwszych liczb kwantowych) jest powtarzana tyle razy, ile jest to wymagane dla każdej pary elektronów, którą może zawierać. Wynikiem jest skompresowany układ okresowy, w którym każdy wpis reprezentuje dwa kolejne elementy:
| 1s | |||||||||||||||
| 2s | 2p | 2p | 2p | ||||||||||||
| 3s | 3p | 3p | 3p | ||||||||||||
| 4s | 3d | 3d | 3d | 3d | 3d | 4p | 4p | 4p | |||||||
| 5s | 4d | 4d | 4d | 4d | 4d | 5p | 5p | 5p | |||||||
| 6s | 4f | 4f | 4f | 4f | 4f | 4f | 4f | 5d | 5d | 5d | 5d | 5d | 6p | 6p | 6p |
| 7s | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6d | 6d | 6d | 6d | 6d | 7p | 7p | 7p |
Chociaż jest to ogólna kolejność wypełniania orbity zgodnie z regułą Madelunga, istnieją wyjątki, a rzeczywiste energie elektronowe każdego pierwiastka zależą również od dodatkowych szczegółów atomów (patrz Konfiguracja elektronowa # Atomy: zasada Aufbau i reguła Madelunga ).
Liczba elektronów w elektrycznie obojętnym atomie wzrasta wraz z liczbą atomową . Elektrony w zewnętrznej powłoce, czyli elektrony walencyjne , są zwykle odpowiedzialne za zachowanie chemiczne pierwiastka. Pierwiastki zawierające taką samą liczbę elektronów walencyjnych można zgrupować i wykazywać podobne właściwości chemiczne.
Efekty relatywistyczne
Dla pierwiastków o dużej liczbie atomowej Z , efekty względności stają się bardziej wyraźne, a zwłaszcza dla elektronów s, które poruszają się z prędkościami relatywistycznymi, gdy przenikają elektrony ekranujące w pobliżu jądra atomów o wysokim Z. Ten relatywistyczny wzrost pędu dla szybkich elektronów powoduje odpowiedni spadek długości fali i skrócenie orbitali 6s w stosunku do orbitali 5d (w porównaniu z odpowiednimi elektronami s i d w lżejszych pierwiastkach w tej samej kolumnie układu okresowego); powoduje to spadek energii elektronów walencyjnych 6s.
Przykładami znaczących fizycznych skutków tego efektu jest obniżona temperatura topnienia rtęci (co wynika z braku elektronów 6s dla wiązania metalu) oraz złoty kolor złota i cezu .
W Bohra modelu An n = 1 elektronów ma prędkość danych przez , gdzie Z jest liczba atomowa jest stała drobnocząsteczkowa , a c jest prędkością światła. Dlatego w nierelatywistycznej mechanice kwantowej każdy atom o liczbie atomowej większej niż 137 wymagałby, aby jego 1s elektrony poruszały się szybciej niż prędkość światła. Nawet w równaniu Diraca , które uwzględnia efekty relatywistyczne, funkcja falowa elektronu dla atomów z jest oscylacyjna i nieograniczona . Na znaczenie pierwiastka 137, znanego również jako untriseptium , po raz pierwszy zwrócił uwagę fizyk Richard Feynman . Pierwiastek 137 jest czasami nieformalnie nazywany feynmanium (symbol Fy). Jednak przybliżenie Feynmana nie pozwala przewidzieć dokładnej krytycznej wartości Z ze względu na niepunktową naturę jądra i bardzo mały promień orbity wewnętrznych elektronów, co skutkuje potencjałem widzianym przez wewnętrzne elektrony, który jest skutecznie mniejszy niż Z . Krytycznym Z wartości, co sprawia, że atom niestabilny ze względu na rozkład pola wysokiej próżni i wytwarzania par elektron-pozytronów nie występuje dopóki Z wynosi około 173. Te warunki nie są widoczne z wyjątkiem przejściowo w kolizji bardzo dużych jądrach takich jak ołów lub uran w akceleratorach, gdzie twierdzi się, że takie wytwarzanie elektronów-pozytonów z tych efektów zostało zaobserwowane.
Nie ma węzłów w relatywistycznych gęstościach orbitalnych, chociaż poszczególne składowe funkcji falowej będą miały węzły.
hybrydyzacja pp (przypuszczalne)
Oczekuje się, że w późnym okresie 8-elementowym będzie istniała hybryda 8p 3/2 i 9p 1/2 , gdzie „3/2” i „1/2” odnoszą się do całkowitej liczby kwantowej momentu pędu . Ta hybryda „pp” może być odpowiedzialna za p-blok okresu ze względu na właściwości podobne do p podpowłok w zwykłych powłokach walencyjnych . Poziomy energii 8p 3/2 i 9p 1/2 zbliżają się do siebie z powodu relatywistycznych efektów spin-orbita ; podpowłoka 9s również powinna uczestniczyć, ponieważ oczekuje się, że te pierwiastki będą analogiczne do odpowiednich pierwiastków 5p od indu do ksenonu .
Przejścia między orbitalami
Związane stany kwantowe mają dyskretne poziomy energetyczne. W przypadku zastosowania do orbitali atomowych oznacza to, że różnice energii między stanami są również dyskretne. Przejście między tymi stanami (tj. elektron absorbujący lub emitujący foton) może zatem nastąpić tylko wtedy, gdy foton ma energię odpowiadającą dokładnej różnicy energii między wspomnianymi stanami.
Rozważ dwa stany atomu wodoru:
Stan 1) n = 1 , ℓ = 0 , m ℓ = 0 i s = +1/2
Stan 2) n = 2 , ℓ = 0 , m ℓ = 0 i s = +1/2
Według teorii kwantowej stan 1 ma stałą energię E 1 , a stan 2 ma stałą energię E 2 . Co by się stało, gdyby elektron w stanie 1 przeszedł do stanu 2? Aby tak się stało, elektron musiałby uzyskać energię dokładnie E 2 − E 1 . Jeśli elektron otrzyma energię mniejszą lub większą od tej wartości, nie może przeskoczyć ze stanu 1 do stanu 2. Załóżmy teraz, że naświetlamy atom szerokim spektrum światła. Fotony, które dotrą do atomu o energii dokładnie E 2 − E 1 zostaną pochłonięte przez elektron w stanie 1 i ten elektron przeskoczy do stanu 2. Jednak fotony o większej lub mniejszej energii nie mogą zostać wchłonięte przez elektron, ponieważ elektron może przeskoczyć tylko na jeden z orbitali, nie może przeskoczyć do stanu pomiędzy orbitalami. W rezultacie atom będzie absorbował tylko fotony o określonej częstotliwości. Tworzy to linię w widmie, znaną jako linia absorpcji, która odpowiada różnicy energii między stanami 1 i 2.
Model orbity atomowej przewiduje zatem widma liniowe, które są obserwowane eksperymentalnie. To jedna z głównych walidacji modelu orbity atomowej.
Model orbity atomowej jest jednak przybliżeniem do pełnej teorii kwantowej, która rozpoznaje tylko wiele stanów elektronowych. Przewidywania widm liniowych są przydatne jakościowo, ale nie są ilościowo dokładne dla atomów i jonów innych niż zawierające tylko jeden elektron.
Zobacz też
Uwagi
Bibliografia
- McCaw, Charles S. (2015). Orbitale: z aplikacjami w widmach atomowych . Singapur: World Scientific Publishing Company. Numer ISBN 9781783264162.
- Tipler, Paweł; Llewellyn, Ralph (2003). Fizyka współczesna (4 wyd.). Nowy Jork: WH Freeman and Company. Numer ISBN 978-0-7167-4345-3.
- Scerri, Eric (2007). Układ okresowy pierwiastków, jego historia i znaczenie . Nowy Jork: Oxford University Press. Numer ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Chemia kwantowa (wyd. 7). Edukacja Pearsona. Numer ISBN 978-0-321-80345-0.
- Griffiths, Dawid (2000). Wprowadzenie do mechaniki kwantowej (2 wyd.). Benjamina Cummingsa. Numer ISBN 978-0-13-111892-8.
- Cohena, Irwina; Drop, Tomasz (1966). „Orbitale atomowe: ograniczenia i wariacje”. J.Chem. eduk . 43 (4): 187. Kod Bib : 1966JChEd..43..187C . doi : 10.1021/ed043p187 .
Zewnętrzne linki
- Orbitale wodorowe 3D na Wikimedia Commons
- Przewodnik po orbitalach atomowych
- Wiązania kowalencyjne i struktura molekularna
- Animacja ewolucji czasowej orbitalu hydrogenicznego
- Orbitron , wizualizacja wszystkich powszechnych i nietypowych orbitali atomowych, od 1s do 7g
- Wielki stół Nieruchome obrazy wielu orbitali