Zasada Aufbaua - Aufbau principle
| Część serii na |
| Układ okresowy pierwiastków |
|---|
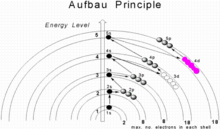
Zasada aufbau , z niemieckiego Aufbauprinzip ( zasada budowania ), zwana także zasadą aufbau , mówi, że w stanie podstawowym atomu lub jonu elektrony wypełniają podpowłoki o najniższej dostępnej energii, a następnie wypełniają podpowłoki o wyższej energii. Na przykład podpowłoka 1s jest wypełniana przed zajęciem podpowłoki 2s. W ten sposób elektrony atomu lub jonu tworzą najbardziej stabilną możliwą konfigurację elektronową . Przykładem jest konfiguracja 1s 2 2s 2 2p 6 3s 2 3p 3 dla atomu fosforu , co oznacza, że podpowłoka 1s ma 2 elektrony i tak dalej.
Zachowanie elektronów jest opracowany przez innych zasad fizyki atomowej , takich jak reguły Hund za i zakaz Pauliego . Reguła Hunda mówi, że jeśli dostępnych jest wiele orbitali o tej samej energii , elektrony będą zajmować różne orbitale pojedynczo, zanim jakikolwiek z nich zostanie zajęty podwójnie. Jeśli wystąpi podwójne zajęcie, zasada Pauliego wymaga, aby elektrony zajmujące ten sam orbital miały różne spiny (+1/2 i -1/2).
Gdy przechodzimy od jednego pierwiastka do drugiego o kolejnej wyższej liczbie atomowej, za każdym razem do neutralnego atomu dodawany jest jeden proton i jeden elektron. Maksymalna liczba elektronów w dowolnej powłoce to 2 n 2 , gdzie n jest główną liczbą kwantową . Maksymalna liczba elektronów w podpowłoce (s, p, d lub f) jest równa 2(2ℓ+1), gdzie ℓ = 0, 1, 2, 3... Zatem te podpowłoki mogą mieć maksymalnie 2, 6, 10 i 14 elektronów. W stanie podstawowym konfigurację elektronową można zbudować, umieszczając elektrony w najniższej dostępnej podpowłoce, aż całkowita liczba dodanych elektronów będzie równa liczbie atomowej. W ten sposób podpowłoki są wypełniane w kolejności rosnącej energii, przy użyciu dwóch ogólnych zasad, aby pomóc przewidzieć konfiguracje elektroniczne:
- 1. Elektrony są przypisane do podpowłoki w kolejności rosnącej wartości (n+ℓ).
- 2. Dla podpowłok o tej samej wartości (n+ℓ), elektrony są najpierw przypisywane do podpowłoki o niższym n .
Wersja zasady aufbau znana jako model powłoki jądrowej służy do przewidywania konfiguracji protonów i neutronów w jądrze atomowym .
Zasada porządkowania energii Madelung
W atomach obojętnych przybliżoną kolejność wypełniania podpowłok określa reguła n + ℓ , znana również jako:
- Reguła Madelunga (po Erwin Madelung )
- Rządy Janet (po Charles Janet )
- Rządy Klechkowskiego (po Wsiewołodzie Klechkowskim )
- Rządy Wiswessera (za Williamem Wiswesserem )
- przybliżenie aufbau
- Ścieżka wujka Wiggly'ego lub
- reguła przekątna
Tu n reprezentuje główną liczbę kwantową i £ -l azymutalny liczbą kwantową ; wartości ℓ = 0, 1, 2, 3 odpowiadają odpowiednio etykietom s , p , d i f . Kolejność podpowłok według tej reguły to 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s, 5g, . .. Na przykład tytan ( Z = 22) ma konfigurację stanu podstawowego 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 .
Inni autorzy piszą podpowłokę zawsze w kolejności rosnącej n, na przykład Ti (Z = 22) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 . Można to nazwać „porządkiem opuszczenia”, ponieważ jeśli ten atom jest zjonizowany, elektrony opuszczają mniej więcej w kolejności 4s, 3d, 3p, 3s itd. Dla danego neutralnego atomu te dwie notacje są równoważne, ponieważ tylko zajętości podpowłok mają znaczenie.
Podpowłoki o niższej wartości n + ℓ są wypełniane przed podpowłokami o wyższych wartościach n + ℓ . W przypadku równych wartości n + ℓ podpowłoka z mniejszą wartością n jest wypełniana jako pierwsza. Zasada porządkowania energii Madelunga dotyczy tylko neutralnych atomów w ich stanie podstawowym. Istnieje dwadzieścia elementów (jedenaście w bloku d i dziewięć w bloku f), dla których reguła Madelunga przewiduje konfigurację elektronową, która różni się od określonej eksperymentalnie, chociaż przewidywane przez Madelunga konfiguracje elektronowe są co najmniej zbliżone do stanu podstawowego nawet w tych przypadkach.
Jeden podręcznik chemii nieorganicznej opisuje regułę Madelunga jako zasadniczo przybliżoną regułę empiryczną, chociaż z pewnym uzasadnieniem teoretycznym, opartą na modelu atomu Thomasa-Fermiego jako wieloelektronowego układu kwantowo-mechanicznego.
Wyjątki w d-block
Wartościowość D-podpowłoką „pożycza sobie” elektronu (w przypadku palladu dwoma elektronami) od wartościowości s-podpowłoki.
Szczególnym wyjątkiem jest lawrencium 103 Lr, gdzie elektron 6d przewidziany przez regułę Madelunga jest zastąpiony elektronem 7p: reguła przewiduje [Rn]5f 14 6d 1 7s 2 , ale zmierzona konfiguracja to [Rn]5f 14 7s 2 7p 1 .
| Atom | 24 kr | 29 Cu | 41 Nb | 42 mies | 44 Ruy | 45 Rh | 46 Pd | 47 Ag | 78 pkt | 79 Au | 103 Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Elektrony rdzeniowe | [Ar] | [Ar] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Xe]4f 14 | [Xe]4f 14 | [Rn]5f 14 |
| Reguła Madelunga | 3d 4 4s 2 | 3d 9 4s 2 | 4d 3 5s 2 | 4d 4 5s 2 | 4d 6 5s 2 | 4d 7 5s 2 | 4d 8 5s 2 | 4d 9 5s 2 | 5d 8 6s 2 | 5d 9 6s 2 | 6d 1 7s 2 |
| Eksperyment | 3d 5 4s 1 | 3d 10 4s 1 | 4d 4 5s 1 | 4d 5 5s 1 | 4d 7 5s 1 | 4d 8 5s 1 | 4d 10 | 4d 10 5s 1 | 5d 9 6s 1 | 5d 10 6s 1 | 7s 2 7p 1 |
Na przykład w miedzi 29 Cu, zgodnie z regułą Madelunga, podpowłoka 4s ( n + ℓ = 4 + 0 = 4) jest zajęta przed podpowłoką 3d ( n + ℓ = 3 + 2 = 5). Reguła następnie przewiduje konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 , w skrócie [Ar]3d 9 4s 2 gdzie [Ar] oznacza konfigurację argonu , poprzedzającego gazu szlachetnego. Jednak zmierzona konfiguracja elektronowa atomu miedzi to [Ar]3d 10 4s 1 . Wypełniając podpowłokę 3d, miedź może znajdować się w niższym stanie energetycznym.
Wyjątki w bloku f
Walencyjna podpowłoka d często „pożycza” jeden elektron (w przypadku toru dwa elektrony) z walencyjnej podpowłoki f. Na przykład w uranu 92 U, zgodnie z regułą Madelunga, podpowłoka 5f ( n + ℓ = 5 + 3 = 8) jest zajęta przed podpowłoką 6d ( n + ℓ = 6 + 2 = 8). Reguła następnie przewiduje konfigurację elektronową [Rn]5f 4 7s 2 gdzie [Rn] oznacza konfigurację radonu , poprzedzającego gazu szlachetnego. Jednak zmierzona konfiguracja elektronowa atomu uranu to [Rn]5f 3 6d 1 7s 2 .
| Atom | 57 La | 58 Ce | 64 Gd | 89 Ac | 90 Th | 91 Pa | 92 godz | 93 Np | 96 cm² |
|---|---|---|---|---|---|---|---|---|---|
| Elektrony rdzeniowe | [Xe] | [Xe] | [Xe] | [Rn] | [Rn] | [Rn] | [Rn] | [Rn] | [Rn] |
| Reguła Madelunga | 4f 1 6s 2 | 4f 2 6s 2 | 4f 8 6s 2 | 5f 1 7s 2 | 5f 2 7s 2 | 5f 3 7s 2 | 5f 4 7s 2 | 5f 5 7s 2 | 5f 8 7s 2 |
| Eksperyment | 5d 1 6s 2 | 4f 1 5d 1 6s 2 | 4f 7 5d 1 6s 2 | 6d 1 7s 2 | 6d 2 7s 2 | 5f 2 6d 1 7s 2 | 5f 3 6d 1 7s 2 | 5f 4 6d 1 7s 2 | 5f 7 6d 1 7s 2 |
Wszystkie te wyjątki nie mają dużego znaczenia dla chemii, ponieważ różnice energii są dość małe, a obecność pobliskiego atomu może zmienić preferowaną konfigurację. Układ okresowy ignoruje je i podąża za wyidealizowanymi konfiguracjami. Występują w wyniku międzyelektronicznych efektów odpychania; kiedy atomy są zjonizowane dodatnio, większość anomalii znika.
Przewiduje się, że powyższe wyjątki będą jedynymi aż do elementu 120 , w którym powłoka 8s jest ukończona. Wyjątkiem powinien być pierwiastek 121 rozpoczynający g-blok, w którym oczekiwany elektron 5g jest przenoszony na 8p (podobnie jak lawrencjum). Po tym, źródła nie zgadzają się co do przewidywanych konfiguracji, ale ze względu na bardzo silne efekty relatywistyczne nie oczekuje się, że będzie dużo więcej elementów, które pokazują oczekiwaną konfigurację z reguły Madelunga poza 120. Ogólna idea, że po dwóch elementach 8s obszary o aktywności chemicznej 5g, następnie 6f, następnie 7d, a następnie 8p, jednak w większości wydają się być prawdziwe, z wyjątkiem tego, że teoria względności "rozdziela" powłokę 8p na ustabilizowaną część (8p 1/2 , która zachowuje się jak dodatkowa powłoka przykrywająca wraz z 8s i powoli zatopiona w rdzeniu w seriach 5g i 6f) i zdestabilizowana część (8p 3/2 , która ma prawie taką samą energię jak 9p 1/2 ), a powłoka 8s dostaje zastąpiona powłoką 9s jako powłoką s dla elementów 7d.
Historia
Zasada aufbau w nowej teorii kwantowej

Zasada wzięła swoją nazwę od niemieckiego Aufbauprinzip , „zasada budowania”, a nie nazwana od nazwiska naukowca. Sformułowali go Niels Bohr i Wolfgang Pauli na początku lat dwudziestych. Było to wczesne zastosowanie mechaniki kwantowej do właściwości elektronów i wyjaśnienie właściwości chemicznych w kategoriach fizycznych . Każdy dodany elektron podlega działaniu pola elektrycznego wytworzonego przez dodatni ładunek jądra atomowego i ujemny ładunek innych elektronów związanych z jądrem. Chociaż w wodorze nie ma różnicy energii między podpowłoką o tej samej głównej liczbie kwantowej n , nie dotyczy to zewnętrznych elektronów innych atomów.
W starej teorii kwantowej sprzed mechaniki kwantowej elektrony miały zajmować klasyczne orbity eliptyczne. Orbity o najwyższym momencie pędu są "orbitami kołowymi" poza wewnętrznymi elektronami, ale orbity o niskim momencie pędu ( s - i p - podpowłoka) mają dużą mimośrodowość podpowłoki , dzięki czemu zbliżają się do jądra i odczuwają średnio mniej silnie ekranowany ładunek jądrowy.
N + ℓ reguła zamawiania energia
Układ okresowy pierwiastków, w którym każdy wiersz odpowiada jednej wartości n + ℓ (gdzie wartości n i ℓ odpowiadają odpowiednio głównym i azymutalnym liczbom kwantowym) został zaproponowany przez Charlesa Janeta w 1928 r., a w 1930 r. tego wzorca, opartego na znajomości stanów podstawowych atomów, określonych przez analizę widm atomowych. Ta tabela zaczęła być określana jako tabela lewego kroku. Janet „dostosował” niektóre z rzeczywistych wartości n + ℓ pierwiastków, ponieważ nie były one zgodne z jego regułą porządkowania energii, i uznał, że występujące rozbieżności musiały wynikać z błędów pomiarowych. W każdym razie rzeczywiste wartości były prawidłowe, a reguła uporządkowania energii n + ℓ okazała się raczej przybliżeniem niż idealnym dopasowaniem, chociaż dla wszystkich pierwiastków będących wyjątkami konfiguracja uregulowana jest niskoenergetycznym stanem wzbudzonym, który jest w zasięgu ręki energii wiązań chemicznych.
W 1936 roku niemiecki fizyk Erwin Madelung zaproponował to jako empiryczną regułę dla kolejności wypełniania podpowłok atomowych i dlatego większość źródeł anglojęzycznych odnosi się do reguły Madelunga. Madelung mógł być świadomy tego wzoru już w 1926 r. W 1945 r. William Wiswesser zaproponował, aby podpowłoki były wypełniane w kolejności rosnących wartości funkcji
W 1962 r. rosyjski chemik rolniczy VM Klechkowski zaproponował pierwsze teoretyczne wyjaśnienie znaczenia sumy n + ℓ (tzn. wypełnienie powłok elektronowych w kolejności rosnącej n + ℓ ), oparte na statystycznym modelu atomu Thomasa-Fermiego . Wiele źródeł francusko- i rosyjskojęzycznych odwołuje się zatem do reguły Klechkowskiego. W 1979 r. D. Pan Wong przedstawił teoretyczne uzasadnienie dla drugiej części reguły Madelunga (że dla dwóch podpowłok o tej samej wartości n + ℓ , ta z mniejszą wartością n wypełnia jako pierwsza).
W ostatnich latach zauważono, że kolejność wypełniania podpowłok w atomach obojętnych nie zawsze odpowiada kolejności dodawania lub usuwania elektronów dla danego atomu. Na przykład, w czwartym wierszu układu okresowego , reguła Madelunga wskazuje, że podpowłoka 4s jest zajęta przed 3d. Konfiguracje stanu podstawowego neutralnego atomu to zatem K = (Ar)4s, Ca = (Ar)4s 2 , Sc = (Ar)4s 2 3d, itd. Jednakże, jeśli atom skandu jest zjonizowany przez usunięcie elektronów (tylko), konfiguracje to Sc = (Ar)4s 2 3d, Sc + = (Ar)4s3d, Sc 2+ = (Ar)3d. Energie podpowłoki i ich kolejność zależą od ładunku jądrowego; 4s jest niższe niż 3d zgodnie z regułą Madelunga w K z 19 protonami, ale 3d jest niższe w Sc 2+ z 21 protonami. Reguła Madelunga powinna być używana tylko do neutralnych atomów.
Oprócz tego, że istnieje wiele dowodów eksperymentalnych na poparcie tego poglądu, sprawia to, że wyjaśnienie kolejności jonizacji elektronów w tym i innych metalach przejściowych jest bardziej zrozumiałe, biorąc pod uwagę, że elektrony 4S są niezmiennie preferencyjnie zjonizowane.
Zobacz też
Bibliografia
Dalsza lektura
- Obraz: Zrozumienie kolejności napełniania muszli
- Boeyens, JCA : Chemia od pierwszych zasad . Berlin: Springer Science 2008, ISBN 978-1-4020-8546-8
- Ostrowskiego, VN (2005). „Na niedawnej dyskusji dotyczącej uzasadnienia kwantowego układu okresowego pierwiastków”. Podstawy Chemii . 7 (3): 235–39. doi : 10.1007/s10698-005-2141-y . S2CID 93589189 .
- Kitagawara, Y.; Barut, AO (1984). „O dynamicznej symetrii układu okresowego. II. Zmodyfikowany model atomowy Demkowa-Ostrowskiego”. J. Fiz. B . 17 (21): 4251–59. Kod Bib : 1984JPhB...17.4251K . doi : 10.1088/0022-3700/17/21/013 .
- Vanquickenborne, LG (1994). „Metale przejściowe i zasada Aufbau” (PDF) . Journal of Chemical Education . 71 (6): 469–471. Kod Bibcode : 1994JChEd..71..469V . doi : 10.1021/ed071p469 .
- Scerri, ER (2017). „Na regule Madelunga” . Wnioskowanie . 1 (3).