Mięsisty, mięsisty peptyd - Beefy meaty peptide
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
(2 S ,5 S ,8 S ,11 S ,14 S ,17 S )-17-{2-[( 2S )-2,6-Diaminoheksanamido]acetamido}-8-(hydroksymetylo)-11,14- kwas bis(3-hydroksy-3-oksopropylo)-2-metylo-5-(2-metylopropylo)-4,7,10,13,16-pentaokso-3,6,9,12,15-pentaazanonadekanodiowy |
|
| Inne nazwy
Pyszny peptyd; BMP; BMP (peptyd); L -Lysylglycyl- L -a-aspartylu L -α-glutamylu L -α-glutamylu L -serylo- L -leucyl- L -alanina; KGDEESLA
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C 34 H 57 N 9 O 16 | |
| Masa cząsteczkowa | 847.877 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Beefy mięsisty peptyd , znany również jako pyszny peptyd i w skrócie BMP , to peptyd o długości 8 aminokwasów , który został zidentyfikowany jako nadający mięsisty smak żywności, w której jest obecny. Został wyizolowany z zupy wołowej przez Yamasaki i Maekawę w 1978 roku. Trwające od czasu odkrycia przez Yamasaki i Maekawę badania dostarczyły ogólnych dowodów na obecność jego właściwości nadających smak. Jednak ze względu na wysoki koszt produkcji, potencjał peptydu do szerokiego zastosowania w przemyśle spożywczym nie został jeszcze zrealizowany, co skłania obecne wysiłki badawcze do skupienia się na znalezieniu metody masowej produkcji peptydu.
Identyfikacja
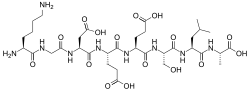
Sekwencja
Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala
Pierwszorzędową strukturę po raz pierwszy określili Yamasaki i Maekawa, którzy przeprowadzili eksperyment z wykorzystaniem metody degradacji Edmana do sekwencjonowania N-końca i karboksypeptydazy A (Cpaza A) oraz triazyny do sekwencjonowania C-końca . W czasie eksperymentu (1978), obie metody były stosowane w celu określenia składu aminokwasowego i kolejności sekwencji, w tym odkrycia wiązania Glu-Glu i wykrycia alaniny na C-końcu. Jednak obecnie każda technika jest wystarczająca do sekwencjonowania całego peptydu.
Produkcja smaku umami
Na poziomie molekularnym smak umami jest rejestrowany, gdy cząsteczki, takie jak glutaminian i asparaginian, wiążą się z domenami wiążącymi ligandy wyspecjalizowanych receptorów smaku. Po aktywacji receptory te wysyłają impulsy elektryczne, które docierają do mózgu za pośrednictwem neuronów czuciowych. W 1989 Tamura i in. stwierdzili, że same reszty zasadowe, takie jak Lys-Gly i Lys-Lys, dają kwaśny i słony smak w postaci dichlorowodorku, podczas gdy reszty kwasowe, takie jak Asp-Glu-Glu i Lys-Gly, dają kwaśny i słodki smak. Jednak smak umami jest wytwarzany przez połączenie kwaśnych i zasadowych reszt aminokwasowych, takich jak Lys-Gly-Asp. Dokładniej, smak umami występujący w BMP jest generowany przez połączenie lizyny na końcu N i aminokwasów kwasowych (Asp-Glu-Glu) w środkowej części peptydu, co sugeruje, że kationy i aniony odgrywają rolę w stymulacja receptorów smaku w celu wytworzenia smaku umami.
Jednak inne czynniki poza obecnością niektórych aminokwasów mogą wpływać na odpowiedź smakową peptydu. Intensywność smaku umami wzrasta, gdy kwasowy peptyd wchodzi w interakcję z kationami tworząc sól. Przy wartości progowej 1,25 milimolowej (mM) dipeptyd Asp-Glu wytwarza najsilniejszy smak umami po wystawieniu na działanie NaOH i poddaniu wzrostowi pH. Pozycja aminokwasów również odgrywa rolę w intensywności smaku, ponieważ dipeptyd Glu-Asp rejestruje się przy wartości progowej 3,14 mM, co oznacza, że potrzebowałby większej ilości związku, aby osoba mogła zarejestrować smak umami. Dodatkowo, podczas gdy analog Lys-Gly-HCl zarejestrowałby słony smak umami przy 1,22 mM, analog Gly-Lys-HCl zarejestrowałby kwaśny i słodki smak przy 5,48 mM. Zatem wyniki badań wskazują, że smak i moc można modyfikować poprzez modyfikację reszt kwasowych w peptydach, co otwiera możliwości produkcji peptydów BMP-podobnych o większej intensywności smaku. Chociaż jego intensywność smaku nie zmienia się w zależności od pH, opisano, że BMP wytwarza różne smaki w zależności od zmian pH. Warto zauważyć, że jest kwaśny przy pH 3,5, umami przy pH 6,5 i słodki, kwaśny i umami przy pH 9,5.
Możliwość zastosowania w rzeczywistych zastosowaniach
Wykazano, że BMP pozostaje stabilny, bez rozpadu, w warunkach pasteryzacji i sterylizacji w wysokiej temperaturze, co umożliwia potencjalne wykorzystanie do celów kulinarnych. Osoby opowiadające się za obecnością wzmacniającego smak smaku umami BMP donoszą, że jego smak jest podobny do smaku glutaminianu sodu. W związku z tym BMP posiada potencjał do komercjalizacji na dużą skalę w przemyśle spożywczym. Jednak główną przeszkodą jest koszt masowej produkcji związany z peptydem. Obecnie głównymi sposobami produkcji określonych peptydów smakowych, takich jak BMP, są synteza chemiczna i enzymatyczna, które wiążą się z wysokimi kosztami produkcji.
