Aldehyd benzowy - Benzaldehyde
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Nazwa IUPAC
Benzenokarbaldehyd
|
|||
|
Preferowana nazwa IUPAC
Benzenokarbaldehyd |
|||
| Inne nazwy
Benzenokarboksyaldehyd
Fenylometanal Aldehyd benzoesowy |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.002.601 |
||
| Numer WE | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS | |||
| UNII | |||
| Numer ONZ | 1990 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 7 H 6 O | |||
| Masa cząsteczkowa | 106,124 g·mol -1 | ||
| Wygląd | bezbarwna ciecz silnie refrakcyjna |
||
| Zapach | przypominający migdał | ||
| Gęstość | 1,044 g/ml, ciecz | ||
| Temperatura topnienia | -57,12 ° C (-70,82 ° F; 216,03 K) | ||
| Temperatura wrzenia | 178,1 ° C (352,6 ° F; 451,2 K) | ||
| 6,95 g/l (25°C) | |||
| log P | 1.64 | ||
| -60,78 x 10 -6 cm 3 / mol | |||
|
Współczynnik załamania ( n D )
|
1,5456 | ||
| Lepkość | 1,321 cP (25°C) | ||
| Termochemia | |||
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
-36,8 kJ/mol | ||
|
Standardowa entalpia
spalania (Δ c H ⦵ 298 ) |
-3525.1 kJ/mol | ||
| Zagrożenia | |||
| Arkusz danych dotyczących bezpieczeństwa | JT Baker | ||
| Piktogramy GHS |

|
||
| Hasło ostrzegawcze GHS | Ostrzeżenie | ||
| H302 | |||
| P264 , P270 , P301+312 , P330 , P501 | |||
| NFPA 704 (ognisty diament) | |||
| Temperatura zapłonu | 64 ° C (147 ° F; 337 K) | ||
| 192 ° C (378 ° F; 465 K) | |||
| Granice wybuchowości | 1,4-8,5% | ||
| Dawka lub stężenie śmiertelne (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
1300 mg/kg (szczur, doustnie) | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
Alkohol benzylowy Kwas benzoesowy |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Benzaldehyd (C 6 H 5 CHO) jest związek organiczny, składa się z benzenowym pierścieniem z formylo podstawnik. Jest to najprostszy aromatyczny aldehyd i jeden z najbardziej użytecznych przemysłowo.
Jest to ciecz bezbarwna charakterystycznym migdałowym -jak zapachu . Główny składnik olejku z gorzkich migdałów , benzaldehyd, można pozyskać z wielu innych naturalnych źródeł. Syntetyczny benzaldehyd jest substancją aromatyzującą w ekstrakcie z imitacji migdałów, która jest używana do aromatyzowania ciast i innych wypieków.
Historia
Benzaldehyd został po raz pierwszy wyekstrahowany w 1803 roku przez francuskiego aptekarza Martrèsa. Jego eksperymenty koncentrowały się na wyjaśnieniu natury amigdaliny , trującego materiału znajdującego się w gorzkich migdałach , owocu Prunus dulcis . Dalsze prace nad olejem prowadzone przez dwóch francuskich chemików Pierre'a Robiqueta i Antoine'a Boutron-Charlarda doprowadziły do wytworzenia benzaldehydu. W 1832 roku Friedrich Wöhler i Justus von Liebig po raz pierwszy zsyntetyzowali benzaldehyd.
Produkcja
Od 1999 roku produkowano 7000 ton syntetycznego i 100 ton naturalnego benzaldehydu rocznie. Faza ciekła chlorowania i utleniania z toluenu są główne szlaki. Opracowano wiele innych metod, takich jak częściowe utlenianie alkoholu benzylowego , alkaliczna hydroliza chlorku benzolu i karbonylowanie benzenu.
Znaczna ilość naturalnego benzaldehydu jest wytwarzana z aldehydu cynamonowego otrzymanego z oleju kasja w reakcji retroaldolowej : aldehyd cynamonowy jest podgrzewany w roztworze wodno - alkoholowym o temperaturze od 90 °C do 150 °C z użyciem zasady (najczęściej węglanu lub wodorowęglanu sodu ) przez 5 do 80 godzin, po czym następuje destylacja utworzonego benzaldehydu. Ta reakcja daje również aldehyd octowy . Naturalny status uzyskanego w ten sposób benzaldehydu budzi kontrowersje. Niektóre inne produkty spożywcze poddawane są niezaprzeczalnie większym warunkom reaktywności, jak np. mąka masowa, którą wytwarza się przez traktowanie mąki kukurydzianej wodorotlenkiem sodu (ługiem). Kiedy żywność jest gotowana, często ulega ona zmianie pod wpływem warunków katalitycznego utleniania podczas gotowania, które mogą nawet nadać pewną ilość toksyczności (choć nieistotnej). Mimo to poddanie aldehydu cynamonowego reakcji retro aldolowej jest bez wątpienia chemiczną konwersją w odrębny związek chemiczny.
„Strona specyficzne spektroskopii jądrowego rezonansu magnetycznego ”, który oblicza 1 / H 2 stosunki izotopów H, stosowano do różnicowania między naturalnie występujących i syntetycznych benzaldehydu.
Występowanie
Benzaldehyd i podobne chemikalia występują naturalnie w wielu produktach spożywczych. Większość spożywanego przez ludzi benzaldehydu pochodzi z naturalnych pokarmów roślinnych, takich jak migdały .
Migdały, morele , jabłka i pestki wiśni zawierają znaczne ilości amigdaliny . Ten glikozyd rozpada się pod wpływem katalizy enzymatycznej na benzaldehyd, cyjanowodór i dwa równoważniki glukozy .
Benzaldehyd przyczynia się do zapachu boczniaków ( Pleurotus ostreatus ).
Reakcje
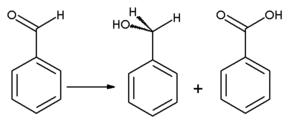
Benzaldehyd można utlenić do kwasu benzoesowego ; w rzeczywistości „[B]enzaldehyd łatwo ulega samoutlenieniu, tworząc kwas benzoesowy pod wpływem powietrza w temperaturze pokojowej”, powodując powszechne zanieczyszczenie w próbkach laboratoryjnych. Ponieważ temperatura wrzenia kwasu benzoesowego jest znacznie wyższa niż benzaldehydu, można go oczyszczać przez destylację . Alkohol benzylowy można wytworzyć z benzaldehydu przez uwodornienie . Reakcja benzaldehydu z bezwodnym octanem sodu i bezwodnikiem octowym daje kwas cynamonowy , podczas gdy alkoholowy cyjanek potasu może być użyty do katalizowania kondensacji benzaldehydu do benzoiny . Benzaldehyd ulega dysproporcjonowaniu pod wpływem stężonych zasad ( reakcja Cannizzaro ): jedna cząsteczka aldehydu jest redukowana do alkoholu benzylowego, a druga cząsteczka jest jednocześnie utleniana do kwasu benzoesowego .
Z diolami, w tym wieloma cukrami, benzaldehyd kondensuje, tworząc acetale benzylidenowe .
Zastosowania
Benzaldehyd jest powszechnie stosowany do nadawania migdałowego smaku żywności i produktom zapachowym. Czasami jest używany w produktach kosmetycznych.
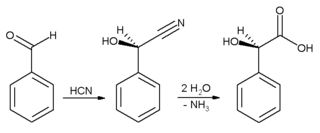
W warunkach przemysłowych benzaldehyd jest używany głównie jako prekursor innych związków organicznych, od farmaceutyków po dodatki do tworzyw sztucznych. Barwnik aniliny malachit wytwarza się z benzaldehydu i dimetyloanilina . Benzaldehyd jest również prekursorem niektórych barwników akrydynowych . W wyniku kondensacji aldolowej benzaldehyd jest przekształcany w pochodne aldehydu cynamonowego i styrenu . Synteza kwasu migdałowego rozpoczyna się od dodania kwasu cyjanowodorowego do benzaldehydu:
Powstała cyjanohydryna jest hydrolizowana do kwasu migdałowego . (Powyższy schemat przedstawia tylko jeden z dwóch utworzonych enancjomerów ).
Zastosowania niszowe
Jako środek odstraszający pszczoły stosuje się Benzaldehyd . Niewielką ilość roztworu benzaldehydu umieszcza się na wyciągu w pobliżu plastrów miodu. Następnie pszczoły odsuwają się od plastrów miodu, aby uniknąć oparów. Beekeeper można następnie usunąć ramki miodu z ula pszczelego mniejsze ryzyko dla obu pszczół i pszczelarza.
Dodatkowo, benzaldehyd jest również stosowany jako substancja smakowa w strąkach e-papierosów JUUL , w szczególności w odmianach „Cool Mint”, „Cool Cucumber” i „Fruit Medley”. Stężenie jest stosunkowo niskie, około 1 μg/ml.
Bezpieczeństwo
Stosowany w żywności, kosmetykach, farmaceutykach i mydle, benzaldehyd jest „ogólnie uważany za bezpieczny” ( GRAS ) przez amerykańską FDA i FEMA . Status ten został potwierdzony po przeglądzie w 2005 roku. Jest akceptowany w Unii Europejskiej jako środek aromatyzujący. Badania toksykologiczne wskazują, że jest bezpieczny i nierakotwórczy w stężeniach stosowanych w żywności i kosmetykach, a nawet może mieć właściwości przeciwrakotwórcze (przeciwrakowe).
Dla człowieka o wadze 70 kg śmiertelną dawkę szacuje się na 50 ml. Dopuszczalna dzienna dawka 15 mg / dzień został uznany za benzaldehydu przez Agencję Ochrony Środowiska Stanów Zjednoczonych . Benzaldehyd nie kumuluje się w tkankach ludzkich. Jest metabolizowany, a następnie wydalany z moczem.
Bibliografia
Linki zewnętrzne
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0102
- Raport ze wstępnej oceny SIDS dla benzaldehydu z Organizacji Współpracy Gospodarczej i Rozwoju (OECD) zarchiwizowany
- Opis benzaldehydu na ChemicalLand21.com
- ChemSub Online: Benzaldehyde.
- Projekt dotyczący rakotwórczości