Beta-peptyd - Beta-peptide
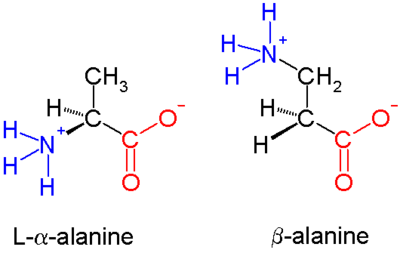
β-peptydy to peptydy pochodzące z β-aminokwasów. Rodzic beta-aminokwasów oznacza H 2 NCH 2 CH 2 CO 2 h, ale większość przykładów posiadają podstawniki zamiast jednego lub więcej wiązań CH. Jedynym powszechnie występującym β-aminokwasem jest β-alanina . Generalnie β-peptydy nie występują w naturze. Antybiotyki oparte na peptydach β są badane jako sposoby na uniknięcie oporności na antybiotyki . Wczesne badania w tej dziedzinie zostały opublikowane w 1996 roku przez grupę Dietera Seebacha i Samuela Gellmana.
Synteza
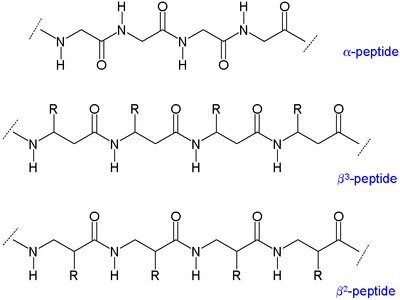
Dwa podstawowe typy p peptydów istnieje: osoby z pozostałości organicznej (R) obok aminy o nazwie β 3 -peptydy i te położeniu obok grupy karbonylowej nazywane β 2 -peptydy.
β-Aminokwasy wytworzono wieloma drogami, w tym niektóre oparte na syntezie Arndta-Eisterta .
Struktura drugorzędna
Ponieważ ich szkielety są dłuższe niż normalne peptydy , β- peptydy tworzą odrębne struktury drugorzędowe . W alkilowych podstawników w obu pozycjach alfa i beta w p aminowej za kwasowy gauche konformacji o wiązanie między grupą a-węglu i P-węgiel. Wpływa to również na stabilność termodynamiczną konstrukcji.
Doniesiono o wielu typach struktur helisy składających się z peptydów β. Te typy konformacji różnią się liczbą atomów w pierścieniu związanym wiązaniem wodorowym , który powstaje w roztworze; Zgłaszano przypadki 8-helis, 10-helix, 12-helix, 14-helix i 10/12-helix. Ogólnie rzecz biorąc, peptydy β tworzą bardziej stabilną helisę niż peptydy α.
Potencjał kliniczny
β-peptydy są stabilne wobec degradacji proteolitycznej in vitro i in vivo , co stanowi potencjalną przewagę nad naturalnymi peptydami. β-Peptydy stosowano do naśladowania naturalnych antybiotyków opartych na peptydach , takich jak magininy , które są bardzo silne, ale trudne w użyciu jako leki, ponieważ są rozkładane przez enzymy proteolityczne.
Lista
Istnieje 8 form beta: formy alaniny, leucyny, lizyny, argininy, glutaminianu, glutaminy, fenyloalaniny, tyrozyny. Kwas asparaginowy jest uważany zarówno za formę beta, jak i alfa, chociaż forma beta znajduje się w mikrocystynach .