Blaise reakcji - Blaise reaction
| Reakcję blaise | |
|---|---|
| Nazwany po | Edmond E. Blaise |
| typ reakcji | Reakcję sprzęgania |
| identyfikatory | |
| Chemia organiczna Portal | blaise reakcja |
| RSC ontologia ID | RXNO: 0000237 |
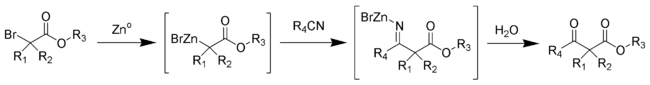
Reakcji Blaise jest reakcji organicznej , która tworzy P-ketoestru w reakcji z cynkiem metalu z a-bromoester i nitrylu . Reakcja była po raz pierwszy opisana przez Edmond Blaise'em (1872-1939) w 1901 ostatni produkt pośredni jest metaloimine, który następnie hydrolizuje się z wytworzeniem pożądanego P-ketoestru.
Nieporęczne alifatyczne estry często dają wyższe plony. Steven Hannick i Yoshito Kishi opracowali ulepszoną procedurę.
Stwierdzono, że wolne grupy hydroksylowe mogą być tolerowane w trakcie tej reakcji, co jest nieoczekiwane dla reakcji halogenków metaloorganicznych.
Mechanizm
Mechanizm reakcji Blaise obejmuje tworzenie kompleksu cynkoorganicznego z alfa bromu karbonylową estru. To sprawia, że nukleofilowego alfa węgla, co pozwala na atak na elektrofilowy atom węgla nitrylu. Ujemne azotu nitrylowy otrzymany przed atakiem kompleksu z kationem bromkiem cynku. Ester β-enamino (tautomer związku pośredniego iminy zdjęciu) produktu ujawnionego obróbki o 50% K 2 CO 3 aq. Jeżeli β-ketoestru jest pożądanym produktem, dodanie 1 M kwasu solnego, hydrolizuje się ester β-enamino obrócić enamino do ketonu, tworząc P-ketoestru.
Zobacz też
Referencje
- ^ Edmond E. Blaise; Compt. Rozdzierać. 1901,132, 478.
- ^ Rinehart, KI, Jr. Organie Syntheses , Coli. Cz. 4, str. 120 (1963); Cz. 35, str. 15 (1955). (Artykuł)
- ^ Rao HSP; Rafi, S .; Padmavathy, K. Tetrahedron, 2008,64, 8037-8043. (Przejrzeć)
- ^ Cason, J .; Rinehart, KI, Jr .; Thorston, SD, Jr. J. Org. Chem. 1953,18, 1594. (Doi:10,1021 / jo50017a022)
- ^ Hannick SM; Kishi, Y. J. Org. Chem. 1983,48, 3833. (Doi:10,1021 / jo00169a053)
- Marko, IE , J. Am. Chem. Soc. 2007 , ASAP doi : 10,1021 / ja0691728
- Wang D .; Yue, J.-M. Synlett 2005 , 2077-2079.