Chemia kombinatoryczna - Combinatorial chemistry
Chemia kombinatoryczna obejmuje metody syntezy chemicznej, które umożliwiają wytworzenie dużej liczby (dziesiątki, tysiące, a nawet miliony) związków w jednym procesie. Te biblioteki związków mogą być tworzone jako mieszaniny, zestawy pojedynczych związków lub struktury chemiczne generowane przez oprogramowanie komputerowe. Chemia kombinatoryczna może być stosowana do syntezy małych cząsteczek i peptydów.
Strategie umożliwiające identyfikację użytecznych składników bibliotek są również częścią chemii kombinatorycznej. Metody stosowane w chemii kombinatorycznej są również stosowane poza chemią.
Historia
Chemia kombinatoryczna została wynaleziona przez Furkę Á (Eötvös Loránd University Budapest Hungary), który opisał jej zasadę, syntezę kombinatoryczną i procedurę dekonwolucji w dokumencie poświadczonym notarialnie w 1982 roku. mieszanina składników składowych (biblioteka kombinatoryczna) w pojedynczej, etapowej procedurze i przesiewanie jej w celu znalezienia kandydatów na leki lub innych rodzajów użytecznych związków również w jednym procesie. Najważniejszą innowacją metody kombinatorycznej jest wykorzystanie mieszanin w syntezie i skriningu, co zapewnia wysoką wydajność procesu. Motywacje, które doprowadziły do wynalazku, zostały opublikowane w 2002 roku.
Wstęp
Synteza cząsteczek w sposób kombinatoryczny może szybko doprowadzić do powstania dużej liczby cząsteczek. Na przykład, cząsteczka z trzema punktami różnorodności ( R 1 , R 2 i R 3 ) może generować możliwych struktur, w których , i to liczba różnych podstawników wykorzystane.
Podstawową zasadą chemii kombinatorycznej jest przygotowanie bibliotek z bardzo dużej liczby związków, a następnie zidentyfikowanie użytecznych składników bibliotek.
Chociaż chemii kombinatorycznej dopiero naprawdę zostały podjęte przez przemysł od 1990, jego korzenie mogą być widoczne już w 1960 roku, gdy badacz z Uniwersytetu Rockefellera , Bruce Merrifield rozpoczęła śledztwo w sprawie syntezy w fazie stałej z peptydami .
W swojej nowoczesnej formie chemia kombinatoryczna prawdopodobnie wywarła największy wpływ na przemysł farmaceutyczny . Naukowcy próbujący zoptymalizować profil aktywności związku tworzą " bibliotekę " wielu różnych, ale powiązanych związków. Postępy w robotyce doprowadziły do przemysłowego podejścia do syntezy kombinatorycznej, umożliwiając firmom rutynową produkcję ponad 100 000 nowych i unikalnych związków rocznie.
Aby obsłużyć ogromną liczbę możliwości strukturalnych, badacze często tworzą „wirtualną bibliotekę”, czyli obliczeniowe wyliczenie wszystkich możliwych struktur danego farmakoforu ze wszystkimi dostępnymi reagentami . Taka biblioteka może składać się z tysięcy do milionów „wirtualnych” związków. Badacz wybierze podzbiór „wirtualnej biblioteki” do rzeczywistej syntezy, w oparciu o różne obliczenia i kryteria (patrz ADME , chemia obliczeniowa i QSAR ).
Polimery (peptydy i oligonukleotydy)
Kombinatoryczna synteza split-mix (split i pool)
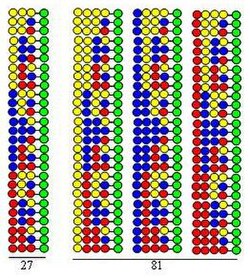
Kombinatoryczna synteza typu split-mix (split and pool) opiera się na syntezie w fazie stałej opracowanej przez firmę Merrifield . Jeśli kombinatoryczna biblioteka peptydów jest syntetyzowana przy użyciu 20 aminokwasów (lub innego rodzaju bloków budulcowych), stały nośnik w postaci kulek dzieli się na 20 równych części. Po tym następuje sprzęganie innego aminokwasu z każdą porcją. Trzeci krok to wymieszanie wszystkich porcji. Te trzy kroki składają się na cykl. Wydłużenie łańcuchów peptydowych można zrealizować po prostu powtarzając etapy cyklu.
Procedurę ilustruje synteza biblioteki dipeptydowej przy użyciu tych samych trzech aminokwasów jako elementów budulcowych w obu cyklach. Każdy składnik tej biblioteki zawiera dwa aminokwasy ułożone w różnej kolejności. Aminokwasy używane w sprzęganiach są reprezentowane na rysunku przez żółte, niebieskie i czerwone kółka. Rozbieżne strzałki pokazują podział żywicy stałego nośnika (zielone kółka) na równe porcje, pionowe strzałki oznaczają sprzężenie, a zbieżne strzałki reprezentują mieszanie i homogenizację porcji nośnika.
Rysunek pokazuje, że w dwóch cyklach syntetycznych powstaje 9 dipeptydów. W trzecim i czwartym cyklu utworzyłoby się odpowiednio 27 tripeptydów i 81 tetrapeptydów.
Synteza „split-mix” ma kilka wyjątkowych cech:
- Jest bardzo wydajny. Jak pokazuje rysunek, liczba peptydów powstających w procesie syntezy (3, 9, 27, 81) rośnie wykładniczo wraz z liczbą wykonanych cykli. Przy użyciu 20 aminokwasów w każdym cyklu syntetycznym liczba utworzonych peptydów wynosi odpowiednio: 400, 8000, 160 000 i 3 200 000. Oznacza to, że liczba peptydów rośnie wykładniczo wraz z liczbą wykonanych cykli.
- Wszystkie sekwencje peptydowe powstają w procesie, który można wywnioskować przez kombinację aminokwasów użytych w cyklach.
- Porcjowanie nośnika na równe próbki zapewnia tworzenie składników biblioteki w prawie równych ilościach molowych.
- Na każdej kulce nośnika tworzy się tylko jeden peptyd. Jest to konsekwencją użycia tylko jednego aminokwasu w etapach sprzęgania. Nie wiadomo jednak, który peptyd zajmuje wybraną kulkę.
- Metodę split-mix można stosować do syntezy biblioteki organicznej lub innego rodzaju biblioteki, którą można przygotować z jej bloków budulcowych w procesie etapowym.
W 1990 roku trzy grupy opisały metody przygotowania bibliotek peptydowych metodami biologicznymi, a rok później Fodor et al. opublikowali niezwykłą metodę syntezy macierzy peptydowych na małych szkiełkach.
Mario Geysen i jego współpracownicy opracowali metodę "syntezy równoległej" do przygotowania macierzy peptydowych. Zsyntetyzowali 96 peptydów na plastikowych prętach (szpilkach) pokrytych na ich końcach stałym podłożem. Szpilki zanurzono w roztworze odczynników umieszczonych w studzienkach płytki do mikromiareczkowania . Metoda jest szeroko stosowana, zwłaszcza przy wykorzystaniu automatycznych syntezatorów równoległych. Chociaż metoda równoległa jest znacznie wolniejsza niż prawdziwa metoda kombinatoryczna, jej zaletą jest to, że dokładnie wiadomo, który peptyd lub inny związek tworzy się na każdej szpilce.
Opracowano dalsze procedury, aby połączyć zalety dzielonej mieszanki i syntezy równoległej. W metodzie opisanej przez dwie grupy stały nośnik zamknięto w przepuszczalnych kapsułkach z tworzywa sztucznego wraz ze znacznikiem o częstotliwości radiowej, który zawierał kod związku, który miał być utworzony w kapsułce. Procedurę przeprowadzono podobnie do metody split-mix. Jednak w etapie dzielonym kapsułki zostały rozprowadzone pomiędzy naczyniami reakcyjnymi zgodnie z kodami odczytanymi ze znaczników częstotliwości radiowych kapsułek.
Inną metodę do tego samego celu opracowali Furka i in. nosi nazwę „synteza strun”. W tej metodzie kapsułki nie zawierały kodu. Są nawleczone jak perły w naszyjniku i umieszczone w naczyniach reakcyjnych w formie sznurków. Tożsamość kapsułek, a także ich zawartość, są przechowywane przez ich pozycję zajętą na strunach. Po każdym etapie sprzęgania kapsuły są rozdzielane pomiędzy nowe struny według określonych reguł.
Małe cząsteczki
W procesie odkrywania leków synteza i ocena biologiczna małych cząsteczek będących przedmiotem zainteresowania były zazwyczaj długim i pracochłonnym procesem. Chemia kombinatoryczna pojawiła się w ostatnich dziesięcioleciach jako podejście do szybkiej i wydajnej syntezy dużej liczby potencjalnych kandydatów na leki małocząsteczkowe. W typowej syntezie na końcu schematu syntezy wytwarzana jest tylko jedna cząsteczka docelowa, przy czym na każdym etapie syntezy powstaje tylko jeden produkt. W syntezie kombinatorycznej , przy użyciu tylko jednego materiału wyjściowego, możliwe jest zsyntetyzowanie dużej biblioteki cząsteczek przy użyciu identycznych warunków reakcji, które można następnie przeszukiwać pod kątem ich aktywności biologicznej . Ta pula produktów jest następnie dzielona na trzy równe porcje zawierające każdy z trzech produktów, a następnie każda z trzech indywidualnych pul jest poddawana reakcji z inną jednostką odczynnika B, C lub D, tworząc 9 unikalnych związków z poprzednich 3. Proces ten jest następnie powtarzany aż do dodania pożądanej liczby bloków budulcowych, generując wiele związków. Syntetyzując bibliotekę związków na drodze syntezy wieloetapowej, należy zastosować wydajne metody reakcji, a jeśli po każdym etapie reakcji stosuje się tradycyjne metody oczyszczania, ucierpi wydajność i wydajność.
Synteza w fazie stałej oferuje potencjalne rozwiązania pozwalające uniknąć typowych etapów hartowania i oczyszczania, często stosowanych w chemii syntetycznej. Ogólnie rzecz biorąc, wyjściowa cząsteczka przylega do stałego nośnika (zazwyczaj nierozpuszczalnego polimeru ), następnie przeprowadza się dodatkowe reakcje i końcowy produkt oczyszcza się, a następnie odcina od stałego nośnika. Ponieważ cząsteczki będące przedmiotem zainteresowania są przyłączone do stałego podłoża, możliwe jest zredukowanie oczyszczania po każdej reakcji do pojedynczego etapu filtracji/przemywania, eliminując potrzebę żmudnych etapów ekstrakcji ciecz-ciecz i odparowywania rozpuszczalnika, z którymi wiąże się większość chemii syntetycznej. Ponadto, stosując heterogeniczne reagenty, można zastosować nadmiar reagentów do doprowadzenia do końca powolnych reakcji, co może jeszcze bardziej poprawić wydajność. Nadmiar odczynników można po prostu wypłukać bez dodatkowych etapów oczyszczania, takich jak chromatografia .
Z biegiem lat opracowano szereg metod udoskonalania wykorzystania syntezy organicznej w fazie stałej w chemii kombinatorycznej, w tym wysiłki mające na celu zwiększenie łatwości syntezy i oczyszczania, a także nietradycyjne metody charakteryzowania produktów pośrednich. Chociaż większość opisanych tu przykładów będzie wykorzystywać heterogeniczne środowisko reakcji na każdym etapie reakcji, Booth i Hodges dostarczają wczesny przykład zastosowania odczynników na nośniku stałym tylko podczas etapu oczyszczania w tradycyjnych syntezach w fazie roztworu. Ich zdaniem, chemia fazy roztworu oferuje korzyści polegające na unikaniu reakcji przyłączania i rozszczepiania niezbędnych do zakotwiczenia i usuwania cząsteczek w żywicach, a także wyeliminowaniu potrzeby odtwarzania analogów fazy stałej ustalonych reakcji fazy roztworu.
Pojedynczy etap oczyszczania pod koniec syntezy umożliwia usunięcie jednego lub większej liczby zanieczyszczeń, zakładając, że struktura chemiczna danego zanieczyszczenia jest znana. Chociaż zastosowanie odczynników na nośniku stałym znacznie upraszcza syntezę związków, wiele syntez kombinatorycznych wymaga wielu etapów, z których każdy nadal wymaga jakiejś formy oczyszczenia. Armstrong i in. opisują metodę one-pot do generowania bibliotek kombinatorycznych, zwanych wieloskładnikowymi kondensacjami (MCC). Na tym schemacie trzy lub więcej odczynników reaguje tak, że każdy odczynnik jest włączany do produktu końcowego w jednym etapie, eliminując potrzebę wieloetapowej syntezy, która obejmuje wiele etapów oczyszczania. W MCC nie ma konieczności dekonwolucji, aby określić, które związki są biologicznie aktywne, ponieważ każda synteza w macierzy zawiera tylko jeden produkt, a zatem tożsamość związku powinna być jednoznacznie znana.
W innej syntezie macierzy, Still wygenerował dużą bibliotekę oligopeptydów poprzez syntezę rozdzieloną. Wadą wytwarzania wielu tysięcy związków jest to, że trudno jest określić strukturę utworzonych związków. Ich rozwiązaniem jest zastosowanie znaczników molekularnych, w których niewielka ilość (1 pmoli/kulkę) barwnika jest przyczepiona do kulek, a tożsamość określonej kulki można określić analizując, które znaczniki znajdują się na kulce. Pomimo tego, jak łatwo przyczepianie znaczników umożliwia identyfikację receptorów, byłoby zupełnie niemożliwe indywidualne badanie przesiewowe każdego związku pod kątem jego zdolności wiązania z receptorem, dlatego do każdego receptora przyłączono barwnik, tak że tylko te receptory, które wiążą się ze swoim substratem, powodują zmianę koloru.
Gdy wiele reakcji musi być prowadzonych w macierzy (takiej jak 96 reakcji opisanych w jednej z macierzy MCC firmy Armstrong), niektóre z bardziej żmudnych aspektów syntezy można zautomatyzować w celu poprawy wydajności. DeWitt i Czarnik szczegółowo opisali metodę zwaną „ metodą DYWERSOMERA ”, w której wiele zminiaturyzowanych wersji reakcji chemicznych przebiega jednocześnie. Metoda ta wykorzystuje urządzenie, które automatyzuje cykle ładowania i płukania żywicy, a także monitorowanie i oczyszczanie cyklu reakcji oraz demonstruje wykonalność ich metody i aparatury poprzez wykorzystanie jej do syntezy różnych klas cząsteczek, takich jak hydantoiny i benzodiazepiny , w większości przypadków przeprowadzanie 40 indywidualnych reakcji.
Często nie jest możliwe użycie drogiego sprzętu, a Schwabacher et al. opisują prostą metodę łączenia równoległej syntezy członków biblioteki i oceny całych bibliotek związków. W ich metodzie nić, która jest podzielona na różne regiony, jest owijana wokół cylindra, gdzie inny odczynnik jest następnie sprzęgany z każdym regionem, który zawiera tylko jeden rodzaj. Nić jest następnie ponownie dzielona i owijana wokół cylindra o innym rozmiarze, a następnie ten proces jest powtarzany. Piękno tej metody polega na tym, że tożsamość każdego produktu można poznać po prostu na podstawie jego położenia wzdłuż nici, a odpowiednią aktywność biologiczną identyfikuje się za pomocą transformacji sygnałów fluorescencyjnych Fouriera .
W większości opisanych tutaj syntez konieczne jest przyłączanie i usuwanie odczynnika wyjściowego do/z stałego podłoża. Może to prowadzić do wytworzenia grupy hydroksylowej, która potencjalnie może wpływać na aktywność biologiczną docelowego związku. Ellman wykorzystuje nośniki fazy stałej w wieloetapowym schemacie syntezy, aby otrzymać 192 pojedyncze pochodne 1,4-benzodiazepiny, które są dobrze znanymi środkami terapeutycznymi. Aby wyeliminować możliwość potencjalnej interferencji grup hydroksylowych, stosuje się nową metodę wykorzystującą chemię sililo-arylu do łączenia cząsteczek ze stałym nośnikiem, który odcina się od nośnika i nie pozostawia śladów po łączniku.
Podczas zakotwiczania cząsteczki na stałym nośniku, półproduktów nie można izolować od siebie bez odszczepienia cząsteczki od żywicy. Ponieważ wiele tradycyjnych technik charakteryzowania stosowanych do śledzenia postępu reakcji i potwierdzania struktury produktu jest opartych na rozwiązaniach, należy zastosować różne techniki. Spektroskopia 13C NMR w fazie żelowej, spektrometria masowa MALDI i spektroskopia IR zostały wykorzystane do potwierdzenia struktury i monitorowania postępu reakcji w fazie stałej. Gordon i wsp. opisują kilka studiów przypadku, w których wykorzystuje się iminy i fosfoniany peptydylowe do generowania bibliotek kombinatorycznych małych cząsteczek. Aby wygenerować bibliotekę iminową, aminokwas związany z żywicą poddaje się reakcji w obecności aldehydu. Autorzy demonstrują zastosowanie szybkiej spektroskopii NMR w fazie żelowej 13 C i spektroskopii 1 H NMR z wirowaniem pod magicznym kątem do monitorowania postępu reakcji i wykazali, że większość imin może powstać w ciągu zaledwie 10 minut w temperaturze pokojowej, gdy jako ortomrówczan trimetylu zastosowano rozpuszczalnik. Utworzone iminy poddano następnie derywatyzacji, aby wytworzyć 4-tiazolidynony, B-laktamy i pirolidyny.
Zastosowanie nośników w fazie stałej znacznie upraszcza syntezę dużych kombinatorycznych bibliotek związków. Odbywa się to poprzez zakotwiczenie materiału wyjściowego na stałym podłożu, a następnie prowadzenie kolejnych reakcji aż do zbudowania wystarczająco dużej biblioteki, po czym produkty są odcinane od podłoża. Wykazano również zastosowanie oczyszczania w fazie stałej w schematach syntezy w fazie roztworu w połączeniu ze standardowymi technikami oczyszczania metodą ekstrakcji ciecz-ciecz.
Dekonwolucja i przesiewanie
Biblioteki kombinatoryczne
Biblioteki kombinatoryczne to specjalne wieloskładnikowe mieszaniny drobnocząsteczkowych związków chemicznych, które są syntetyzowane w jednym, etapowym procesie. Różnią się one zarówno od zbioru pojedynczych związków, jak i od serii związków otrzymanych metodą syntezy równoległej. Ważną cechą jest to, że do ich syntezy wykorzystuje się mieszaniny. Zastosowanie mieszanek zapewnia bardzo wysoką wydajność procesu. Oba reagenty mogą być mieszaninami iw tym przypadku procedura byłaby jeszcze wydajniejsza. Ze względów praktycznych wskazane jest jednak stosowanie metody split-mix, w której jedną z dwóch mieszanek zastępuje się pojedynczymi blokami budulcowymi (BB). Mieszaniny są tak ważne, że nie ma bibliotek kombinatorycznych bez użycia mieszaniny w syntezie, a jeśli mieszanina jest stosowana w procesie, nieuchronnie powstają kombinatoryczne formy bibliotek. Synteza typu split-mix jest zwykle realizowana przy użyciu stałego nośnika, ale możliwe jest również zastosowanie go w roztworze. Ponieważ jego struktury, składniki są nieznanymi metodami dekonwolucji, muszą być stosowane w badaniach przesiewowych. Jedną z najważniejszych cech bibliotek kombinatorycznych jest możliwość przeszukiwania całej mieszaniny w jednym procesie. To sprawia, że biblioteki te są bardzo przydatne w badaniach farmaceutycznych. Można również zsyntetyzować częściowe biblioteki pełnych bibliotek kombinatorycznych. Niektóre z nich można wykorzystać w dekonwolucji
Dekonwolucja bibliotek wyrwanych ze stałego podłoża
Jeśli zsyntetyzowane cząsteczki biblioteki kombinatorycznej są odcinane ze stałego nośnika, tworzy się rozpuszczalna mieszanina. W takim rozwiązaniu można znaleźć miliony różnych związków. Kiedy opracowano tę syntetyczną metodę, początkowo wydawało się niemożliwe, aby zidentyfikować molekuły i znaleźć molekuły o użytecznych właściwościach. Opracowano jednak strategie identyfikacji przydatnych komponentów, aby rozwiązać ten problem. Wszystkie te strategie opierają się na syntezie i testowaniu bibliotek częściowych. Najwcześniejsza strategia iteracyjna jest opisana we wspomnianym powyżej dokumencie Furki poświadczonym notarialnie w 1982 r. Metoda została później niezależnie opublikowana przez Erb et al. pod nazwą „Dekonwolucja rekurencyjna”
Rekurencyjna dekonwolucja
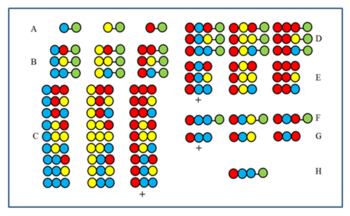
Metoda jest zrozumiała na rysunku. 27-członowa biblioteka peptydów jest syntetyzowana z trzech aminokwasów. Po pierwszym (A) i drugim (B) cyklu próbki odstawiono przed zmieszaniem. Produkty trzeciego cyklu (C) są rozszczepiane przed zmieszaniem, a następnie badane pod kątem aktywności. Załóżmy, że grupa oznaczona znakiem + jest aktywna. Wszyscy członkowie mają czerwony aminokwas w ostatniej pozycji sprzęgania (CP). W konsekwencji aktywny członek ma również czerwony aminokwas w ostatnim CP. Następnie czerwony aminokwas jest sprzęgany z trzema próbkami odłożonymi na bok po drugim cyklu (B), aby uzyskać próbki D. Po rozszczepieniu powstają trzy próbki E. Jeśli po badaniu próbka oznaczona + jest aktywna, oznacza to, że niebieski aminokwas zajmuje drugi CP w aktywnym składniku. Następnie do trzech próbek A najpierw sprzęga się niebieski, a potem czerwony aminokwas (F), a następnie ponownie testuje po rozszczepieniu (G). Jeśli składnik + okaże się aktywny, kolejność składnika aktywnego jest określana i wyświetlana w H.
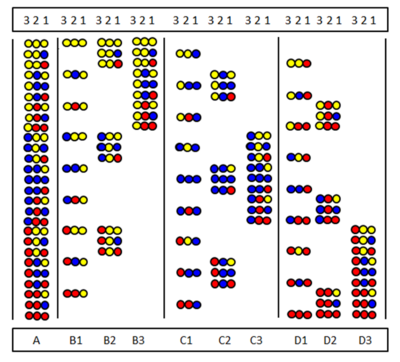
Skanowanie pozycyjne
Skanowanie pozycyjne zostało wprowadzone niezależnie przez Furkę i in. i Pinilla i in. Metoda opiera się na syntezie i testowaniu serii podbibliotek. w którym pewna pozycja sekwencji jest zajęta przez ten sam aminokwas. Rysunek przedstawia dziewięć podbibliotek (B1-D3) pełnej biblioteki trimerów peptydów (A) utworzonej z trzech aminokwasów. W bibliotekach podrzędnych istnieje pozycja, która we wszystkich składnikach zajmuje ten sam aminokwas. W syntezie podbiblioteki nośnik nie jest dzielony i tylko jeden aminokwas jest sprzęgany z całą próbką. W rezultacie jedna pozycja jest tak naprawdę zajęta przez ten sam aminokwas we wszystkich składnikach. Na przykład w podbibliotece B2 pozycja 2 jest zajęta przez aminokwas „żółty” we wszystkich dziewięciu składnikach. Jeśli w teście przesiewowym podbiblioteka ta daje odpowiedź pozytywną oznacza to, że pozycja 2 w aktywnym peptydzie jest również zajęta przez „żółty” aminokwas. Sekwencję aminokwasową można określić, testując wszystkie dziewięć (lub czasem mniej) podbibliotek.
Biblioteki zaniechań
W bibliotekach pominięć brakuje określonego aminokwasu we wszystkich peptydach mieszaniny. Rysunek przedstawia pełną bibliotekę i trzy biblioteki pominięć. Na górze pokazane są pominięte aminokwasy. Jeśli biblioteka pominięć daje wynik negatywny, pominięty aminokwas jest obecny w aktywnym składniku.
Dekonwolucja połączonych bibliotek kombinatorycznych
Jeśli peptydy nie zostaną odcięte od podłoża stałego, mamy do czynienia z mieszaniną kulek, z których każda zawiera jeden peptyd. Smith i jego koledzy wykazali wcześniej, że peptydy można testować również w formie uwięzi. Podejście to zastosowano również w przeszukiwaniu bibliotek peptydów. Związaną bibliotekę peptydów testowano z rozpuszczonym białkiem docelowym. Kulki, do których przyłączone było białko, zostały wybrane, usunięto białko z kulki, a następnie zakotwiczony peptyd zidentyfikowano przez sekwencjonowanie. Nieco inne podejście przyjęli Taylor i Morken. Wykorzystali termografię w podczerwieni do identyfikacji katalizatorów w bibliotekach niepeptydowych. Metoda opiera się na cieple wydzielanym w kulkach zawierających katalizator po zanurzeniu uwiązanej biblioteki w roztworze substratu. Gdy perełki bada się pod mikroskopem w podczerwieni, perełki zawierające katalizator wyglądają jak jasne plamki i można je wychwycić.
Zakodowane biblioteki kombinatoryczne
Jeśli mamy do czynienia z niepeptydową biblioteką organicznych bibliotek, określenie identyczności zawartości kulki nie jest tak proste, jak w przypadku kulki peptydowej. W celu obejścia tej trudności opracowano metody przyłączania do kulek, równolegle z syntezą biblioteki, cząsteczek kodujących strukturę związku utworzonego w kulce. Ohlmeyer i jego koledzy opublikowali metodę kodowania binarnego. Wykorzystali mieszaniny 18 znakujących cząsteczek, które po odcięciu ich od kulek można było zidentyfikować za pomocą chromatografii gazowej z wychwytem elektronów. Sarkar i in. opisali chiralne oligomery amidów pentenowych (COPA), które można stosować do konstruowania masowo kodowanych bibliotek OBOC. Kerr i in. wprowadziła innowacyjną metodę kodowania Do kulek przymocowano wyjmowany dwufunkcyjny łącznik zabezpieczony ortogonalnie. Jeden koniec łącznika zastosowano do przyłączenia nienaturalnych bloków budulcowych biblioteki, podczas gdy z drugim końcem połączono tryplety kodujące aminokwasy. Blokami budulcowymi były aminokwasy nienaturalne, a serie ich kodujących trójek aminokwasów można było określić przez degradację Edmana. Ważnym aspektem tego rodzaju kodowania była możliwość odcięcia z kulek elementów biblioteki wraz z dołączonymi do nich znacznikami kodującymi, tworząc rozpuszczalną bibliotekę. To samo podejście zastosowali Nikolajev i in. do kodowania za pomocą peptydów. W 1992 roku Brenner i Lerner wprowadzili sekwencje DNA do kodowania kulek stałego podłoża, które okazały się najbardziej skuteczną metodą kodowania. Nielsen, Brenner i Janda również zastosowali podejście Kerra do implementacji kodowania DNA. W ostatnim okresie nastąpiły ważne postępy w sekwencjonowaniu DNA. Techniki nowej generacji umożliwiają równoległe sekwencjonowanie dużej liczby próbek, co jest bardzo ważne w przeszukiwaniu bibliotek kodowanych przez DNA. Do sukcesu kodowania DNA przyczyniła się kolejna innowacja. W 2000 Halpin i Harbury pominęli stałe podłoże w syntezie typu split-mix bibliotek kombinatorycznych kodowanych przez DNA i zastąpili je kodującymi oligomerami DNA. W rozdzieleniu fazy stałej i syntezie puli liczba składników bibliotek nie może przekroczyć liczby kulek nośnika. Dzięki nowatorskiemu podejściu autorów ograniczenie to zostało całkowicie wyeliminowane i umożliwiło przygotowanie nowych związków w praktycznie nieograniczonej liczbie. Na przykład duńska firma Nuevolution zsyntetyzowała zakodowaną w DNA bibliotekę zawierającą 40 bilionów! składniki Biblioteki kodowane przez DNA są rozpuszczalne, co umożliwia zastosowanie skutecznego wiązania powinowactwa w badaniach przesiewowych. Niektórzy autorzy stosują DEL dla akromimu bibliotek kombinatorycznych zakodowanych w DNA, inni stosują DECL. To ostatnie wydaje się lepsze, gdyż w tej nazwie wyraźnie wyraża się kombinatoryczny charakter tych bibliotek. Kilka typów bibliotek kombinatorycznych kodowanych w DNA zostało wprowadzonych i opisanych w pierwszej dekadzie obecnego tysiąclecia. Biblioteki te są z powodzeniem stosowane w badaniach leków.
- Synteza na matrycy DNA bibliotek kombinatorycznych opisana w 2001 przez Gartner et al.
- Biblioteki kombinatoryczne kodowane przez podwójny farmakofor DNA kodowane w 2004 r. przez Mlecco et al.
- Routing zakodowany sekwencyjnie opublikowany przez Harbury Halpin i Harbury w 2004 roku.
- Biblioteki kombinatoryczne kodowane pojedynczym farmakoforem DNA, wprowadzone w 2008 r. przez Manocci et al.
- Biblioteki kombinatoryczne kodowane DNA utworzone przy użyciu reaktora w skali joktolitra opublikowanego przez Hansena i in. w 2009
Szczegóły dotyczące ich syntezy i zastosowania można znaleźć na stronie „ Biblioteka chemiczna kodowana w DNA” . Rozpuszczalne biblioteki kombinatoryczne kodowane przez DNA mają również wady. Przede wszystkim całkowicie traci się korzyść płynącą z zastosowania solidnego podparcia. Ponadto polijonowy charakter łańcuchów kodujących DNA ogranicza przydatność rozpuszczalników niewodnych w syntezie. Z tego powodu wiele laboratoriów decyduje się na opracowanie reakcji kompatybilnych z DNA do wykorzystania w syntezie DECL. Sporo z dostępnych jest już opisanych
Inżynieria materiałowa
Materiałoznawstwo zastosowało techniki chemii kombinatorycznej do odkrywania nowych materiałów. Ta praca została zapoczątkowana przez PG Schultza i in. w połowie lat dziewięćdziesiątych w kontekście materiałów luminescencyjnych otrzymanych przez współosadzanie pierwiastków na podłożu krzemowym. Jego pracę poprzedził JJ Hanak w 1970 roku, ale narzędzia komputerowe i robotyka nie były dostępne dla rozpowszechnienia tej metody w tym czasie. Prace kontynuowało kilka grup akademickich oraz firmy posiadające duże programy badawczo-rozwojowe ( Symyx Technologies , GE , Dow Chemical itp.). Technika ta jest szeroko stosowana w katalizie, powłokach, elektronice i wielu innych dziedzinach. Zastosowanie odpowiednich narzędzi informatycznych ma kluczowe znaczenie dla obsługi, administrowania i przechowywania ogromnych ilości wytwarzanych danych. Opracowano również nowe rodzaje metod projektowania eksperymentów , aby skutecznie zająć się dużymi przestrzeniami eksperymentalnymi, które można rozwiązać za pomocą metod kombinatorycznych.
Biblioteki zorientowane na różnorodność
Chociaż chemia kombinatoryczna jest istotną częścią wczesnych odkryć leków przez ponad dwie dekady, jak dotąd tylko jedna substancja chemiczna syntetyzowana de novo chemicznie kombinatoryczna została zatwierdzona do użytku klinicznego przez FDA ( sorafenib , inhibitor multikinazy wskazany w zaawansowanym raku nerki) . Zasugerowano, że analiza słabego wskaźnika powodzenia tego podejścia wiąże się z dość ograniczoną przestrzenią chemiczną, jaką zajmują produkty chemii kombinatorycznej. Porównując właściwości związków w kombinatorycznych bibliotekach chemicznych z właściwościami zatwierdzonych leków i produktów naturalnych, Feher i Schmidt zauważyli, że kombinatoryczne biblioteki chemiczne szczególnie cierpią z powodu braku chiralności , a także sztywności struktury, które są powszechnie uważane za leki. jak właściwości. Chociaż odkrywanie leków na bazie produktów naturalnych nie jest prawdopodobnie najmodniejszym trendem w przemyśle farmaceutycznym w ostatnich czasach, duża część nowych związków chemicznych wciąż jest związkami pochodzenia naturalnego, a zatem sugeruje się, że skuteczność chemii kombinatorycznej może być ulepszone poprzez zwiększenie chemicznej różnorodności bibliotek przesiewowych. Ponieważ chiralność i sztywność są dwiema najważniejszymi cechami odróżniającymi zatwierdzone leki i produkty naturalne od związków w kombinatorycznych bibliotekach chemii, na te dwie kwestie zwraca się uwagę w tzw. tylko ogromnej liczby związków.
Podklasa klasyfikacji patentowej
W VIII edycji Międzynarodowej Klasyfikacji Patentowej (IPC), która weszła w życie 1 stycznia 2006 r., utworzono specjalną podklasę zgłoszeń patentowych i patentów związanych z wynalazkami z dziedziny chemii kombinatorycznej: „C40B”.
Zobacz też
- Kombinatoryka
- Chemoinformatyka
- Biologia kombinatoryczna
- Odkrycie narkotyków
- Dynamiczna chemia kombinatoryczna
- Przesiewanie o wysokiej przepustowości
- chemia matematyczna
- Modelowanie molekularne
Bibliografia
Zewnętrzne linki
- Angielska wersja dokumentu z 1982 r.
- „Ukryta strona historii chemii kombinatorycznej”
- „Słownik terminów stosowanych w chemii kombinatorycznej” IUPAC
- ACS Combinatorial Science (dawniej Journal of Combinatorial Chemistry )
- Przegląd chemii kombinatorycznej
- Różnorodność molekularna
- Chemia kombinatoryczna i wysokowydajne badania przesiewowe
- Chemia kombinatoryczna: dziennik internetowy
- SmiLib — bezpłatne oprogramowanie typu open source do wyliczania bibliotek kombinatorycznych
- GLARE — bezpłatne oprogramowanie typu open source do projektowania bibliotek kombinatorycznych