Cyklopentadien - Cyclopentadiene
|
|
|||

|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Cyklopenta-1,3-dien |
|||
| Inne nazwy
1,3-cyklopentadien
Piropentylen |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| Skróty | CPD, HCp | ||
| 471171 | |||
| CZEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.008.033 |
||
| Numer WE | |||
| 1311 | |||
| Siatka | 1,3-cyklopentadien | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS | |||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 5 H 6 | |||
| Masa cząsteczkowa | 66,103 g·mol -1 | ||
| Wygląd zewnętrzny | Bezbarwna ciecz | ||
| Zapach | drażniące, podobne do terpenów | ||
| Gęstość | 0,786 g cm- 3 | ||
| Temperatura topnienia | -90°C; -130°F; 183 tys | ||
| Temperatura wrzenia | 39 do 43 °C; 102 do 109°F; 312 do 316 tys | ||
| nierozpuszczalny | |||
| Ciśnienie pary | 400 mmHg (53 kPa) | ||
| Kwasowość (p K a ) | 16 | ||
| Podstawa sprzężona | Anion cyklopentadienylowy | ||
| -44,5 × 10 -6 cm 3 mol -1 | |||
| Struktura | |||
| Planarny | |||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
115,3 JK -1 mol -1 | ||
|
Standardowa
entropia molowa ( S |
182,7 JK -1 mol -1 | ||
| Zagrożenia | |||
| Temperatura zapłonu | 25 ° C (77 ° F; 298 K) | ||
| Dawka lub stężenie śmiertelne (LD, LC): | |||
|
LC 50 ( mediana stężenia )
|
14182 ppm (szczur, 2 godz.) 5091 ppm (mysz, 2 godz.) |
||
| NIOSH (limity ekspozycji dla zdrowia w USA): | |||
|
PEL (dopuszczalne)
|
TWA 75 ppm (200 mg/m 3 ) | ||
|
REL (zalecane)
|
TWA 75 ppm (200 mg/m 3 ) | ||
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
750 ppm | ||
| Związki pokrewne | |||
|
Powiązane węglowodory
|
Benzen Cyklobutadien Cyklopenten |
||
|
Związki pokrewne
|
Dicyklopentadien | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Cyklopentadien jest związkiem organicznym o wzorze C 5 H 6 . Często oznacza się go skrótem CpH, ponieważ anion cyklopentadienylowy oznacza się skrótem Cp − .
Ta bezbarwna ciecz ma silny i nieprzyjemny zapach . W temperaturze pokojowej ten cykliczny dien ulega dimeryzacji w ciągu godzin, dając dicyklopentadien poprzez reakcję Dielsa-Aldera . Ten dimer można przywrócić przez ogrzewanie w celu uzyskania monomeru.
Związek wykorzystywany jest głównie do produkcji cyklopentenu i jego pochodnych. Jest powszechnie stosowany jako prekursor anionu cyklopentadienylowego (Cp - ), ważnego liganda w kompleksach cyklopentadienylowych w chemii metaloorganicznej .
Produkcja i reakcje
Produkcja cyklopentadienu zwykle nie różni się od dicyklopentadienu, ponieważ ulegają one przemianie. Są one otrzymywane ze smoły węglowej (około 10-20 g / tonę) i parą krakowania z benzyny (około 14 kg / tonę). Aby otrzymać monomer cyklopentadienu, handlowy dicyklopentadien jest krakowany przez ogrzewanie do około 180 °C. Monomer jest zbierany przez destylację i używany wkrótce potem. W tym celu wskazane jest użycie jakiejś formy kolumny frakcjonującej , aby usunąć refluksujący niekrakowany dimer.
Przegrupowanie sigmatropowe
Atomy wodoru w cyklopentadienu ulegają szybkiej [1,5] -sigmatropic zmiany wskazanych przez 1 H NMR rejestrowano przy różnych temperaturach. Jeszcze bardziej fluxional są pochodne C 5 H 5 E (CH 3 ) 3 (E = Si , Ge , Sn ), przy czym cięższe migruje z pierwiastków węgla do dwutlenku węgla o niskiej bariery aktywacji.
Reakcje Dielsa-Aldera
Cyklopentadien jest wysoce reaktywnym dienem w reakcji Dielsa-Aldera, ponieważ minimalne zniekształcenie dienu jest wymagane do osiągnięcia geometrii otoczki stanu przejściowego w porównaniu z innymi dienami. Znane jest to, że cyklopentadien ulega dimeryzacji. Konwersja zachodzi w ciągu godzin w temperaturze pokojowej, ale monomer można przechowywać przez kilka dni w temperaturze -20 °C.
Deprotonacja
Związek ten jest wyjątkowo kwaśne (s K = 16) dla węglowodorów , fakt wytłumaczyć dużą stabilność aromatycznego cyklopentadienylowym anionu , C
5h−
5. Deprotonowanie można osiągnąć za pomocą różnych zasad, zazwyczaj wodorku sodu, metalicznego sodu i butylolitu . Sole tego anionu są dostępne w handlu, w tym cyklopentadienid sodu i cyklopentadienid litu . Służą do przygotowania kompleksów cyklopentadienylowych .
Pochodne metalocenu
Metaloceny i pokrewne pochodne cyklopentadienylowe zostały dokładnie zbadane i stanowią podstawę chemii metaloorganicznej ze względu na ich wysoką stabilność. Pierwszy metalocen charakteryzuje ferrocenu wytwarza się jak wiele innych metaloceny przygotowywane są dzięki kombinacji pochodnych metali alkalicznych w postaci MC 5 H 5 z dihalogenków tych metali przejściowych : Jako typowy przykład, niklocen formy w czasie obróbki chlorek niklu (II), z cyklopentadienek sodu w THF .
- NiCl 2 + 2 NaC 5 H 5 → Ni(C 5 H 5 ) 2 + 2 NaCl
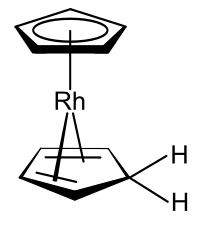
Znane są kompleksy metaloorganiczne, które zawierają zarówno anion cyklopentadienylowy, jak i sam cyklopentadien, których jednym przykładem jest pochodna rodocenu wytworzona z monomeru rodocenu w rozpuszczalnikach protonowych .
Synteza organiczna
Był to materiał wyjściowy w syntezie dwunastościanu Leo Paquette'a z 1982 roku . Pierwszy etap obejmował redukcyjną dimeryzację cząsteczki w celu uzyskania dihydrofulwalenu , a nie proste dodanie do dicyklopentadienu.
Zastosowania
Oprócz służenia jako prekursor katalizatorów opartych na cyklopentadienyl, głównym komercyjnym zastosowaniem cyklopentadienu jest jako prekursor komonomerów . Częściowe uwodornienie daje cyklopenten . Reakcja Dielsa-Aldera z butadienem daje etylidenonorbornen , komonomer w produkcji kauczuków EPDM .
Pochodne

Cyklopentadien może zastąpić jeden lub więcej wodorów, tworząc pochodne posiadające wiązania kowalencyjne:
- Masywne cyklopentadieny
- Calicene
- Cyklopentadienon
- Di- tert -butylcyclopentadiene
- Metylocyklopentadien
- Pentametylocyklopentadien
- Pentacyjanocyklopentadien
Większość z tych podstawionych cyklopentadienów może również tworzyć aniony i łączyć się w kompleksy cyklopentadienylowe .