Cyklopropan - Cyclopropane

|
|||
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Cyklopropan |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.000,771 |
||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 6 | |||
| Masa cząsteczkowa | 42,08 g/mol | ||
| Wygląd | Bezbarwny gaz | ||
| Zapach | Słodko pachnący | ||
| Gęstość | 1,879 g/l (1 atm, 0°C) | ||
| Temperatura topnienia | -128 ° C (-198 ° F; 145 K) | ||
| Temperatura wrzenia | -33°C (-27°F; 240 K) | ||
| Kwasowość (p K a ) | ~46 | ||
| -39,9 x 10 -6 cm 3 / mol | |||
| Zagrożenia | |||
| Główne zagrożenia | Wysoce łatwopalny środek duszący |
||
| Arkusz danych dotyczących bezpieczeństwa | Zewnętrzna Karta Charakterystyki | ||
| NFPA 704 (ognisty diament) | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Cyklopropan jest cykloalkan o wzorze cząsteczkowym (CH 2 ) 3 , zawierającego trzy grupy metylenowe (CH 2 ) połączonych ze sobą z utworzeniem pierścienia. Niewielki rozmiar pierścienia powoduje znaczne obciążenie struktury pierścienia . Sam cyklopropan ma głównie znaczenie teoretyczne, ale wiele jego pochodnych ma znaczenie handlowe lub biologiczne.
Historia
Cyklopropan został odkryty w 1881 roku przez Augusta Freunda , który również zaproponował prawidłową strukturę substancji w swojej pierwszej pracy. Freund traktowano 1,3-dibromopropanu z sodu , co powoduje wewnątrzcząsteczkowe Wurtza reakcji prowadzącej bezpośrednio do cyklopropanu. Wydajność reakcji poprawiła Gustavson w 1887 r., stosując cynk zamiast sodu. Cyklopropan nie miał zastosowania komercyjnego, dopóki Henderson i Lucas nie odkryli jego właściwości znieczulających w 1929 roku; produkcja przemysłowa rozpoczęła się w 1936 roku. We współczesnej praktyce anestezjologicznej została wyparta przez inne środki.
Znieczulenie
Cyklopropan został wprowadzony do użytku klinicznego przez amerykańskiego anestezjologa Ralpha Watersa, który zastosował zamknięty system z absorpcją dwutlenku węgla, aby zachować ten kosztowny wówczas środek. Cyklopropan jest stosunkowo silnym, niedrażniącym i słodko pachnącym środkiem o minimalnym stężeniu pęcherzykowym 17,5% i współczynniku podziału krew/gaz 0,55. Oznaczało to, że indukcja znieczulenia przez inhalację cyklopropanu i tlenu była szybka i nieprzyjemna. Jednak po zakończeniu przedłużonego znieczulenia pacjenci mogą doświadczyć nagłego spadku ciśnienia krwi, potencjalnie prowadzącego do arytmii serca : reakcji znanej jako „wstrząs cyklopropanowy”. Z tego powodu, jak również z powodu wysokich kosztów i wybuchowego charakteru, był on ostatnio używany tylko do indukcji znieczulenia i nie był dostępny do użytku klinicznego od połowy lat 80-tych. Cylindry i przepływomierze miały kolor pomarańczowy.
Farmakologia
Cyklopropan jest nieaktywna na GABA A i receptorów glicynowych , a zamiast tego działa jako antagonista receptora NMDA . Hamuje także receptor AMPA i receptorów nikotynowych acetylocholiny , i uruchamia pewne K 2P kanałów .
Struktura i klejenie
Trójkątna struktura cyklopropanu wymaga, aby kąty wiązania między wiązaniami kowalencyjnymi węgiel-węgiel wynosiły 60°. Molekuła D' 3H symetrii cząsteczkowej . Oprócz odkształcenia pierścieniowego cząsteczka ma również odkształcenie skrętne z powodu zaćmionej konformacji jej atomów wodoru. W związku z tym wiązania między atomami węgla są znacznie słabsze niż w typowym alkanie , co skutkuje znacznie wyższą reaktywnością.
Wiązanie pomiędzy centrami węglowymi jest ogólnie opisywane w kategoriach zgiętych wiązań . W tym modelu wiązania węgiel-węgiel są wygięte na zewnątrz tak, że kąt międzyoczodołowy wynosi 104°. Niezwykłą konsekwencją zgiętego wiązania jest to, że podczas gdy wiązania CC w cyklopropanie są słabsze niż normalnie, atomy węgla są również bliżej siebie niż w zwykłym wiązaniu alkanowym: 151 pm w porównaniu do 153 pm (średnie wiązanie alkenowe : 146 pm).
Delokalizację sześciu elektronów trzech wiązań CC cyklopropanu podano jako wyjaśnienie tylko nieco większego odkształcenia cyklopropanu („tylko” 27,6 kcal/mol) w porównaniu z cyklobutanem (26,2 kcal/mol) z cykloheksanem jako odniesieniem z E str =0 kcal/mol. Ta stabilizacja jest określana jako aromatyczność σ, w przeciwieństwie do zwykłej aromatyczności π, która na przykład jest wysoce stabilizującym efektem w benzenie . Inne badania nie potwierdzają roli aromatyczności w cyklopropanu i istnienia indukowanego prądu pierścieniowego; takie badania dostarczają alternatywnego wyjaśnienia stabilizacji energetycznej i nieprawidłowego zachowania magnetycznego cyklopropanu.
Synteza
Cyklopropan najpierw wytwarza się przez sprzęganie Wurtza , w którym 1,3-dibromopropanu się cyklizacji stosując sód . Wydajność tej reakcji można poprawić, stosując cynk jako środek dehalogenujący i jodek sodu jako katalizator.
- BrCH 2 CH 2 CH 2 Br + 2 Na → (CH 2 ) 3 + 2 NaBr
Wytwarzanie pierścieni cyklopropanowych określa się mianem cyklopropanacji .
Cyklopropany
 Kwas 1-aminocyklopropano-1-karboksylowy odgrywa ważną rolę w biosyntezie hormonu roślinnego etylenu .
Kwas 1-aminocyklopropano-1-karboksylowy odgrywa ważną rolę w biosyntezie hormonu roślinnego etylenu .
Pochodne cyklopropanu są liczne. Wiele biocząsteczek i leków farmaceutycznych zawiera pierścień cyklopropanowy. Znanym przykładem jest kwas aminocyklopropanokarboksylowy , który jest prekursorem etylenu , hormonu roślinnego. W pyretroidy są podstawą wielu insektycydów. Znanych jest kilka cyklopropanowych kwasów tłuszczowych .
Reakcje
Dzięki zwiększonemu charakterowi π wiązań CC, cyklopropan może w niektórych przypadkach reagować jak alken. Na przykład ulega uwodornieniu za pomocą kwasów mineralnych z wytworzeniem liniowych halogenków alkilowych. Reagują również podstawione cyklopropany, zgodnie z regułą Markownikowa . Podstawione cyklopropany mogą oksydować do metali przejściowych , w procesie zwanym aktywacją C–C .
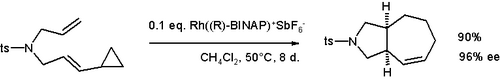
Grupy cyklopropylowe sąsiadujące z grupami winylowymi mogą ulegać reakcjom rozszerzania pierścienia . Przykłady obejmują przegrupowanie winylocyklopropanu i przegrupowanie diwinylocyklopropan-cykloheptadien . Ta reaktywność może zostać wykorzystana do wygenerowania niezwykłych związków cyklicznych, takich jak cyklobuteny , lub związków bicyklicznych, takich jak cyklohepten pokazany poniżej.
Bezpieczeństwo
Cyklopropan jest wysoce łatwopalny. Jednak pomimo swojej energii odkształcenia nie jest znacznie bardziej wybuchowy niż inne alkany .
Zobacz też
- Tetraedran zawiera cztery skondensowane pierścienie cyklopropanowe, które tworzą ściany czworościanu
- Propelan zawiera trzy pierścienie cyklopropanowe, które dzielą jedno centralne wiązanie węgiel-węgiel.
- Cyklopropen
- Metylenocyklopropan