Odkrycie neutronu - Discovery of the neutron

Odkrycie neutronu i jego właściwości była centralnym niezwykłych osiągnięć w fizyce atomowej w pierwszej połowie 20 wieku. Na początku XX wieku, Ernest Rutherford opracował surowy modelu atomu, oparty na folii złoto eksperymentu z Hans Geiger i Ernest Marsden . W tym modelu atomy miały swoją masę i dodatni ładunek elektryczny skoncentrowane w bardzo małym jądrze . Do roku 1920 odkryto izotopy chemiczne , masy atomowe określono jako (w przybliżeniu) całkowite wielokrotności masy atomu wodoru , a liczbę atomową zidentyfikowano jako ładunek na jądrze. W latach dwudziestych postrzegano jądro jako złożone z kombinacji protonów i elektronów , dwóch znanych wówczas cząstek elementarnych, ale model ten przedstawiał kilka eksperymentalnych i teoretycznych sprzeczności.
Zasadnicza natura jądra atomowego została ustalona wraz z odkryciem neutronu przez Jamesa Chadwicka w 1932 roku i ustaleniem, że jest to nowa cząstka elementarna, różna od protonu.
Nienaładowane neutronów natychmiast wykorzystywane jako nowe środki do badania struktury jądra, co doprowadziło do odkrycia takich jak tworzenie nowych pierwiastków promieniotwórczych przez napromienianie neutronów (1934) i rozszczepienie z uranu atomów neutronami (1938). Odkrycie rozszczepienia doprowadziło do powstania zarówno energii jądrowej, jak i broni jądrowej pod koniec II wojny światowej. Zarówno proton, jak i neutron uważano za cząstki elementarne do lat sześćdziesiątych, kiedy to uznano je za cząstki złożone z kwarków .
Odkrycie radioaktywności
Na początku XX wieku ożywiona debata na temat istnienia atomów nie została jeszcze rozwiązana. Filozofowie tacy jak Ernst Mach i Wilhelm Ostwald zaprzeczali, że atomy są prawdziwe, postrzegając je jako wygodną konstrukcję matematyczną, podczas gdy naukowcy tacy jak Arnold Sommerfeld i Ludwig Boltzmann widzieli, że teorie fizyczne wymagają istnienia atomów.
Radioaktywność odkrył w 1896 roku francuski naukowiec Henri Becquerel podczas pracy z materiałami fosforescencyjnymi . W 1898 roku Ernest Rutherford w Cavendish Laboratory wyróżnił dwa rodzaje promieniotwórczości, promienie alfa i promienie beta , które różniły się zdolnością do penetracji lub podróżowania do zwykłych obiektów lub gazów. Dwa lata później Paul Villard odkrył promienie gamma , które miały jeszcze większą przenikliwość. Promieniowania te zostały wkrótce zidentyfikowane ze znanymi cząstkami: w 1902 Walter Kaufmann wykazał, że promienie beta są elektronami ; W 1907 Rutherford i Thomas Royds wykazali, że promienie alfa są jonami helu ; Rutherford i Edward Andrade w 1914 roku wykazali, że promienie gamma są promieniowaniem elektromagnetycznym, to jest formą światła . Promieniowanie to również zostało zidentyfikowane jako emanujące z atomów, stąd dostarczyło wskazówek na temat procesów zachodzących w atomach. Odwrotnie, promieniowanie uznano również za narzędzia, które można wykorzystać w eksperymentach rozpraszania do badania wnętrza atomów.
Eksperyment ze złotą folią i odkrycie jądra atomowego
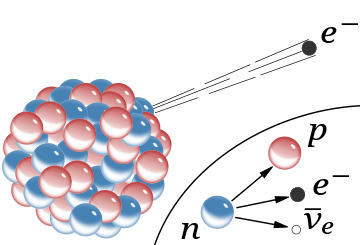
β−
promieniowanie, emisja szybkiego elektronu z jądra (pominięto towarzyszące mu antyneutrino). W modelu Rutherforda dla jądra czerwone kule były protonami o ładunku dodatnim, a niebieskie były protonami ściśle związanymi z elektronem bez ładunku netto. Wpuszczanym rozpad przedstawia beta wolnego neutronów, jak to jest rozumiane obecnie; w tym procesie powstaje elektron i antyneutrino.
Na Uniwersytecie w Manchesterze w latach 1908-1913 Rutherford polecił Hansowi Geigerowi i Ernestowi Marsdenowi przeprowadzenie serii eksperymentów w celu ustalenia, co dzieje się, gdy cząstki alfa rozpraszają się z metalowej folii. Nazywane teraz eksperymentem ze złotą folią Rutherforda lub eksperymentem Geigera-Marsdena, pomiary te doprowadziły do niezwykłego odkrycia, że cząstki alfa czasami rozpraszają się pod dużym kątem podczas przechodzenia przez cienką złotą folię. Rozpraszanie wskazywało, że cząstki alfa zostały odchylone przez mały, ale gęsty składnik atomów. Na podstawie tych pomiarów do 1911 Rutherford zrozumiał, że atom składa się z małego, masywnego jądra z ładunkiem dodatnim, otoczonego znacznie większym obłokiem ujemnie naładowanych elektronów . Skoncentrowana masa atomowa była wymagana, aby zapewnić obserwowane ugięcie cząstek alfa, a Rutherford opracował model matematyczny, który uwzględniał rozpraszanie.
Model Rutherforda był bardzo wpływowy, motywując model Bohra dla elektronów krążących wokół jądra w 1913 roku i ostatecznie doprowadził do mechaniki kwantowej w połowie lat dwudziestych.
Odkrycie izotopów
Równolegle z pracami Rutherforda, Geigera i Marsdena radiochemik Frederick Soddy z Uniwersytetu w Glasgow badał zagadnienia związane z chemią materiałów radioaktywnych. Soddy pracował z Rutherfordem nad radioaktywnością na Uniwersytecie McGill . Do 1910 r. około 40 różnych pierwiastków promieniotwórczych, zwanych pierwiastkami promieniotwórczymi , zostało zidentyfikowanych między uranem a ołowiem, chociaż układ okresowy dopuszczał tylko 11 pierwiastków. Soddy i Kazimierz Fajans niezależnie odkryli w 1913 roku, że pierwiastek ulegający rozpadowi alfa wytworzy pierwiastek dwa miejsca w lewo w układzie okresowym, a pierwiastek ulegający rozpadowi beta wytworzy pierwiastek o jedno miejsce w prawo w układzie okresowym. Również te pierwiastki promieniotwórcze, które znajdują się w tych samych miejscach w układzie okresowym, są chemicznie identyczne. Soddy nazwał te chemicznie identyczne pierwiastki izotopami . Za swoje badania nad promieniotwórczością i odkrycie izotopów Soddy otrzymał w 1921 roku Nagrodę Nobla w dziedzinie chemii.
Budowanie z pracy przez JJ Thomsona na ugięcia dodatnio naładowanych atomów pól elektrycznych i magnetycznych, Francis Aston zbudował pierwszy masowy spektrograf w Cavendish Laboratory w roku 1919. Jego celem, który łatwo osiągnąć, było oddzielenie tych dwóch izotopów neonu ,20
Ne
oraz 22
Ne
. Aston odkrył, że masy wszystkich cząstek są liczbami całkowitymi ( zasada liczb całkowitych ): to znaczy masy wszystkich izotopów są całkowitymi wielokrotnościami masy atomu wodoru. W tych pomiarach Aston arbitralnie obliczył swoją masę w stosunku do tlenu-16 , którą przyjął jako masę dokładnie 16. (Dzisiaj jednostka masy atomowej (amu) odnosi się do węgla-12 ). Jak na ironię, jedyny wyjątek od tego regułą był sam wodór, który miał wartość masy 1,008. Nadmiar masy był niewielki, ale znacznie przekraczał granice niepewności eksperymentalnej. Aston i inni szybko zdali sobie sprawę, że rozbieżność wynika z energii wiązania atomów, to znaczy masa wielu atomów wodoru związanych w pojedynczy atom musi być mniejsza niż suma mas oddzielnych atomów wodoru. Praca Astona nad izotopami przyniosła mu w 1922 roku Nagrodę Nobla w dziedzinie chemii za odkrycie izotopów w dużej liczbie nieradioaktywnych pierwiastków oraz za wypowiedzenie zasady liczb całkowitych. Odnotowując niedawne odkrycie przez Astona energii wiązania jądrowego, w 1920 Arthur Eddington zasugerował, że gwiazdy mogą pozyskiwać swoją energię poprzez fuzję wodoru (protonów) w hel, a cięższe pierwiastki mogą tworzyć się w gwiazdach.
Liczba atomowa i prawo Moseleya
Rutherford i inni zauważyli rozbieżność między masą atomu obliczoną w jednostkach masy atomowej a przybliżonym ładunkiem wymaganym na jądrze, aby model Rutherforda działał. Wymagany ładunek jądra atomowego wynosił zwykle około połowy jego masy atomowej. Antonius van den Broek odważnie postawił hipotezę, że wymagany ładunek, oznaczony przez Z , nie był połową masy atomowej pierwiastków, ale był dokładnie równy pozycji pierwiastka w układzie okresowym . W tym czasie nie było wiadomo, czy pozycje pierwiastków w układzie okresowym mają jakiekolwiek znaczenie fizyczne. Jeśli jednak pierwiastki uporządkowano w oparciu o wzrastającą masę atomową, to wykazywano cykliczność właściwości chemicznych. Widoczne były jednak wyjątki od tej okresowości, takie jak kobalt i nikiel.
Na Uniwersytecie w Manchesterze w 1913 roku Henry Moseley omówił z przyjezdnym Bohrem nowy model atomu Bohra. Model uwzględniał widmo emisji elektromagnetycznej z atomu wodoru, a Moseley i Bohr zastanawiali się, czy widma emisji elektromagnetycznej cięższych pierwiastków, takich jak kobalt i nikiel, będą zgodne z ich porządkiem wagowym, czy według ich pozycji w układzie okresowym. W latach 1913-1914 Moseley przetestował to pytanie eksperymentalnie przy użyciu technik dyfrakcji rentgenowskiej . Odkrył, że najbardziej intensywna linia o krótkiej długości fali w widmie rentgenowskim danego pierwiastka, znana jako linia K-alfa , jest związana z pozycją pierwiastka w układzie okresowym, to znaczy z jego liczbą atomową Z . Rzeczywiście, Moseley wprowadził tę nomenklaturę. Moseley odkrył, że częstotliwości promieniowania są w prosty sposób powiązane z liczbą atomową pierwiastków dla dużej liczby pierwiastków.
W ciągu roku zauważono, że równanie tej relacji, zwane obecnie prawem Moseleya , można wyjaśnić za pomocą modelu Bohra z 1913 r., z rozsądnymi dodatkowymi założeniami dotyczącymi struktury atomowej innych pierwiastków. Wynik Moseleya, według późniejszej relacji Bohra, nie tylko ustalił liczbę atomową jako mierzalną wielkość eksperymentalną, ale nadał jej fizyczne znaczenie jako dodatni ładunek jądra atomowego. Pierwiastki można uporządkować w układzie okresowym według liczby atomowej, a nie masy atomowej. Wyniki powiązały razem organizację układu okresowego pierwiastków, model Bohra dla atomu i model Rutherforda dla rozpraszania alfa z jąder. Została przytoczona przez Rutherforda, Bohra i innych jako krytyczny postęp w zrozumieniu natury jądra atomowego.
Dalsze badania w fizyce atomowej przerwał wybuch I wojny światowej . Moseley zginął w 1915 roku w bitwie pod Gallipoli , podczas gdy uczeń Rutherforda James Chadwick został internowany w Niemczech na czas wojny, 1914-1918. W Berlinie przerwano pracę badawczą Lise Meitner i Otto Hahna nad określeniem łańcuchów rozpadu promieniotwórczego radu i uranu metodą precyzyjnej separacji chemicznej. Meitner spędził większość wojny pracując jako radiolog i technik medyczny rentgenowski w pobliżu frontu austriackiego, podczas gdy Hahn, chemik , pracował nad badaniami nad bronią z trującym gazem .
atom Rutherforda
W 1920 Rutherford wygłosił wykład Bakera w Royal Society zatytułowany „Nuclear Constitution of Atoms”, podsumowujący ostatnie eksperymenty na jądrach atomowych i wnioski dotyczące struktury jąder atomowych. Do 1920 roku powszechnie zakładano istnienie elektronów w jądrze atomowym. Założono, że jądro składa się z jąder wodoru w liczbie równej masie atomowej. Ale ponieważ każde jądro wodoru miało ładunek +1, wymagało ono mniejszej liczby „wewnętrznych elektronów” o ładunku -1, aby nadać jądru właściwy ładunek całkowity. Masa protonów jest około 1800 razy większa niż elektronów, więc masa elektronów jest przypadkowa w tym obliczeniu. Taki model był zgodny z rozpraszaniem cząstek alfa z ciężkich jąder, a także ładunkiem i masą wielu zidentyfikowanych izotopów. Były inne motywacje modelu protonowo-elektronowego. Jak zauważył wówczas Rutherford: „Mamy mocne powody, by sądzić, że jądra atomów zawierają zarówno elektrony, jak i ciała naładowane dodatnio…”, mianowicie wiedziano, że promieniowanie beta to elektrony emitowane z jądra.
W tym wykładzie Rutherford przypuszczał istnienie nowych cząstek. Cząstka alfa była znana jako bardzo stabilna i zakładano, że zachowuje swoją tożsamość w jądrze. Przypuszcza się, że cząstka alfa składa się z czterech protonów i dwóch blisko związanych elektronów, co daje jej ładunek +2 i masę 4. W artykule z 1919 roku Rutherford donosił o odkryciu nowej, podwójnie naładowanej cząstki o masie 3, oznaczonej jako X++. interpretowany jako składa się z trzech protonów i blisko związanego elektronu. Ten wynik sugerował Rutherfordowi prawdopodobne istnienie dwóch nowych cząstek: jednej z dwóch protonów z blisko związanym elektronem, a drugiej z jednego protonu i blisko związanego elektronu. Później ustalono, że cząstka X++ ma masę 4 i jest po prostu niskoenergetyczną cząstką alfa. Niemniej jednak Rutherford przypuszczał istnienie deuteronu, cząstki o ładunku +1 o masie 2 i neutronu, neutralnej cząstki o masie 1. Ten pierwszy jest jądrem deuteru , odkrytym w 1931 roku przez Harolda Ureya . Masa hipotetycznej cząstki obojętnej niewiele różniłaby się od masy protonu. Rutherford ustalił, że taka cząstka o zerowym ładunku byłaby trudna do wykrycia dostępnymi technikami.
W roku 1921 Rutherford i William Harkins niezależnie nazwali nienaładowaną cząstkę neutronem , podczas gdy mniej więcej w tym samym czasie słowo proton zostało przyjęte dla jądra wodoru. Neutron został najwyraźniej skonstruowany z łacińskiego pierwiastka neutralnego i greckiego zakończenia -on (poprzez imitację elektronu i protonu ). Odniesienia do słowa neutron w połączeniu z atomem można znaleźć w literaturze już jednak w 1899 roku.
Rutherford i Chadwick natychmiast rozpoczęli program eksperymentalny w Cavendish Laboratory w Cambridge w celu poszukiwania neutronu. Eksperymenty kontynuowano w latach dwudziestych bez powodzenia.
Przypuszczenie Rutherforda nie zostało powszechnie przyjęte. W swojej monografii na 1931 Konstytucji Jądra atomowe i radioaktywności , George'a Gamowa , następnie w Instytucie Fizyki Teoretycznej w Kopenhadze, nie wspominając o neutronu. W czasie ich pomiarów w Paryżu w 1932 r., które doprowadziły do odkrycia neutronu, Irène Joliot-Curie i Frédéric Joliot nie byli świadomi tej hipotezy.
Problemy hipotezy elektronów jądrowych
W latach dwudziestych fizycy zakładali, że jądro atomowe składa się z protonów i „elektronów jądrowych”. Zgodnie z tą hipotezą jądro azotu-14 ( 14 N) składałoby się z 14 protonów i 7 elektronów, a więc miałoby ładunek netto +7 jednostek ładunku elementarnego i masę 14 jednostek masy atomowej. To jądro byłoby również krążone przez kolejne 7 elektronów, nazwanych przez Rutherforda „elektronami zewnętrznymi”, aby uzupełnić atom 14 N. Jednak wkrótce pojawiły się problemy z hipotezą.
Ralph Kronig wskazał w 1926 roku, że obserwowana nadsubtelna struktura widm atomowych jest niezgodna z hipotezą protonowo-elektronową. Struktura ta spowodowana jest wpływem jądra na dynamikę orbitujących elektronów. Momenty magnetyczne rzekomych "elektronów jądrowych" powinny wytworzyć nadsubtelne rozszczepienia linii widmowych podobne do efektu Zeemana , ale takich efektów nie zaobserwowano. Wydawało się, że moment magnetyczny elektronu zniknął, gdy znajdował się w jądrze.
Podczas wizyty na Uniwersytecie w Utrechcie w 1928, Kronig dowiedział się o zaskakującym aspekcie rotacyjnego widma N 2 + . Dokładny pomiar wykonany przez Leonarda Ornsteina , dyrektora Laboratorium Fizycznego w Utrechcie, wykazał, że spin jądra azotu musi być równy jeden. Jeśli jednak jądro azotu-14 ( 14 N) składało się z 14 protonów i 7 elektronów, czyli nieparzystej liczby cząstek o spinie 1/2, to wypadkowy spin jądrowy powinien być liczbą połówkową. Dlatego Kronig zasugerował, że być może „protony i elektrony nie zachowują swojej tożsamości w takim stopniu, w jakim zachowują się poza jądrem”.
Obserwacje poziomów energii rotacyjnej cząsteczek dwuatomowych za pomocą spektroskopii ramanowskiej przeprowadzone przez Franco Rasettiego w 1929 r. były niezgodne ze statystykami oczekiwanymi na podstawie hipotezy proton-elektron. Rasetti uzyskał widma pasmowe dla cząsteczek H 2 i N 2 . Podczas gdy linie dla obu cząsteczek dwuatomowych wykazywały naprzemienną intensywność pomiędzy jasnym i ciemnym, wzór naprzemienny dla H 2 jest odwrotny do tego dla N 2 . Po uważnej analizie tych wyników eksperymentalnych niemieccy fizycy Walter Heitler i Gerhard Herzberg wykazali, że jądra wodoru są zgodne ze statystykami Fermiego, a jądra azotu podlegają statystykom Bosego. Jednak nieopublikowany wówczas wynik Eugene'a Wignera pokazał, że układ kompozytowy o nieparzystej liczbie cząstek o spinie 1/2 musi być zgodny ze statystykami Fermiego; system z parzystą liczbą cząstek o spinie 1/2 jest zgodny ze statystykami Bose. Jeśli jądro azotu ma 21 cząstek, to wbrew faktom powinno podlegać statystyce Fermiego. Tak więc Heitler i Herzberg doszli do wniosku: „elektron w jądrze … traci zdolność określania statystyk jądra”.
Klein paradoksem , odkryli Oskar Kleina z roku 1928, przedstawiono w dalszej kwantowe zastrzeżeń mechaniczne pojęciem elektronu zamkniętej wewnątrz jądra. Pochodzący z równania Diraca ten jasny i precyzyjny paradoks sugerował, że elektron zbliżający się do bariery o wysokim potencjale ma duże prawdopodobieństwo przejścia przez barierę w procesie tworzenia pary . Najwyraźniej elektron nie może być zamknięty w jądrze przez żadną studnię potencjału. Znaczenie tego paradoksu było wówczas intensywnie dyskutowane.
Około roku 1930 powszechnie uznano, że trudno jest pogodzić model protonowo-elektronowy jąder z relacją niepewności Heisenberga w mechanice kwantowej. Ta zależność, Δ x ⋅Δ p ≥ 1 ⁄ 2 ħ , implikuje, że elektron ograniczony do obszaru o wielkości jądra atomowego ma zwykle energię kinetyczną nie mniejszą niż 40 MeV, która jest większa niż obserwowana energia emitowanych cząstek beta z jądra. Taka energia jest również znacznie większa niż energia wiązania nukleonów, która, jak wykazali Aston i inni, wynosi mniej niż 9 MeV na nukleon.
W 1927 roku Charles Ellis i W. Wooster z Cavendish Laboratory zmierzyli energie elektronów beta-rozpadów. Odkryli, że rozkład energii z poszczególnych jąder promieniotwórczych był szeroki i ciągły, co wyraźnie kontrastowało z różnymi wartościami energii obserwowanymi w rozpadach alfa i gamma. Co więcej, ciągły rozkład energii wydawał się wskazywać, że energia nie została zachowana przez ten proces „elektronów jądrowych”. Rzeczywiście, w 1929 roku Bohr zaproponował zmodyfikowanie prawa zachowania energii, aby uwzględnić ciągłą dystrybucję energii. Propozycja zyskała poparcie Wernera Heisenberga. Takie rozważania były najwyraźniej rozsądne, ponieważ prawa mechaniki kwantowej tak niedawno obaliły prawa mechaniki klasycznej.
Chociaż wszystkie te rozważania nie „udowodniły”, że elektron nie może istnieć w jądrze, były mylące i trudne do interpretacji przez fizyków . Wiele teorii zostało wymyślonych, aby wyjaśnić, jak powyższe argumenty mogą być błędne. W swojej monografii z 1931 r. Gamow podsumował wszystkie te sprzeczności, zaznaczając wypowiedzi dotyczące elektronów w jądrze symbolami ostrzegawczymi.
Odkrycie neutronu
W 1930 Walther Bothe i Herbert Becker w Giessen w Niemczech odkryli, że jeśli energetyczne cząstki alfa emitowane z polonu spadają na pewne lekkie pierwiastki, a konkretnie na beryl (9
4Być
), bor (11
5b
) lub litu (7
3Li
), powstało niezwykle przenikliwe promieniowanie. Najintensywniejsze promieniowanie wytworzył beryl. Polon jest wysoce radioaktywny, wytwarza energetyczne promieniowanie alfa i był wówczas powszechnie używany do eksperymentów rozpraszania. Na promieniowanie alfa może wpływać pole elektryczne, ponieważ składa się ono z naładowanych cząstek. Na zaobserwowane promieniowanie penetrujące nie miało jednak wpływu pole elektryczne, dlatego uważano, że jest to promieniowanie gamma . Promieniowanie było bardziej przenikliwe niż jakiekolwiek znane promieniowanie gamma, a szczegóły wyników eksperymentów były trudne do zinterpretowania.

Dwa lata później Irène Joliot-Curie i Frédéric Joliot w Paryżu wykazali, że jeśli to nieznane promieniowanie padnie na parafinę lub jakikolwiek inny związek zawierający wodór , to wyrzuca protony o bardzo wysokiej energii (5 MeV). Ta obserwacja sama w sobie nie była sprzeczna z założoną naturą promieniowania gamma nowego promieniowania, ale ta interpretacja ( rozpraszanie Comptona ) miała problem logiczny. Biorąc pod uwagę energię i pęd, promień gamma musiałby mieć niemożliwie wysoką energię (50 MeV), aby rozproszyć masywny proton. W Rzymie młody fizyk Ettore Majorana oświadczył, że sposób, w jaki nowe promieniowanie oddziałuje z protonami, wymaga nowej neutralnej cząstki.
Słysząc o wynikach z Paryża, ani Rutherford, ani James Chadwick z Cavendish Laboratory nie wierzyli w hipotezę promieniowania gamma. Wspomagany przez Normana Feathera Chadwick szybko przeprowadził serię eksperymentów, które wykazały, że hipoteza dotycząca promieniowania gamma jest nie do utrzymania. W poprzednim roku Chadwick, JER Constable i EC Pollard przeprowadzili już eksperymenty dotyczące rozpadu lekkich pierwiastków za pomocą promieniowania alfa pochodzącego z polonu. Opracowali także dokładniejsze i wydajniejsze metody wykrywania, liczenia i rejestrowania wyrzucanych protonów. Chadwick powtórzył tworzenie promieniowania za pomocą berylu do pochłaniania cząstek alfa: 9 Be + 4 He (α) → 12 C + 1 n. Po eksperymencie paryskim skierował promieniowanie na wosk parafinowy, węglowodór o wysokiej zawartości wodoru, dzięki czemu oferuje cel gęsty od protonów. Podobnie jak w eksperymencie paryskim, promieniowanie energetycznie rozproszyło część protonów. Chadwick zmierzył zasięg tych protonów, a także zmierzył wpływ nowego promieniowania na atomy różnych gazów. Odkrył, że nowe promieniowanie nie składało się z promieni gamma, ale z nienaładowanych cząstek o masie mniej więcej takiej samej jak proton . Te cząstki były neutronami. Chadwick otrzymał za to odkrycie Nagrodę Nobla w dziedzinie fizyki w 1935 roku.
Rok 1932 został później nazwany „ annus mirabilis ” dla fizyki jądrowej w Laboratorium Cavendisha, z odkryciem neutronu, sztucznego rozpadu jądra przez akcelerator cząstek Cockcrofta-Waltona i pozytonu .
Model protonowo-neutronowy jądra
Biorąc pod uwagę problemy modelu protonowo-elektronowego , szybko zaakceptowano, że jądro atomowe składa się z protonów i neutronów, chociaż dokładna natura neutronu była początkowo niejasna. W kilka miesięcy po odkryciu neutronu Werner Heisenberg i Dmitri Ivanenko zaproponowali modele protonowo-neutronowe jądra. Przełomowe artykuły Heisenberga zbliżyły się do opisu protonów i neutronów w jądrze za pomocą mechaniki kwantowej. Chociaż teoria Heisenberga dotycząca protonów i neutronów w jądrze była „dużym krokiem w kierunku zrozumienia jądra jako układu mechaniki kwantowej”, nadal zakładał obecność elektronów jądrowych. W szczególności Heisenberg założył, że neutron jest kompozytem protonowo-elektronowym, dla którego nie ma wyjaśnienia mechaniki kwantowej. Heisenberg nie miał wyjaśnienia, w jaki sposób lekkie elektrony mogą być związane w jądrze. Heisenberg przedstawił pierwszą teorię jądrowych sił wymiany, które wiążą nukleony. Uważał protony i neutrony za różne stany kwantowe tej samej cząstki, czyli nukleony wyróżniające się wartością ich jądrowych liczb kwantowych izospinowych .
Model protonowo-neutronowy wyjaśniał zagadkę dwuazotu. Przy 14 N zaproponowano składa się z 3 par każdego z protonów i neutronów z dodatkowym niesparowany neutronu Proton każdy się wirowaniu z 1 / 2 godziny w tym samym kierunku, w łącznej korkociągu 1 H, wzór się opłacalne. Wkrótce neutrony zostały wykorzystane do naturalnego wyjaśnienia w ten sam sposób różnic spinów w wielu różnych nuklidach.
Jeśli model protonowo-neutronowy jądra rozwiązał wiele problemów, uwydatnił problem wyjaśnienia pochodzenia promieniowania beta. Żadna istniejąca teoria nie może wyjaśnić, w jaki sposób elektrony lub pozytony mogą emanować z jądra. W 1934 roku Enrico Fermi opublikował swoją klasyczną pracę opisującą proces rozpadu beta , w którym neutron rozpada się na proton, tworząc elektron i (jeszcze nieodkryte) neutrino . W artykule wykorzystano analogię, że fotony , czyli promieniowanie elektromagnetyczne, były podobnie tworzone i niszczone w procesach atomowych. Ivanenko zaproponował podobną analogię w 1932 roku teoria Fermiego wymaga neutronu być Podziału 1 / 2 cząstek. Teoria zachowała zasadę zachowania energii, która została zakwestionowana przez ciągły rozkład energii cząstek beta. Podstawowa teoria rozpadu beta zaproponowana przez Fermiego jako pierwsza pokazała, jak można tworzyć i niszczyć cząstki. Ustanowił ogólną, podstawową teorię oddziaływania cząstek przez siły słabe lub silne. Chociaż ten wpływowy artykuł przetrwał próbę czasu, zawarte w nim idee były tak nowe, że kiedy po raz pierwszy został przedstawiony w czasopiśmie Nature w 1933 roku, został odrzucony jako zbyt spekulacyjny.
Natura neutronu
Pytanie, czy neutron jest złożoną cząstką protonu i elektronu, utrzymywało się przez kilka lat po jego odkryciu. W 1932 roku Harrie Massey zbadał na przykład model neutronu kompozytowego, aby wyjaśnić jego wielką moc przenikania przez materię i jego neutralność elektryczną. Problem był spuścizną po dominującym poglądzie z lat dwudziestych, że jedynymi cząstkami elementarnymi były proton i elektron.
Natura neutronu była głównym tematem dyskusji na VII Konferencji Solvaya, która odbyła się w październiku 1933 r., w której uczestniczyli Heisenberg, Niels Bohr , Lise Meitner , Ernest Lawrence , Fermi, Chadwick i inni. Jak postawił Chadwick w swoim Bakerian Lecture w 1933, głównym pytaniem była masa neutronu w stosunku do protonu. Jeśli masa neutronu była mniejsza niż połączone masy protonu i elektronu (1.0078 u ), to neutron mógłby być kompozytem proton-elektron z powodu defektu masy wywołanego energią wiązania jądra . Jeśli był większy niż suma mas, to neutron był elementarny jak proton. Odpowiedź na pytanie była trudna, ponieważ masa elektronu to zaledwie 0,05% masy protonu, stąd wymagane były wyjątkowo precyzyjne pomiary.
Trudność wykonania pomiaru ilustrują szeroko zakrojone wartości masy neutronu uzyskane w latach 1932-1934. Przyjęta dziś wartość to 1.008 66 u . W artykule Chadwicka z 1932 roku, opisującym odkrycie, oszacował, że masa neutronu wynosi pomiędzy1,005 U i1.008 u . Bombardując bor cząstkami alfa, Frédéric i Irène Joliot-Curie uzyskali wysoką wartość1,012 u , podczas gdy zespół Ernesta Lawrence'a z Uniwersytetu Kalifornijskiego zmierzył małą wartość1.0006 u używający nowego cyklotronu .
W 1935 Chadwick i jego doktorant Maurice Goldhaber rozwiązali problem, ogłaszając pierwszy dokładny pomiar masy neutronu. Do fotodezintegracji deuteronu użyli promieniowania gamma o energii 2,6 MeV z talu - 208 ( 208 Tl) (wtedy znanego jako tor C" )
W tej reakcji powstały proton i neutron mają mniej więcej taką samą energię kinetyczną, ponieważ ich masy są w przybliżeniu równe. Można zmierzyć energię kinetyczną powstałego protonu (0,24 MeV), a tym samym wyznaczyć energię wiązania deuteronu (2,6 MeV − 2 (0,24 MeV) = 2,1 MeV, lub0,0023 U ). Masę neutronu można następnie określić za pomocą prostego bilansu masy
m d + być = m str + m n
gdzie m d,p,n odnoszą się do masy deuteronu, protonu lub neutronu, a „be” jest energią wiązania. Znane były masy deuteronu i protonu; Chadwick i Goldhaber zastosowali odpowiednio wartości 2,0142 u i 1,0081 u. Odkryli, że masa neutronu była nieco większa niż masa protonu1.0084 u lub1.0090 u , w zależności od dokładnej wartości użytej dla masy deuteronu. Masa neutronu była zbyt duża, aby mógł być kompozytem protonowo-elektronowym, dlatego neutron zidentyfikowano jako cząstkę elementarną. Chadwick i Goldhaber przewidzieli, że wolny neutron może się rozpaść na proton, elektron i neutrino ( rozpad beta ).
Fizyka neutronów w latach 30.
Wkrótce po odkryciu neutronu pośrednie dowody sugerowały, że neutron ma nieoczekiwaną niezerową wartość momentu magnetycznego. Próby zmierzenia momentu magnetycznego neutronu rozpoczęły się wraz z odkryciem przez Otto Sterna w 1933 roku w Hamburgu, że proton ma anomalnie duży moment magnetyczny. Do roku 1934 grupy kierowane przez Sterna, obecnie w Pittsburghu , i II Rabi w Nowym Jorku, niezależnie wydedukowały, że moment magnetyczny neutronu był ujemny i nieoczekiwanie duży, mierząc momenty magnetyczne protonu i deuteronu . Wartości momentu magnetycznego neutronu wyznaczyli także Robert Bacher (1933) w Ann Arbor oraz IY Tamm i SA Altshuler (1934) w Związku Radzieckim z badań nad subtelną strukturą widm atomowych. Pod koniec lat 30. XX wieku grupa Rabiego za pomocą pomiarów wykorzystujących nowo opracowane techniki magnetycznego rezonansu jądrowego wydedukowała dokładne wartości momentu magnetycznego neutronu . Duża wartość momentu magnetycznego protonu i wywnioskowana ujemna wartość momentu magnetycznego neutronu były nieoczekiwane i rodziły wiele pytań.

Odkrycie neutronu natychmiast dało naukowcom nowe narzędzie do badania właściwości jąder atomowych. Cząstki alfa były używane przez ostatnie dziesięciolecia w eksperymentach rozpraszania, ale takie cząstki, które są jądrami helu, mają ładunek +2. Ładunek ten utrudnia cząstkom alfa pokonanie siły odpychania Coulomba i bezpośrednie oddziaływanie z jądrami atomów. Ponieważ neutrony nie mają ładunku elektrycznego, nie muszą pokonywać tej siły, aby oddziaływać z jądrami. Niemal zbiegając się z jego odkryciem, neutrony zostały użyte przez Normana Feathera , kolegę i protegowanego Chadwicka, w eksperymentach rozpraszania azotu. Feather był w stanie wykazać, że neutrony oddziałujące z jądrami azotu rozpraszały się na protonach lub indukowały rozpad azotu z wytworzeniem boru z emisją cząstki alfa. Pióro było zatem pierwszym, które wykazało, że neutrony powodują rozpad jądrowy.
W Rzymie Enrico Fermi i jego zespół bombardowali cięższe pierwiastki neutronami i odkryli, że produkty są radioaktywne. Do 1934 roku używali neutronów do indukowania radioaktywności w 22 różnych pierwiastkach, wielu z tych pierwiastków o dużej liczbie atomowej. Zauważając, że inne eksperymenty z neutronami w jego laboratorium wydawały się działać lepiej na drewnianym stole niż na marmurowym stole, Fermi podejrzewał, że protony drewna spowalniają neutrony, zwiększając w ten sposób szansę na interakcję neutronów z jądrami. Fermi przepuszczał zatem neutrony przez wosk parafinowy, aby je spowolnić, i odkrył, że radioaktywność niektórych bombardowanych pierwiastków wzrosła od dziesiątek do setek. Przekrój dla interakcji z jąder jest znacznie większa niż dla powolnych neutronów szybkich neutronów. W 1938 roku Fermi otrzymał Nagrodę Nobla w dziedzinie fizyki „za wykazanie istnienia nowych pierwiastków promieniotwórczych wytwarzanych przez napromieniowanie neutronami i związane z tym odkrycie reakcji jądrowych wywołanych przez powolne neutrony” .
W Berlinie współpraca Lise Meitner i Otto Hahna , wraz z ich asystentem Fritzem Strassmannem , pogłębiła badania rozpoczęte przez Fermiego i jego zespół, gdy zbombardowali uran neutronami. W latach 1934-1938 Hahn, Meitner i Strassmann znaleźli w tych eksperymentach dużą liczbę radioaktywnych produktów transmutacji, z których wszystkie uważali za transuranowe . Nuklidy transuranowe to te, które mają liczbę atomową większą niż uran (92), utworzone przez absorpcję neutronów; takie nuklidy nie występują naturalnie. W lipcu 1938 r. Meitner została zmuszona do ucieczki przed antysemickimi prześladowaniami w nazistowskich Niemczech po Anschlussie i była w stanie zapewnić sobie nową pozycję w Szwecji. Decydujący eksperyment z 16-17 grudnia 1938 r. (przy użyciu procesu chemicznego zwanego „ frakcjonowaniem radowo-barowo-mezotorowym ”) przyniósł zaskakujące wyniki: to, co uważali za trzy izotopy radu, zachowywało się konsekwentnie jak bar . Rad (liczba atomowa 88) i bar (liczba atomowa 56) należą do tej samej grupy chemicznej . W styczniu 1939 roku Hahn doszedł do wniosku, że to, co uważali za nuklidy transuranowe, było zamiast tego znacznie lżejszymi nuklidami, takimi jak bar, lantan , cer i lekkie platynoidy . Meitner i jej siostrzeniec Otto Frisch natychmiast i poprawnie zinterpretowali te obserwacje jako wynikające z rozszczepienia jądra atomowego , terminu ukutego przez Frischa.
Hahn i jego współpracownicy wykryli rozpad jąder uranu, niestabilnych przez absorpcję neutronów, na lżejsze pierwiastki. Meitner i Frisch wykazali również, że rozszczepienie każdego atomu uranu uwolni około 200 MeV energii. Odkrycie rozszczepienia zelektryzowało globalną społeczność fizyków atomowych i opinię publiczną. W swojej drugiej publikacji na temat rozszczepienia jądrowego Hahn i Strassmann przewidzieli istnienie i uwolnienie dodatkowych neutronów podczas procesu rozszczepienia. Frédéric Joliot i jego zespół udowodnili, że to zjawisko jest reakcją łańcuchową w marcu 1939 r. W 1945 r. Hahn otrzymał Nagrodę Nobla w dziedzinie chemii w 1944 r. „za odkrycie rozszczepienia ciężkich jąder atomowych”.
Po 1939
Odkrycie rozszczepienia jądrowego pod koniec 1938 roku oznaczało przesunięcie centrów badań jądrowych z Europy do Stanów Zjednoczonych. Duża liczba naukowców emigrowała do Stanów Zjednoczonych, aby uciec przed kłopotami i antysemityzmem w Europie oraz nadciągającą wojną (Patrz naukowcy żydowscy i Projekt Manhattan ). Nowymi ośrodkami badań jądrowych były uniwersytety w Stanach Zjednoczonych, zwłaszcza Columbia University w Nowym Jorku i University of Chicago, gdzie przeniósł się Enrico Fermi, oraz tajna placówka badawcza w Los Alamos w Nowym Meksyku , założona w 1942 roku, nowy dom z projektu Manhattan . Ten wojenny projekt koncentrował się na budowie broni jądrowej , wykorzystując ogromną energię uwalnianą przez rozszczepienie uranu lub plutonu w reakcjach łańcuchowych opartych na neutronach.
Odkrycia neutronu i pozytonu w 1932 roku były początkiem odkryć wielu nowych cząstek. Miony odkryto w 1936 roku. Piony i kaony odkryto w 1947, a cząstki lambda w 1950. W latach 50. i 60. odkryto dużą liczbę cząstek zwanych hadronami . Schemat klasyfikacji organizowania wszystkich tych cząstek, zaproponowany niezależnie przez Murraya Gell-Manna i George'a Zweiga w 1964 roku, stał się znany jako model kwarkowy . Według tego modelu cząstki takie jak proton i neutron nie były elementarne, ale składały się z różnych konfiguracji niewielkiej liczby innych prawdziwie elementarnych cząstek zwanych partonami lub kwarkami . Model kwarków przeszedł weryfikację eksperymentalną pod koniec lat sześćdziesiątych i ostatecznie dostarczył wyjaśnienia anomalnego momentu magnetycznego neutronu.
Filmy
- Ernest Rutherford podsumowuje stan fizyki jądrowej w 1935 r. (7 min., Nobelprize.org)
- Hans Bethe omawia pracę Chadwicka i Goldhabera nad rozpadem deuteronu. (2 min., Sieć opowieści)
Uwagi
Bibliografia
Dalsza lektura
- Bibliografia z adnotacjami dla neutronów z Biblioteki Cyfrowej Alsos for Nuclear Issues
- Abraham Pais , Inward Bound , Oxford: Oxford University Press, 1986. ISBN 0198519974 .
- Herwig Schopper , Słabe interakcje i jądrowy rozpad beta , Wydawnictwo, North-Holland Pub. Co., 1966. OCLC 644015779
- Ruth Lewin Sime , Lise Meitner: A Life in Physics , Berkeley, University of California Press, 1996. ISBN 0520208609 .
- Roger H. Stuewer , „Hipoteza elektronów jądrowych”. W Otto Hahn and the Rise of Nuclear Physics , William R. Shea, ed. Dordrecht, Holandia: D. Riedel Publishing Company. s. 19-67, 1983. ISBN 90-277-1584-X .
- Sin-Itiro Tomonaga , The Story of Spin , The University of Chicago Press, 1997. ISBN 9780226807942