Egzocytoza - Exocytosis
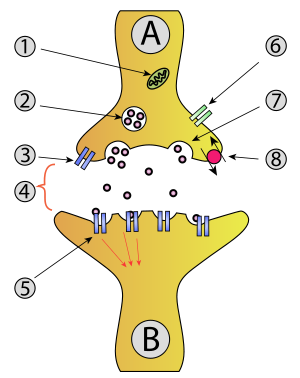
- Mitochondrium
- Pęcherzyk synaptyczny z neuroprzekaźnikami
- Autoreceptor
- Synapsa z uwolnionym neuroprzekaźnikiem ( serotonina )
- Receptory postsynaptyczne aktywowane przez neuroprzekaźnik (indukcja potencjału postsynaptycznego)
- Kanał wapniowy
- Egzocytoza pęcherzyka
- Odzyskany neuroprzekaźnik
Egzocytoza ( / ˌ ɛ k s oʊ s aɪ t oʊ s ɪ s / ) jest formą aktywną transportu i transportu luzem , w którym A transporty komórkowe cząsteczki (np neuroprzekaźników i białka ) z komory ( egzo + cytoza ) . Jako aktywny mechanizm transportu egzocytoza wymaga użycia energii do transportu materiału. Egzocytoza i jej odpowiednik endocytoza są wykorzystywane przez wszystkie komórki, ponieważ większość substancji chemicznychważne jest, aby ich duże polarne cząsteczki, które nie mogą przejść przez hydrofobowej części błony komórkowej przez pasywne środki. Egzocytoza to proces, w którym uwalniana jest duża ilość cząsteczek; dlatego jest to forma transportu masowego. Egzocytoza zachodzi poprzez portale wydzielnicze w błonie komórkowej zwane porosomiami . Porosomy to trwała struktura lipoproteinowa w kształcie miseczki w błonie komórkowej komórki, w której pęcherzyki wydzielnicze przejściowo łączą się i łączą w celu uwolnienia zawartości wewnątrzpęcherzykowej z komórki.
W egzocytozie pęcherzyki wydzielnicze związane z błoną są przenoszone do błony komórkowej , gdzie łączą się i łączą w porosomach, a ich zawartość (tj. cząsteczki rozpuszczalne w wodzie) jest wydzielana do środowiska zewnątrzkomórkowego. Ta sekrecja jest możliwa, ponieważ pęcherzyk przejściowo łączy się z błoną plazmatyczną. W kontekście neuroprzekaźnictwa , neuroprzekaźniki są zazwyczaj uwalniane z pęcherzyków synaptycznych do szczeliny synaptycznej poprzez egzocytozę; jednak neuroprzekaźniki mogą być również uwalniane poprzez transport odwrotny przez białka transportujące błony .
Egzocytoza jest również mechanizmem, dzięki któremu komórki są w stanie wstawić do błony komórkowej białka błonowe (takie jak kanały jonowe i receptory powierzchni komórki ), lipidy i inne składniki. Pęcherzyki zawierające te składniki błony w pełni łączą się z zewnętrzną błoną komórkową i stają się jej częścią.
Historia
Termin został zaproponowany przez De Duve w 1963 roku.
Rodzaje
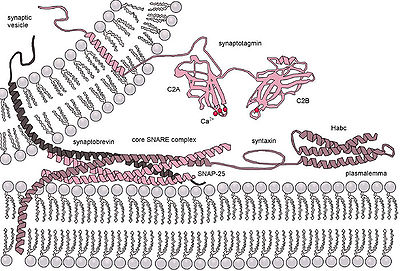
U eukariontów istnieją dwa rodzaje egzocytozy: 1) niekonstytucyjna wyzwalana Ca 2+ (tj. regulowana egzocytoza) i 2) konstytutywna nie wyzwalana Ca 2+ (tj. nieregulowana). Niekonstytucyjna egzocytoza wywoływana przez Ca2 + wymaga sygnału zewnętrznego, specyficznego sygnału sortującego na pęcherzykach, otoczki klatryny , a także wzrostu wewnątrzkomórkowego wapnia. W organizmach wielokomórkowych mechanizm ten inicjuje wiele form komunikacji międzykomórkowej, takich jak transmisja synaptyczna, sekrecja hormonów przez komórki neuroendokrynne i sekrecja komórek odpornościowych. W neuronach i komórkach endokrynnych białka SNARE i białka SM katalizują fuzję, tworząc kompleks, który łączy ze sobą dwie błony fuzyjne. Na przykład w synapsach kompleks SNARE tworzą Syntaxin-1 i SNAP25 na błonie komórkowej oraz VAMP2 na błonie pęcherzyka. Egzocytoza w neuronalnych synapsach chemicznych jest wyzwalana przez Ca2 + i służy do sygnalizacji międzyneuronowej. Czujniki wapnia, które wyzwalają egzocytozę, mogą oddziaływać albo z kompleksem SNARE, albo z fosfolipidami błon fuzyjnych. Synaptotagmina została uznana za główny czujnik egzocytozy wywoływanej przez Ca 2+ u zwierząt. Jednak w roślinach i jednokomórkowych organizmach eukariotycznych nie występują białka synaptotagminy. Inne potencjalne czujniki wapnia dla egzocytozy to białka EF-hand (np. Calmodulin) i domeny C2 (np. Ferlins, E-synaptotagmina, Doc2b). Nie jest jasne, w jaki sposób różne czujniki wapnia mogą ze sobą współpracować i pośredniczyć w kinetyce wywoływanej przez wapń egzocytozy w określony sposób.
Egzocytoza konstytutywna jest wykonywana przez wszystkie komórki i służy uwolnieniu składników macierzy zewnątrzkomórkowej lub dostarczeniu nowo zsyntetyzowanych białek błonowych, które po fuzji pęcherzyków transportowych zostają włączone do błony komórkowej . Nie ma wyraźnego konsensusu co do maszynerii i procesów molekularnych, które kierują tworzeniem, pączkowaniem, translokacją i fuzją pęcherzyków po aparatach Golgiego z błoną plazmatyczną. Fuzja obejmuje tethering membranowy (rozpoznawanie) i fuzję membranową. Nadal nie jest jasne, czy mechanizm między sekrecją konstytutywną a regulowaną jest inny. Nie tyle badano maszynerię wymaganą do konstytutywnej egzocytozy, co mechanizm regulowanej egzocytozy. Z konstytutywną egzocytozą u ssaków związane są dwa kompleksy wiążące: ELKS i Exocyst. ELKS jest dużym białkiem typu coiled-coil, zaangażowanym również w egzocytozę synaptyczną, wyznaczającą „gorące punkty” fuzji nośników wydzielniczych. Exocyst to oktameryczny kompleks białkowy. U ssaków składniki egzocysty lokalizują się zarówno w błonie komórkowej, jak i w aparacie Golgiego i białkach egzocyst w miejscu fuzji pęcherzyków post-Golgi. W fuzji błony konstytutywnej egzocytozy prawdopodobnie pośredniczą SNAP29 i Syntaxin19 na błonie plazmatycznej oraz YKT6 lub VAMP3 na błonie pęcherzyka.
Egzocytoza pęcherzykowa u bakterii Gram-ujemnych prokariontów jest trzecim mechanizmem i najnowszym odkryciem w egzocytozie. Peryplazma jest ściągnięta jako bakteryjne pęcherzyki błony zewnętrznej (OMVs) do translokacji biochemicznych sygnałów drobnoustrojów do eukariotycznych komórek gospodarza lub innych drobnoustrojów znajdujących się w pobliżu, osiągając kontrolę nad wydzielającym drobnoustrojem w jego środowisku - w tym inwazję gospodarza, endotoksemię, konkurowanie z innymi drobnoustrojami o odżywianie itp. To odkrycie przemieszczania się pęcherzyków błonowych na styku gospodarz-patogen obala również mit, że egzocytoza jest zjawiskiem czysto komórki eukariotycznej.
Kroki
W egzocytozie zaangażowanych jest pięć etapów:
Handel pęcherzykami
Niektóre etapy handlu pęcherzykami wymagają transportu pęcherzyka na umiarkowanie małą odległość. Na przykład pęcherzyki transportujące białka z aparatu Golgiego na powierzchnię komórki będą prawdopodobnie wykorzystywać białka motoryczne i szlak cytoszkieletowy, aby zbliżyć się do celu. Zanim wiązanie byłoby odpowiednie, wiele białek wykorzystywanych do aktywnego transportu byłoby zamiast tego nastawionych na transport pasywny, ponieważ aparat Golgiego nie wymaga ATP do transportu białek. Zarówno podstawa aktynowa, jak i mikrotubul są zaangażowane w te procesy, wraz z kilkoma białkami motorycznymi . Gdy pęcherzyki dotrą do celu, wchodzą w kontakt z czynnikami wiążącymi, które mogą je powstrzymać.
Wiązanie pęcherzyków
Przydatne jest odróżnienie początkowego, luźnego wiązania pęcherzyków do ich celu od bardziej stabilnych oddziaływań upakowania . Tethering obejmuje połączenia na odległościach ponad około połowy średnicy pęcherzyka od danej powierzchni membrany (>25 nm). Interakcje tethering prawdopodobnie biorą udział w koncentracji pęcherzyków synaptycznych w synapsie .
Pęcherzyki na uwięzi są również zaangażowane w normalne procesy transkrypcyjne komórki.
Dokowanie pęcherzyków
Pęcherzyki wydzielnicze przejściowo łączą się i łączą w porosomie na błonie plazmatycznej komórki poprzez ciasny kompleks pierścieniowy t-/v-SNARE.
Gruntowanie pęcherzyków
W egzocytozie neuronalnej termin priming został użyty do objęcia wszystkich przegrupowań molekularnych i modyfikacji białek i lipidów zależnych od ATP, które mają miejsce po początkowym zadokowaniu pęcherzyka synaptycznego, ale przed egzocytozą, tak że napływ jonów wapnia jest wszystkim, co jest potrzebne do wywołania niemal natychmiastowego uwalniania neuroprzekaźników . W innych typach komórek, których sekrecja jest konstytutywna (tj. ciągła, niezależna od jonów wapnia, niewyzwalana) nie ma pobudzenia.
Fuzja pęcherzyków
Przejściowa fuzja pęcherzyków jest napędzana przez białka SNARE , co powoduje uwolnienie zawartości pęcherzyków do przestrzeni zewnątrzkomórkowej (lub w przypadku neuronów w szczelinie synaptycznej).
Połączenie błon dawcy i akceptora spełnia trzy zadania:
- Zwiększa się powierzchnia błony plazmatycznej (o powierzchnię skondensowanego pęcherzyka). Jest to ważne dla regulacji wielkości komórek, np. podczas wzrostu komórek.
- Substancje w pęcherzyku są uwalniane na zewnątrz. Mogą to być produkty przemiany materii lub toksyny lub cząsteczki sygnałowe, takie jak hormony lub neuroprzekaźniki podczas transmisji synaptycznej .
- Białka osadzone w błonie pęcherzyka są teraz częścią błony plazmatycznej. Strona białka, która była skierowana do wnętrza pęcherzyka, jest teraz skierowana na zewnątrz komórki. Ten mechanizm jest ważny dla regulacji transbłonowej i transporterów.
Pobieranie pęcherzyków
Odzyskanie pęcherzyków synaptycznych następuje na drodze endocytozy . Większość pęcherzyków synaptycznych jest zawracanych bez pełnej fuzji z błoną (fuzja kiss-and-run ) przez porosomy . Egzocytoza niekonstytucyjna i późniejsza endocytoza są procesami wysokoenergetycznymi, a zatem są zależne od mitochondriów .
Badanie komórek po sekrecji za pomocą mikroskopu elektronowego wykazało zwiększoną obecność częściowo pustych pęcherzyków po sekrecji. Sugerowało to, że podczas procesu wydzielania tylko część zawartości pęcherzyka może opuścić komórkę. Byłoby to możliwe tylko wtedy, gdyby pęcherzyk tymczasowo nawiązał ciągłość z błoną komórkową w porosomach , wypchnął część jej zawartości, a następnie odłączył się, ponownie uszczelnił i wycofał do cytozolu (endocytoza). W ten sposób pęcherzyk wydzielniczy mógł być ponownie wykorzystany w kolejnych rundach egzoendocytozy, aż do całkowitego opróżnienia z jego zawartości.
Zobacz też
- Endocytoza
- Pinocytoza
- Fagocytoza
- Nanorurka membranowa
- Zrzucanie wirusów
- Presynaptyczna strefa aktywna
- Pozostałości ciała
- Degranulacja
Bibliografia
Zewnętrzne linki
- Egzocytoza w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)