Ferrocen - Ferrocene
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Ferrocen |
|||
| Inne nazwy | |||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.002.764 |
||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 10 H 10 Fe | |||
| Masa cząsteczkowa | 186,04 g/mol | ||
| Wygląd zewnętrzny | jasnopomarańczowy proszek | ||
| Zapach | kamfora -like | ||
| Gęstość | 1,107 g / cm 3 (0 ° C) 1,490 g / cm 3 (20 ° C) | ||
| Temperatura topnienia | 172,5°C (342,5°F; 445,6 K) | ||
| Temperatura wrzenia | 249 ° C (480 ° F; 522 K) | ||
| Nierozpuszczalny w wodzie, rozpuszczalny w większości rozpuszczalników organicznych | |||
| log P | 2.04050 | ||
| Struktura | |||
| D 5d / D 5h | |||
| metalocen | |||
| Brak stałego momentu dipolowego dzięki szybkim obrotom Cp | |||
| Zagrożenia | |||
| Główne zagrożenia | Bardzo niebezpieczne w przypadku spożycia. Niebezpieczne w przypadku kontaktu ze skórą (czynnik drażniący), kontaktu z oczami (czynnik drażniący), wdychania | ||
|
Klasyfikacja UE (DSD) (nieaktualna)
|
 
|
||
| NFPA 704 (ognisty diament) | |||
| NIOSH (limity ekspozycji dla zdrowia w USA): | |||
|
PEL (dopuszczalne)
|
TWA 15 mg/m 3 (całkowita) TWA 5 mg/m 3 (odp.) | ||
|
REL (zalecane)
|
TWA 10 mg/m 3 (całkowita) TWA 5 mg/m 3 (odp.) | ||
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
NS | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
kobaltocen , nikielocen , chromocen , rutenocen , osmocen , plumbocen | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Ferrocen to związek metaloorganiczny o wzorze Fe(C
5h
5)
2. Cząsteczka składa się z dwóch pierścieni cyklopentadienylowych związanych po przeciwnych stronach centralnego atomu żelaza . Jest to pomarańczowe ciało stałe o zapachu podobnym do kamfory, które sublimuje powyżej temperatury pokojowej i jest rozpuszczalne w większości rozpuszczalników organicznych. Charakteryzuje się stabilnością: jest odporny na działanie powietrza, wody, mocnych zasad i może być podgrzewany do 400°C bez rozkładu. W warunkach utleniających może reagować odwracalnie z mocnymi kwasami, tworząc kation żelazocenowy Fe(C
5h
5)+
2.
Szybki rozwój chemii metaloorganicznej jest często przypisywany podnieceniu wynikającemu z odkrycia ferrocenu i jego wielu analogów ( metalocenów ).
Historia
Odkrycie
Ferrocen odkryto przypadkiem — trzykrotnie. Pierwsza znana synteza mogła zostać dokonana pod koniec lat 40. XX wieku przez nieznanych badaczy z Union Carbide , którzy próbowali przepuścić gorące opary cyklopentadienu przez żelazną rurę. Para weszła w reakcję ze ścianą rury, tworząc „żółty szlam”, który zatykał rurę. Wiele lat później próbka szlamu, który został uratowany, została pobrana i przeanalizowana przez E. Brimma , wkrótce po przeczytaniu artykułu Kealy i Pausona, i okazało się, że składa się z ferrocenu.
Drugi raz miał miejsce około 1950 roku, kiedy S. Miller , J. Tebboth i J. Tremaine , badacze z British Oxygen , próbowali zsyntetyzować aminy z węglowodorów i azotu w modyfikacji procesu Habera . Kiedy próbowali reagować cyklopentadienem z azotem w temperaturze 300 °C, pod ciśnieniem atmosferycznym, byli rozczarowani, widząc, że węglowodór reaguje z jakimś źródłem żelaza, dając ferrocen. Chociaż oni również zaobserwowali jego niezwykłą stabilność, odłożyli obserwację na bok i opublikowali ją dopiero po tym, jak Pauson przedstawił swoje odkrycia. W rzeczywistości, Kealy i Pauson otrzymali próbkę od Millera i wsp., którzy potwierdzili, że produkty są tym samym związkiem.
W 1951 roku, Peter L. Pauson i Thomasa J. Kealy w Duquesne University próbowano przygotować fulvalene ( (C
5h
4)
2) przez oksydacyjną dimeryzację cyklopentadienu ( C
5h
6). W tym celu poddali reakcji bromek cyklopentadienylomagnezowy związku Grignarda w eterze dietylowym z chlorkiem żelazowym jako utleniaczem. Jednak zamiast oczekiwanego fulwalenu uzyskali jasnopomarańczowy proszek o „niezwykłej stabilności”, o wzorze C
10h
10Fe .
Ustalenie struktury
Pauson i Kealy przypuszczali, że związek ma dwie grupy cyklopentadienylowe, każda z pojedynczym wiązaniem kowalencyjnym od nasyconego atomu węgla do atomu żelaza. Jednak ta struktura była niezgodna z istniejącymi wówczas modelami wiązania i nie wyjaśniała nieoczekiwanej stabilności związku, a chemicy mieli trudności ze znalezieniem prawidłowej struktury.
Struktura została wydedukowana i zgłoszona niezależnie przez trzy grupy w 1952 roku:
- Woodward i Wilkinson wywnioskowali to obserwując, że ferrocen ulegał reakcjom typowym dla związków aromatycznych, takich jak benzen
- E. Fischer wydedukował strukturę (którą nazwał „podwójnym stożkiem”), a także zsyntetyzował inne metaloceny, takie jak niklocen i kobaltocen .
- PF Eiland i R. Pepinsky potwierdzili strukturę za pomocą krystalografii rentgenowskiej, a później metodą NMR .
Zrozumienie struktury
„Kanapkowa” struktura ferrocenu była szokująco nowa i wymagała nowej teorii do wyjaśnienia. Zastosowanie teorii orbitali molekularnych przy założeniu centrum Fe 2+ pomiędzy dwoma anionami cyklopentadienidowymi C
5h−
5zaowocował udanym modelem Dewara-Chatta-Duncansona , pozwalającym na prawidłowe przewidywanie geometrii cząsteczki, a także wyjaśniającym jej niezwykłą stabilność.
Uderzenie
Ferrocen nie był pierwszym znanym związkiem metaloorganicznym. Sól Zeise'a K[PtCl
3(C
2h
4)]·H 2 O odnotowano w 1831 r., odkrycie Ni(CO) 4 przez Monda miało miejsce w 1888 r., a związki litoorganiczne zostały opracowane w latach 30. XX wieku. Można jednak argumentować, że to odkrycie ferrocenu zapoczątkowało chemię metaloorganiczną jako odrębną dziedzinę chemii. Doprowadziło to również do eksplozji zainteresowania związkami metali bloku d z węglowodorami.
Odkrycie to zostało uznane za tak znaczące, że Wilkinson i Fischer podzielił 1973 Nagrodę Nobla w dziedzinie chemii „za pionierskie prace, wykonywane niezależnie, na chemii metaloorganicznych, tak zwane związki sandwich ”.
Struktura i klejenie
Spektroskopia mössbauerowska wskazuje, że centrum żelaza w ferrocenie należy przypisać stopień utlenienia +2. Każdemu pierścieniowi cyklopentadienylowemu (Cp) należy następnie przypisać pojedynczy ładunek ujemny. Tak więc ferrocen można opisać jako bis( cyklopentadienid ) żelaza(II ), Fe 2+ [C
5h−
5]
2.
Liczba elektronów π na każdym pierścieniu wynosi wtedy sześć, co czyni go aromatycznym zgodnie z regułą Hückla . Te dwanaście elektronów π jest następnie dzielonych z metalem poprzez wiązanie kowalencyjne. Ponieważ Fe 2+ ma sześć d-elektronów, kompleks osiąga konfigurację 18-elektronową , co odpowiada za jego stabilność. We współczesnej notacji ten kanapkowy model strukturalny cząsteczki ferrocenu jest oznaczony jako Fe ( η5
-C
5h
5)
2.
Odległości wiązań węgiel-węgiel wokół każdego pięcioczłonowego pierścienia wynoszą wszystkie 1,40 Å, a odległości wiązań Fe-C wynoszą wszystkie 2,04 Å. Od temperatury pokojowej do 164 K, krystalografia rentgenowska daje jednoskośną grupę przestrzenną; pierścienie cyklopentadienidowe są konformacją przesuniętą, w wyniku czego powstaje cząsteczka centrosymetryczna z grupą symetrii D 5d . Jednak poniżej 110 K ferrocen krystalizuje w rombowej sieci krystalicznej, w której pierścienie Cp są uporządkowane i zaćmione, tak że cząsteczka ma grupę symetrii D 5h . W fazie gazowej dyfrakcja elektronów i badania obliczeniowe pokazują, że pierścienie Cp są zaćmione.
Pierścienie Cp obracają się z niską barierą wokół osi Cp (centroid) –Fe–Cp (centroid) , co zaobserwowano w pomiarach podstawionych pochodnych ferrocenu za pomocą spektroskopii magnetycznego rezonansu jądrowego 1 H i 13 C. Na przykład, methylferrocene (CH 3 C 5 H 4 FeC 5 H 5 ) wykazuje singlet do C 5 H 5 pierścienia.
Synteza
Synteza przemysłowa
Przemysłowo ferrocen jest syntetyzowany w reakcji etanolanu żelaza(II) z cyklopentadienem; potrzebny etanolan żelaza(II) jest wytwarzany przez elektrochemiczne utlenianie metalicznego żelaza w bezwodnym etanolu . Ponieważ reakcja między etanolanem żelaza(II) a cyklopentadienem wytwarza etanol jako produkt uboczny, etanol skutecznie służy jako katalizator całej reakcji, przy czym reakcja netto to Fe + 2C 5 H 6 → H 2 + Fe(C 5 H 5 ) 2 ( patrz również poniżej )
Przez odczynnik Grignarda
Pierwsze zgłoszone syntezy ferrocenu były niemal równoczesne. Pauson i Kealy zsyntetyzowali ferrocen przy użyciu chlorku żelaza(III) i odczynnika Grignarda, bromku cyklopentadienylomagnezowego. Chlorek żelaza(III) zawiesza się w bezwodnym eterze dietylowym i dodaje do odczynnika Grignarda. Następuje reakcja redoks, w wyniku której powstaje rodnik cyklopentadienylowy i jony żelaza(II). Dihydrofulwalen jest wytwarzany przez rekombinację rodnikowo-rodnikową, podczas gdy żelazo (II) reaguje z odczynnikiem Grignarda, tworząc ferrocen. Utlenianie dihydrofulwalenu do fulwalenu żelazem(III), do którego dążyli Kealy i Pauson, nie występuje.
Reakcja gaz-metal
Inną wczesną syntezę ferrocenu przeprowadzili Miller i in. , który reagował metaliczne żelazo bezpośrednio z cyklopentadienem w fazie gazowej w podwyższonej temperaturze. Zgłoszono również podejście wykorzystujące pentakarbonyl żelaza .
- Fe(CO) 5 + 2 C 5 H 6 (g) → Fe(C 5 H 5 ) 2 + 5 CO(g) + H 2 (g)
Przez alkaliczny cyklopentadienid
Bardziej wydajnymi metodami preparatywnymi są na ogół modyfikacja oryginalnej sekwencji transmetalacji przy użyciu albo dostępnego w handlu cyklopentadienku sodu, albo świeżo krakowanego cyklopentadienu odprotonowanego wodorotlenkiem potasu i poddanego reakcji z bezwodnym chlorkiem żelaza(II) w rozpuszczalnikach eterowych.
Współczesne modyfikacje oryginalnego podejścia Grignarda Pausona i Kealy'ego są znane:
- Stosując cyklopentadienek sodu: 2 NaC 5 H 5 + FeCl 2 → Fe(C 5 H 5 ) 2 + 2 NaCl
- Stosując świeżo krakowany cyklopentadien: FeCl 2 ·4H 2 O + 2 C 5 H 6 + 2 KOH → Fe(C 5 H 5 ) 2 + 2 KCl + 6 H 2 O
- Stosując sól żelaza(II) z odczynnikiem Grignarda: 2 C 5 H 5 MgBr + FeCl 2 → Fe(C 5 H 5 ) 2 + 2 MgBrCl
Nawet niektóre zasady aminowe (takie jak dietyloamina ) mogą być użyte do deprotonowania, chociaż reakcja przebiega wolniej niż przy użyciu silniejszych zasad:
- 2 C 5 H 6 + 2 (CH 3 CH 2 ) 2 NH + FeCl 2 → Fe(C 5 H 5 ) 2 + 2 (CH 3 CH 2 ) 2 NH 2 Cl
Bezpośrednią transmetalację można również zastosować do przygotowania ferrocenu z innych metalocenów, takich jak manganocen :
- FeCl 2 + Mn (C 5 H 5 ) 2 → MnCI 2 + Fe (C 5 H 5 ) 2
Nieruchomości
Ferrocen to stabilne w powietrzu pomarańczowe ciało stałe o zapachu przypominającym kamforę. Jak oczekiwano dla symetrycznych, nienaładowanych związków, ferrocen jest rozpuszczalny w normalnych rozpuszczalnikach organicznych, takich jak benzen, ale jest nierozpuszczalny w wodzie. Jest odporny na temperatury do 400 °C.
Ferrocen łatwo ulega sublimacji , zwłaszcza po podgrzaniu w próżni. Jego prężność pary wynosi około 1 Pa w 25 °C, 10 Pa w 50 °C, 100 Pa w 80 °C, 1000 Pa w 116 °C i 10 000 Pa (prawie 0,1 atm ) w 162 °C.
Reakcje
Z elektrofilami
Ferrocen podlega wielu reakcjom charakterystycznym dla związków aromatycznych, umożliwiając otrzymanie podstawionych pochodnych. Powszechnym doświadczeniem licencjackim jest reakcja Friedla-Craftsa ferrocenu z bezwodnikiem octowym (lub chlorkiem acetylu ) w obecności kwasu fosforowego jako katalizatora. W warunkach reakcji Mannicha ferrocen daje N,N-dimetyloaminometyloferrocen .
Protonowanie ferrocenu umożliwia izolację [Cp 2 FeH]PF 6 .
W obecności chlorku glinu Me 2 NPCl 2 i ferrocenu reagują dać ferrocenylo dichlorophosphine, podczas leczenia phenyldichlorophosphine w warunkach podobnych do formy P , P -diferrocenyl- P fenylo fosfiny.
Ferrocen reaguje z P 4 S 10 tworząc disiarczek diferrocenylo-ditiadifosfetanu.
Litacja
Ferrocen reaguje z butylolitem, dając 1,1′-dilitioferrocen, który jest wszechstronnym nukleofilem . Tert-butylolit wytwarza monolitioferrocen. Reaguje Dilithioferrocene o S 8 , chlorophosphines i chlorosilanów . Naprężone związki ulegają polimeryzacji z otwarciem pierścienia .
Fosfiny, 1,1'-bis (difenylofosfino) ferrocen (dppf) wytwarza się z dilithioferrocene.
Chemia redoks
Ferrocen ulega utlenianiu jednoelektronowemu przy około 0,5 V w porównaniu z nasyconą elektrodą kalomelową (SCE), stając się ferrocenem . To odwracalne utlenianie jest stosowane jako standard w elektrochemii, ponieważ Fc + /Fc = 0,40 V w porównaniu ze standardową elektrodą wodorową . Częstym odczynnikiem jest tetrafluoroboran ferrocenu . Niezwykle odwracalne zachowanie utleniania-redukcji jest szeroko stosowane do kontrolowania procesów przenoszenia elektronów w układach elektrochemicznych i fotochemicznych.

Podstawniki na ligandach cyklopentadienylowych zmieniają potencjał redoks w oczekiwany sposób: grupy elektronoakceptorowe, takie jak kwas karboksylowy, przesuwają potencjał w kierunku anodowym ( czyli stają się bardziej dodatnie), podczas gdy grupy uwalniające elektrony, takie jak grupy metylowe , przesuwają potencjał w katodowej kierunku (bardziej ujemna). Tak więc dekametyloferrocen jest znacznie łatwiej utleniany niż ferrocen i może nawet zostać utleniony do odpowiedniego wskazania. Ferrocen jest często używany jako wzorzec wewnętrzny do kalibracji potencjałów redoks w elektrochemii niewodnej .
Stereochemia podstawionych ferrocenów
Dipodstawione ferroceny mogą występować jako izomery 1,2-, 1,3- lub 1,1'-, z których żaden nie jest wzajemnie konwertowalny. Ferroceny asymetrycznie dipodstawione na jednym pierścieniu są chiralne – np. [CpFe(EtC 5 H 3 Me)]. Ta planarna chiralność powstaje pomimo tego, że żaden pojedynczy atom nie jest centrum stereogenicznym . Podstawiony ferrocen przedstawione po prawej stronie (4- (dimetyloamino) pirydyny pochodna) okazał się być skuteczne, gdy stosuje się do rozdziału kinetycznego z racemicznych drugorzędowych alkoholi . Opracowano kilka podejść do asymetrycznej 1,1'-funkcjonalizacji ferrocenu.
Zastosowania ferrocenu i jego pochodnych
Ferrocen i jego liczne pochodne nie mają zastosowań na dużą skalę, ale mają wiele zastosowań niszowych, które wykorzystują niezwykłą strukturę (rusztowania ligandowe, kandydaci na leki), wytrzymałość (preparaty przeciwstukowe, prekursory materiałów) i redox (odczynniki i standardy redox) .
Jako rusztowanie ligandowe
Ferrocenylowe chiralne fosfiny są stosowane jako ligandy dla metali przejściowych katalizowanych reakcjach. Niektóre z nich znalazły zastosowanie przemysłowe w syntezie farmaceutyków i agrochemikaliów. Na przykład, difosfinowy -1,1'-bis (difenylofosfino) ferrocen (dppf) jest ceniony za palladu - Reakcje sprzęgania i Josiphos ligand jest przydatny do katalizowania uwodornienia. Zostały nazwane na cześć technika, który stworzył pierwszy, Josi Puleo.
Dodatki do paliw
Ferrocen i jego pochodne to środki przeciwstukowe stosowane w paliwie do silników benzynowych . Są bezpieczniejsze niż dotychczas stosowany tetraetyloołów . Roztwory dodatków do benzyny zawierające ferrocen mogą być dodawane do benzyny bezołowiowej, aby umożliwić jej stosowanie w samochodach zabytkowych zaprojektowanych do pracy na benzynie ołowiowej. W żelaza złoża Niezawierające utworzone z ferrocenu, mogą tworzyć przewodzącej powłoki na świecy powierzchni. Kopolimery ferrocenowo-poliglikolowe, otrzymywane w wyniku reakcji polikondensacji pomiędzy pochodną ferrocenu i podstawionym alkoholem dihydroksylowym, są obiecujące jako składnik paliw rakietowych. Kopolimery te zapewniają propelentom rakietowym stabilność cieplną, służąc jako spoiwo paliwa i kontrolując szybkość spalania paliwa.
Stwierdzono, że ferrocen skutecznie redukuje dym i trójtlenek siarki wytwarzany podczas spalania węgla. Dodanie dowolnymi praktycznymi środkami, impregnując węgiel lub dodając ferrocen do komory spalania, może znacznie zmniejszyć ilość tych niepożądanych produktów ubocznych, nawet przy niewielkiej ilości metalicznego związku cyklopentadienylowego.
Farmaceutyczny
Pochodne ferrocenu były badane jako leki. Tylko jeden lek wszedł do badań klinicznych, Ferroquine (7-chloro-N-(2-((dimetyloamino)metylo)ferrocenylo)chinolin-4-amina), środek przeciwmalaryczny . Zbadano systemy dostarczania leków na bazie polimerów zawierające ferrocen.
Aktywność przeciwnowotworową pochodnych ferrocenu po raz pierwszy zbadano pod koniec lat siedemdziesiątych, kiedy pochodne zawierające grupy aminowe lub amidowe testowano przeciwko białaczce limfocytowej . Niektóre sole ferrocenu wykazują działanie przeciwnowotworowe, ale żaden związek nie był oceniany w klinice. Pochodne ferrocenu wykazują silne działanie hamujące wobec linii komórek ludzkiego raka płuc A549, linii komórek raka jelita grubego HCT116 i linii komórek raka piersi MCF-7. Doniesiono o eksperymentalnym leku, który jest ferrocenylową wersją tamoksyfenu . Pomysł polega na tym, że tamoksyfen zwiąże się z miejscami wiązania estrogenu , powodując cytotoksyczność.
Ferocyfeny są wykorzystywane do zastosowań nowotworowych przez francuską firmę biotechnologiczną Feroscan, założoną przez prof. Gerarda Jaouena.
Stałe paliwo rakietowe
Ferrocen i pokrewne pochodne są stosowane jako potężne katalizatory szybkości spalania w złożonym paliwie pędnym nadchloranu amonu .
Pochodne i odmiany
Analogi ferrocenu można wytworzyć z wariantami cyklopentadienylu. Na przykład, bis indenyliron i bisfluorenyliron.
Atomy węgla mogą być zastąpione przez heteroatomy, jak ilustrują Fe( η 5- C 5 Me 5 )( η 5- P 5 ) i Fe( η 5- C 5 H 5 )( η 5- C 4 H 4 N) (" azaferrocen "). Azaferrocene powstaje dekarbonylację Fe ( η 5 -Ci 5 H 5 ) (CO) 2 ( η 1 -pirolo) w cykloheksanie . Związek ten podczas gotowania pod chłodnicą zwrotną w benzenie przekształca się w ferrocen.
Ze względu na łatwość podstawienia przygotowano wiele nietypowych strukturalnie pochodnych ferrocenu. Na przykład, ligand penta(ferrocenylo)cyklopentadienylowy zawiera anion cyklopentadienylowy derywatyzowany pięcioma podstawnikami ferrocenowymi.
W hexaferrocenylbenzene C 6 [( η 5 -Ci 5 H 4 ), Fe ( η 5 -Ci 5 H 5 )] 6 , wszystkie sześć pozycji na benzen cząsteczki mają podstawniki ferrocenylowe ( R ). Analiza dyfrakcji rentgenowskiej tego związku potwierdza, że ligandy cyklopentadienylowe nie są współpłaszczyznowe z rdzeniem benzenowym, ale mają naprzemienne kąty dwuścienne wynoszące +30° i -80°. Ze względu na stłoczenie steryczne ferrocenyle są lekko wygięte pod kątem 177° i mają wydłużone wiązania C-Fe. Czwartorzędowe atomy węgla cyklopentadienylowego są również piramidalizowane . Ponadto, rdzeń benzen ma konformację fotela z dwuściennym kącie 14 ° i wyświetla długość wiązania naprzemienne 142,7 pm i 141,1 pm, oba wskazania sterycznych skupienia podstawników.
Syntezę heksaferrocenylobenzenu opisano przy użyciu sprzęgania Negishi heksajodidobenzenu i diferrocenylocynku, przy użyciu tris(dibenzylidenoacetono)dipalladu (0) jako katalizatora w tetrahydrofuranie :
Wydajność wynosi tylko 4%, co stanowi kolejny dowód, zgodny ze znaczną zawady nagromadzenie wokół rdzenia aren.
Chemia materiałów
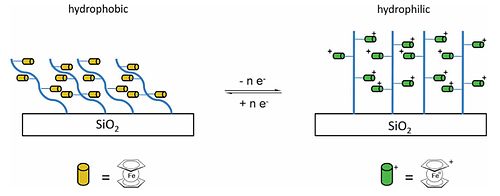
Ferrocen, prekursor nanocząstek żelaza, może być stosowany jako katalizator do produkcji nanorurek węglowych. Vinylferrocene można wytwarzać przez reakcję Wittiga z aldehydem , w soli fosfoniowej i wodorotlenek sodu . Winyl ferrocen można przekształcić w polimer (poliwinyloferrocen, PVFc), ferrocenylową wersję polistyrenu (grupy fenylowe są zastąpione grupami ferrocenylowymi). Innym poliferrocenem, który można wytworzyć, jest poli(2-(metakryloiloksy)ferrocenokarboksylan etylu), PFcMA. Oprócz stosowania organicznych szkielety polimerowe, te jednostki zawieszka ferrocenu zostały dołączone do nieorganicznych trzony, takie jak polisiloksany , polifosfazeny i poli phosphinoboranes (-PH (R) -bh 2 -) n i otrzymane materiały wykazują niezwykłe fizyczne i elektryczne właściwości związane z parą redoks ferrocen / ferrocinium. Zarówno PVFc, jak i PFcMA zostały przywiązane do wafli krzemionkowych, a zwilżalność mierzono, gdy łańcuchy polimeru są nienaładowane i gdy ugrupowania ferrocenowe są utlenione z wytworzeniem dodatnio naładowanych grup. Kąt kontaktu z wodą na wafle PFcMA pokrytego 70 ° mniejszy następuje utlenianie, podczas gdy w przypadku PVFc zmniejszenie wynosi 30 °, a przełączanie zwilżalności, jest odwracalny. W przypadku PFcMA efektem wydłużenia łańcuchów, a tym samym wprowadzenia większej liczby grup ferrocenowych, jest znacznie większa redukcja kąta zwilżania po utlenieniu.
Zobacz też
Bibliografia
- ^ Międzynarodowa Unia Chemii Czystej i Stosowanej (2014). Nomenklatura chemii organicznej: zalecenia IUPAC i preferowane nazwy 2013 . Królewskie Towarzystwo Chemiczne . P. 1041. doi : 10.1039/9781849733069 . Numer ISBN 978-0-85404-182-4.
- ^ „Ferrocen (102-54-5)” . Źródło 3 lutego 2010 .
- ^ "FERROCENE_msds" .
- ^ Lide, DR, wyd. (2005). CRC Handbook of Chemistry and Physics (wyd. 86.). Boca Raton (FL): CRC Press. P. 3.258. Numer ISBN 0-8493-0486-5.
- ^ Mohammadi, Narges; Ganesan, Aravindhan; Chantler, Christopher T.; Wang, Feng (2012). „Zróżnicowanie konformerów ferrocenu D5d i D5h za pomocą spektroskopii IR”. Czasopismo Chemii Metaloorganicznej . 713 : 51–59. doi : 10.1016/j.jorganchem.2012.04.09 .
- ^ "Karta charakterystyki materiału. Ferrocen. MSDS # 03388. Sekcja" (PDF) . Uniwersytet Stanowy Northwest Missouri .
- ^ "MSDS ferrocenu" . Laboratorium Naukowe . Zarchiwizowane od oryginału w dniu 2015-12-12 . Pobrano 25.11.2015 .
- ^ a b c Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych. „#0205” . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ B c d e Werner, H (2012). „Co najmniej 60 lat ferrocenu: odkrycie i ponowne odkrycie kompleksów kanapkowych”. Angew. Chem. wewn. Wyd. 51 (25): 6052-6058. doi : 10.1002/anie.201201598 . PMID 22573490 .
- ^ B c d Pauson Peter L. (2001). „Ferrocen – jak to wszystko się zaczęło”. Czasopismo Chemii Metaloorganicznej . 637–639: 3–6. doi : 10.1016/S0022-328X(01)01126-3 .
- ^ B c Miller, SA; Teboth, JA; Tremaine, JF (1952). „114. Dicyklopentadienyliron”. J.Chem. Soc. : 632–635. doi : 10.1039/JR9520000632 .
- ^ B c Laszlo Pierre; Hoffmanna, Roalda (2000). „Ferrocen: Ironclad History czy Rashomon Tale?” (PDF) . Angewandte Chemie Wydanie Międzynarodowe . 39 (1): 123–124. doi : 10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z . PMID 10649350 .
- ^ a b c Kealy, TJ; Pauson, PL (1951). „Nowy rodzaj związku organicznego żelaza”. Natura . 168 (4285): 1039-1040. Kod bib : 1951Natur.168.1039K . doi : 10.1038/1681039b0 . S2CID 4181383 .
- ^ Federman Neto, Alberto; Pelegrino, Alessandra Caramori; Darin, Vitor André (2004). „Ferrocen: 50 lat chemii metaloorganicznej metali przejściowych — od chemii organicznej i nieorganicznej do chemii supramolekularnej (streszczenie)” . Trendy w chemii metaloorganicznej . Trendy badawcze . 4 : 147–169.
- ^ Werner, H. (2008). Punkty orientacyjne w chemii metaloorganicznej przejściowej: osobiste spojrzenie . Nowy Jork: Springer Science. s. 161–63. Numer ISBN 978-0-387-09847-0.
- ^ Wilkinson, G. ; Rosenblum, M.; Witlinek, MC; Woodward, RB (1952). „Struktura żelaza bis- cyklopentadienyl”. J. Am. Chem. Soc. 74 (8): 2125–2126. doi : 10.1021/ja01128a527 .
- ^ Fischer, EO ; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [O strukturze krystalicznej związków bis-cyklopentadienylowych dwuwartościowego żelaza, kobaltu i niklu]. Zeitschrift für Anorganische und Allgemeine Chemie (w języku niemieckim). 7 (6): 377–339. doi : 10.1002/zaac.19532740603 .
- ^ Fischer, EO ; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [O strukturze krystalicznej związków bis-cyklopentadienylowych dwuwartościowego żelaza, kobaltu i niklu]. Zeitschrift für Naturforschung B . 7 (7): 377–379. doi : 10.1515/znb-1952-0701 .
- ^ Okuda, czerwiec (28.12.2016). „Ferrocen – 65 lat później”. Europejski Dziennik Chemii Nieorganicznej . 2017 (2): 217–219. doi : 10.1002/ejic.201601323 . ISSN 1434-1948 .
- ^ B Eiland Philip Frank; Pepinsky, Ray (1952). „Badanie rentgenowskie żelaza biscyklopentadienyl”. J. Am. Chem. Soc. 74 (19): 4971. doi : 10.1021/ja01139a527 .
- ^ Dunitz, JD; Orgel, LE (1953). „Bis-cyklopentadienyl - kanapka molekularna”. Natura . 171 (4342): 121-122. Kod Bib : 1953Natur.171..121D . doi : 10.1038/171121a0 . S2CID 4263761 .
- ^ Dunitz, J.; Orgel, L.; Rich, A. (1956). „Struktura krystaliczna ferrocenu” . Acta Crystallogr. 9 (4): 373–375. doi : 10.1107/S0365110X5601091 .
- ^ Mingos, DMP (2001). „Historyczna perspektywa wkładu Landmark Dewara do chemii metaloorganicznej”. J. Organom. Chem. 635 (1–2): 1–8. doi : 10.1016/S0022-328X(01)01155-X .
- ^ Mehrotra, RC; Singh, A. (2007). Chemia metaloorganiczna: ujednolicone podejście (2nd ed.). New Delhi: New Age International. s. 261-67. Numer ISBN 978-81-224-1258-1.
- ^ Zeise, WC (1831). "Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen" . Annalen der Physik (w języku niemieckim). 97 (4): 497-541. Kod bib : 1831AnP....97..497Z . doi : 10.1002/andp.18310970402 .
- ^ Polowanie, LB (1984). „Pierwsze związki metaloorganiczne: William Christopher Zeise i jego kompleksy platyny” (PDF) . Metale platynowe Rev. 28 (2): 76-83.
- ^ Leigh, GJ; Winterton, N., wyd. (2002). Współczesna chemia koordynacyjna: dziedzictwo Josepha Chatta . Cambridge, Wielka Brytania: Wydawnictwo RSC. s. 101–10. Numer ISBN 978-0-85404-469-6.
- ^ Eisch, John J. (2002). „Henry Gilman: amerykański pionier w rozwoju chemii metaloorganicznej we współczesnej nauce i technologii†” . Metaloorganiczne . 21 (25): 5439-5463. doi : 10.1021/om0109408 . ISSN 0276-7333 .
- ^ „Nagroda Nobla w dziedzinie chemii 1973” . Fundacja Nobla . Źródło 12 września 2010 .
- ^ Seiler, P.; Dunitz, JD (1982). "Niskotemperaturowa krystalizacja rombowego ferrocenu: analiza struktury w 98 K" . Acta Crystallographica Sekcja B . 38 (6): 1741-1745. doi : 10.1107/s0567740882007080 . ISSN 0567-7408 .
- ^ Haaland, A.; Nilsson, JE (1968). „Określanie barier dla rotacji wewnętrznej za pomocą dyfrakcji elektronów. Ferrocen i rutenocen” . Acta Chem. Skanowanie. 22 : 2653–2670. doi : 10.3891/acta.chem.scand.22-2653 .
- ^ Coriani, Sonia; Haaland, Arne; Helgaker, Trygve; Jørgensen, Poul (2006). „Struktura równowagi ferrocenu”. ChemPhysChem . 7 (1): 245–249. doi : 10.1002/cphc.200500339 . PMID 16404766 .
- ^ Abla, EW; Długie, NJ; Orrella, KG; Osborne AG; Sik, V. (1991). „Dynamiczne badania NMR rotacji pierścieni w podstawionych ferrocenach i rutenocenach”. J.Org. Chem. 403 (1–2): 195–208. doi : 10.1016/0022-328X(91)83100-I .
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/7611
- ^ Wilkinson, G. ; Pauson, PL ; Bawełna, FA (1954). „Bis-cyklopentadienylowe związki niklu i kobaltu”. J. Am. Chem. Soc. 76 (7): 1970. doi : 10.1021/ja01636a080 .
- ^ Wilkinson, G. ; Bawełna, FA (1959). „Cyklopentadienyl i związki metali arenowych”. Postęp w chemii nieorganicznej . 1 . s. 1–124. doi : 10.1002/9780470166024.ch1 . Numer ISBN 978-0-470-16602-4.
- ^ B Wilkinson, G. (1956). „Ferrocen”. Syntezy organiczne . 36 : 31. doi : 10.15227/orgsyn.036.0031 .
- ^ Wesoły, WL (1970). Synteza i charakterystyka związków nieorganicznych . New Jersey: Prentice Hall.
- ^ Wilkinson, G. ; Bawełna, FA ; Birmingham, JM (1956). „Na cyklopentadienku manganu i niektórych reakcjach chemicznych obojętnych związków metali bis-cyklopentadienylowych”. J. Inorg. Nukl. Chem. 2 (2): 95. doi : 10.1016/0022-1902(56)80004-3 .
- ^ Salomona, Grahama; Fryhle, Craig (2006). Chemia organiczna (wyd. 9). USA: John Wiley i synowie.
- ^ Monte, Manuel JS; Santos, Luís MNBF; Fulem, Michał; Fonseca, José MS; Sousa, Carlos AD (2006). „Nowa aparatura statyczna i prężność par materiałów odniesienia: naftalen, kwas benzoesowy, benzofenon i ferrocen”. J.Chem. inż. Dane . 51 (2): 757. doi : 10.1021/je050502y .
- ^ Fulem Michał; Růžička, Květoslav; Červinka, Ctirad; Rocha, Marisa AA; Santos, Luís MNBF; Berg, Robert F. (2013). „Zalecana prężność pary i dane termofizyczne dla ferrocenu”. Czasopismo Termodynamiki Chemicznej . 57 : 530–540. doi : 10.1016/j.jct.2012.07.023 .
- ^ Malischewski, Moritz; Seppelta, Konrada; Sutter, Jörg; Heinemann, Frank W.; Dittrich, Birger; Meyer, Karsten (19.09.2017). „Protonowanie ferrocenu: niskotemperaturowe badanie dyfrakcji rentgenowskiej [Cp 2 FeH] (PF 6 ) ujawnia związany z żelazem ligand Hydrido”. Angewandte Chemie Wydanie Międzynarodowe . 56 (43): 13372–13376. doi : 10.1002/anie.201704854 . PMID 28834022 .
- ^ Knox, GR; Pauson, PL ; Willison, D. (1992). „Pochodne ferrocenu. 27. Ferrocenylodimetylofosfina”. Metaloorganiczne . 11 (8): 2930–2933. doi : 10.1021/om00044a038 .
- ^ Sollott, lekarz ogólny; Mertwoy, ON; Portnoy, S.; Snead, JL (1963). „Niesymetryczne fosfiny trzeciorzędowe ferrocenu przez reakcje Friedla-Craftsa. I. Ferrocenylofenylofosfiny”. J.Org. Chem. 28 (4): 1090–1092. doi : 10.1021/jo01039a055 .
- ^ Mark R. St. J. Foreman, Alexandra MZ Sławin, J. Derek Woollins (1996). "2,4-Diferrocenyl-1,3-dithiadiphosphetane 2,4-disiarczek; struktura i reakcje z katechole i [PtCI 2 (PR 3 ) 2 ] (R = Et lub BUN)". J.Chem. Soc., Dalton Trans. (18): 3653–3657. doi : 10.1039/DT9960003653 .CS1 maint: wiele nazwisk: lista autorów ( link )
- ^ Rebière, F.; Samuel, O.; Kagan, HB (1990). „Wygodna metoda otrzymywania monolitioferrocenu”. Czworościan Lett . 31 (22): 3121–3124. doi : 10.1016/S0040-4039(00)94710-5 .
- ^ Herbert, David E.; Mayer, Ulrich FJ; Maniery, Ian (2007). „Napięte metalocenofany i powiązane pierścienie metaloorganiczne zawierające ligandy pi-węglowodorowe i centra metali przejściowych”. Angew. Chem. wewn. Wyd. 46 (27): 5060-5081. doi : 10.1002/anie.200604409 . PMID 17587203 .
- ^ CE Housecroft & AG Sharpe, Chemia nieorganiczna wydanie 4 , 2012, s. 925.
- ^ Connelly, NG; Geigera, WE (1996). „Chemiczne środki redox dla chemii metaloorganicznej”. Chem. Obj. 96 (2): 877–910. doi : 10.1021/cr940053x . PMID 11848774 .
- ^ Sirbu, D.; Turta, C.; Gibson, EA; Benniston, AC (11.08.2015). „Efekt ferrocenu: zwiększona elektrokatalityczna produkcja wodoru przy użyciu kompleksów mezo-tetraferrocenyloporfirynopallad(II) i miedzi(II)” . Transakcje Daltona . 44 (33): 14646-14655. doi : 10.1039/C5DT02191J . ISSN 1477-9234 . PMID 26213204 .
- ^ Lennox, Alastair JJ; Nutting, Jordan E.; Stahl, Shannon S. (2018-01-03). „Selektywne elektrochemiczne generowanie rodników benzylowych umożliwione przez mediatory przenoszenia elektronów na bazie ferrocenu” . Nauka chemiczna . 9 (2): 356–361. doi : 10.1039/C7SC04032F . ISSN 2041-6539 . PMC 5909123 . PMID 29732109 .
- ^ Dannenberg, JJ; Richards, JH (1965-04-01). „Fotouczulanie przez ferrocen. Fotochemia wyższych elektronowych stanów wzbudzonych”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 87 (7): 1626-1627. doi : 10.1021/ja01085a048 . ISSN 0002-7863 .
- ^ Sirbu, D.; Turta, C.; Benniston, AC; Abou-Chahine, F.; Lemmetyinen, H.; Tkaczenko, NV; Drewno, C.; Gibson, E. (23.05.2014). „Synteza i właściwości porfiryny cynkowej(II) z dodatkiem mezotris-ferrocenu oraz krytyczna ocena działania ogniwa słonecznego sensybilizowanego barwnikiem (DSSC)” . Zaliczki RSC . 4 (43): 22733–22742. doi : 10.1039/C4RA03105A . ISSN 2046-2069 .
- ^ Malischewski, M.; Adelhardt, M.; Sutter, J.; Meyer, K.; Seppelt, K. (2016-08-12). „Izolacja i charakterystyka strukturalna i elektroniczna soli wskazania dekametyloferrocenu”. Nauka . 353 (6300): 678–682. Kod Bibcode : 2016Sci...353..678M . doi : 10.1126/science.aaf6362 . ISSN 0036-8075 . PMID 27516596 . S2CID 43385610 .
- ^ rubel, JC; Latham, Hawaje; Fu, GC (1997). „Skuteczna rozdzielczość kinetyczna drugorzędowych alkoholi z analogiem planarno-chiralnym 4-(dimetyloamino) pirydyny. Zastosowanie grupy Fe (C 5 Ph 5 ) w katalizie asymetrycznej”. J. Am. Chem. Soc. 119 (6): 1492–1493. doi : 10.1021/ja963835b .
- ^ Atkinson, Robert CJ; Gibson, Vernon C.; Długi, Nicholas J. (2004-06-08). „Syntezy i katalityczne zastosowania niesymetrycznych ligandów ferrocenowych” . Przeglądy Towarzystwa Chemicznego . 33 (5): 313–328. doi : 10.1039/B316819K . ISSN 1460-4744 . PMID 15272371 .
- ^ B Blaser Hans-Ulrich (2002). „Solvias Josiphos ligandy: od odkrycia do zastosowań technicznych”. Tematy w katalizie . 19 : 3–16. doi : 10.1023/a: 1013832630565 . S2CID 95738043 .
- ^ Qi-Lin Zhou (2011). Uprzywilejowane chiralne ligandy i katalizatory .
- ^ B Štěpnická Petr (2008). Ferroceny: ligandy, materiały i biomolekuły . Hoboken, NJ: J. Wiley. Numer ISBN 978-0-470-03585-6.
- ^ „Zastosowanie dodatków do paliw” (PDF) . Zarchiwizowane z oryginału (PDF) w dniu 2006-05-05.
- ^ US 4104036 , Chao, Tai S., "Kompozycje paliw silnikowych zawierających żelazo i sposób używania tego samego", opublikowany 1978-08-01
- ^ Dewey, Fred M. Ferrocene poliglikole. Patent USA 3 598 850, złożony 11 czerwca 1969 i wydany 10 sierpnia 1971. Dostępny: https://patentimages.storage.googleapis.com/6f/2a/1c/dad6147ea46bcb/US3598850.pdf
- ^ Kerley, Robert V. Proces i skład spalania węgla. Patent USA 3 927 992, złożony 23 listopada 1971 i wydany 23 grudnia 1975. Dostępny: https://patentimages.storage.googleapis.com/0d/03/57/c94e635d15e1fb/US3927992.pdf
- ^ Van Staveren, Dave R.; Metzler-Nolte, Nils (2004). „Chemia bioorganometaliczna ferrocenu”. Chem. Obj. 104 (12): 5931–5986. doi : 10.1021/cr0101510 . PMID 15584693 .
-
^ Biot, C.; Nosten, F.; Fraisse, L.; Ter-Minassian, D.; Khalife, J.; Nurkować, D. (2011). „Ferrochina przeciwmalaryczna: od ławki do kliniki” . Pasożyt . 18 (3): 207–214. doi : 10.1051/pasożyt/2011183207 . ISSN 1252-607X . PMC 3671469 . PMID 21894260 .

- ^ Roux, C.; Biot, C. (2012). „Leki przeciwmalaryczne na bazie ferrocenu”. Przyszłość Med. Chem . 4 (6): 783–797. doi : 10.4155/fmc.12.26 . PMID 22530641 .
- ^ Gu, Haibin; Mu, Shengdong; Qiu, Guirong; Liu, Xiong; Zhang, Li; Yuan, Yanfei; Astruc, Didier (czerwiec 2018). „Systemy dostarczania leków reagujących na bodźce Redox z supramolekularnymi polimerami zawierającymi ferrocenyl do kontrolowanego uwalniania”. Przeglądy chemii koordynacyjnej . 364 : 51–85. doi : 10.1016/j.ccr.2018.03.013 . ISSN 0010-8545 .
- ^ Ornelas, Catia (2011). „Zastosowanie ferrocenu i jego pochodnych w badaniach nad rakiem”. Nowy Czasopismo Chemii . 35 (10): 1973. doi : 10.1039/c1nj20172g . S2CID 56521492 .
- ^ Babin, VN; i in. (2014). „Ferroceny jako potencjalne leki przeciwnowotworowe. Fakty i hipotezy”. Russ. Chem. Byk . 63 (11): 2405-2422. doi : 10.1007/s11172-014-0756-7 . S2CID 94618726 .
- ^ Yong, Jianping i Lu, Canzhong. Pochodna ferrocenu, sposób otrzymywania i jej zastosowanie. Patent USA 9 738 673, złożony 29 listopada 2016 i wydany 22 sierpnia 2017. Dostępny: https://patentimages.storage.googleapis.com/dd/6e/d6/9fd8e3c5c96b67/US9738673.pdf
- ^ B Top, S .; Vessières, A.; Leclercq, G.; Quivy, J.; Tang, J.; Vaissermann, J.; Huche, M.; Jaouen, G. (2003). „Synteza, właściwości biochemiczne i badania modelowania molekularnego modulatorów metaloorganicznych specyficznych receptorów estrogenowych (SERM), ferrocyfeny i hydroksyferrocyfeny: dowody na działanie antyproliferacyjne hydroksyferrocyfenów na linie komórkowe raka piersi zależne od hormonów i niezależne od hormonów”. Chem. Eur. J. 9 (21): 5223-36. doi : 10.1002/chem.200305024 . PMID 14613131 .
- ^ Ron Dagani (16 września 2002). „Bio strona metaloorganicznych” . Wiadomości chemiczne i inżynieryjne . 80 (37): 23-29. doi : 10.1021/cen-v080n037.p023 .
- ^ "Katalizator szybkości spalania ferrocenu" . www.rocketmotorparts.com . Źródło 13.01.2020 .
- ^ Zakrzewski J.; Giannotti, Karol (1990). „Ulepszona synteza fotochemiczna azaferrocenu”. J. Organom. Chem. 388 (1–2): 175–179. doi : 10.1016/0022-328X(90)85359-7 .
- ^ Efraty, Avi; Jubran, Nusrallah; Goldman, Aleksander (1982). „Chemia niektórych kompleksów η 5 -pirolilo- i η 1 - N -pirolironu”. Inorg. Chem . 21 (3): 868. doi : 10.1021/ic00133a006 .
- ^ Yu, Y.; Bond, AD; Leonarda PW; Vollhardta, KPC; Wybielacz, GD (2006). „Syntezy, Struktury i reaktywność radialnych kompleksów metali oligocyklopentadienylowych: Penta (ferrocenyl) cyklopentadienyl i kongenery”. Angew. Chem. wewn. Wyd. 45 (11): 1794-1799. doi : 10.1002/anie.200504047 . PMID 16470902 .
- ^ B Yu Yong; Bond, Andrew D.; Leonard, Philip W.; Lorenz, Ulrich J.; Timofiejewa, Tatiana V.; Vollhardt, K. Peter C.; Wybielacz, Glenn D.; Jakowenko, Andrzej A. (2006). „Heksaferrocenylobenzen” . Chem. Komunia. (24): 2572–2574. doi : 10.1039/b604844g . PMID 16779481 .
- ^ B c Pietschnig Rudolf (2016). "Polimery z ferrocenami zawieszonymi" . Chem. Soc. Obj. 45 (19): 5216-5231. doi : 10.1039/C6CS00196C . PMID 27156979 .
- ^ Conroya, Devin; Moisalab, Anna; Cardosoa, Silvana; Windleb, Alan; Davidson, John (2010). „Reaktor nanorurek węglowych: rozkład ferrocenu, wzrost cząstek żelaza, agregacja nanorurek i powiększanie skali”. Chem. inż. Nauka. 65 (10): 2965–2977. doi : 10.1016/j.ces.2010.01.0119 .
- ^ Liu, Wan-yi; Xu, Qi-hai; Ma, Yong-xiang; Liang, Yong-min; Dong, Ning-li; Guan, De-Peng (2001). „Bezrozpuszczalnikowa synteza pochodnych ferrocenyletenu”. J. Organom. Chem. 625 : 128–132. doi : 10.1016/S0022-328X(00)00927-X .
- ^ Elbert, J.; Gallei, M.; Rüttiger, C.; Brunsen, A.; Didzolejt, H.; Stühn, B.; Rehahn, M. (2013). „Polimery ferrocenowe dla przełączalnej zwilżalności powierzchni”. Metaloorganiczne . 32 (20): 5873–5878. doi : 10.1021/om400468p .
Zewnętrzne linki
- Ferrocen w układzie okresowym wideo (University of Nottingham)
- Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych (Centra Kontroli i Zapobiegania Chorobom)


















