Glukoneogeneza - Gluconeogenesis
Glukoneogenezy ( GNG ) jest szlak metaboliczny , który prowadzi do wytwarzania glukozy z niektórymi nie- węglowodan substratów węglowych. Jest to wszechobecny proces, obecny w roślinach, zwierzętach, grzybach, bakteriach i innych mikroorganizmach. Kręgowców, glukoneogeneza występuje głównie w wątrobie i w mniejszym stopniu w korze z nerek . Jest to jeden z dwóch podstawowych mechanizmów – drugim jest degradacja glikogenu ( glikogenoliza ) – wykorzystywanego przez ludzi i wiele innych zwierząt w celu utrzymania poziomu cukru we krwi , unikając niskiego poziomu ( hipoglikemia ). U przeżuwaczy , ponieważ węglowodany zawarte w diecie mają tendencję do metabolizowania przez organizmy żwacza , glukoneogeneza zachodzi niezależnie od postu, diety niskowęglowodanowej, ćwiczeń itp. U wielu innych zwierząt proces ten zachodzi w okresach postu , głodu , diety niskowęglowodanowej lub intensywne ćwiczenia .
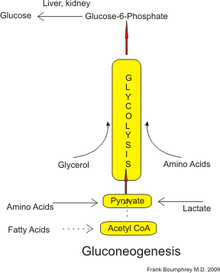
U ludzi substraty do glukoneogenezy mogą pochodzić z dowolnych źródeł innych niż węglowodany, które można przekształcić w pirogronian lub produkty pośrednie glikolizy (patrz rysunek). Do rozkładu białek substraty te obejmują aminokwasy glukogenne (chociaż nie aminokwasy ketogeniczne ); z rozpadu lipidów (takich jak triglicerydy ), obejmują glicerol , nieparzyste kwasy tłuszczowe (chociaż nie parzystołańcuchowe kwasy tłuszczowe, patrz poniżej); oraz z innych części metabolizmu zawierają mleczan z cyklu Cori . W warunkach przedłużonego postu aceton pochodzący z ciał ketonowych może również służyć jako substrat, zapewniając drogę od kwasów tłuszczowych do glukozy. Chociaż większość glukoneogenezy zachodzi w wątrobie, względny udział glukoneogenezy przez nerki jest zwiększony w przypadku cukrzycy i przedłużonego postu.
Ścieżka glukoneogenezy jest wysoce endergoniczna, dopóki nie zostanie sprzężona z hydrolizą ATP lub GTP , skutecznie czyniąc proces egzergicznym . Na przykład szlak prowadzący od pirogronianu do glukozo-6-fosforanu wymaga spontanicznego przebiegu 4 cząsteczek ATP i 2 cząsteczek GTP. Te ATP są dostarczane z katabolizmu kwasów tłuszczowych poprzez beta-oksydację .
Prekursory

- Aminokwasy glukogenne mają tę zdolność
- Aminokwasy ketogeniczne nie. Produkty te mogą być nadal używane do ketogenezy lub syntezy lipidów .
- Niektóre aminokwasy są katabolizowane zarówno do produktów glukogennych, jak i ketogenicznych.
U ludzi głównymi prekursorami glukoneogennymi są mleczan , glicerol (wchodzący w skład cząsteczki trójglicerydów ), alanina i glutamina . W sumie stanowią one ponad 90% całkowitej glukoneogenezy. Inne aminokwasy glukogenne i wszystkie produkty pośrednie cyklu kwasu cytrynowego (poprzez konwersję do szczawiooctanu ) mogą również działać jako substraty do glukoneogenezy. Ogólnie rzecz biorąc, spożywanie przez ludzi substratów glukoneogennych w żywności nie powoduje zwiększonej glukoneogenezy.
U przeżuwaczy propionian jest głównym substratem glukoneogennym. U zwierząt innych niż przeżuwacze, w tym u ludzi, propionian powstaje w wyniku β-oksydacji kwasów tłuszczowych o łańcuchach nieparzystych i rozgałęzionych, co jest (stosunkowo niewielkim) substratem glukoneogenezy.
Mleczan jest transportowany z powrotem do wątroby, gdzie jest przekształcany w pirogronian w cyklu Cori przy użyciu enzymu dehydrogenazy mleczanowej . Pirogronian, pierwszy wyznaczony substrat szlaku glukoneogennego, może być następnie wykorzystany do wytworzenia glukozy. Transaminacja lub deaminacja aminokwasów ułatwia wejście ich szkieletu węglowego do cyklu bezpośrednio (jako pirogronian lub szczawiooctan) lub pośrednio poprzez cykl kwasu cytrynowego. Udział mleczanu cyklu Cori w ogólnej produkcji glukozy wzrasta wraz z czasem trwania postu . W szczególności, po 12, 20 i 40 godzinach postu ochotników, udział mleczanu z cyklu Cori w glukoneogenezie wynosił odpowiednio 41%, 71% i 92%.
To, czy parzystołańcuchowe kwasy tłuszczowe mogą zostać przekształcone w glukozę u zwierząt, jest od dawna kwestią biochemii. Kwasy tłuszczowe o łańcuchach nieparzystych mogą zostać utlenione z wytworzeniem acetylo-CoA i propionylo-CoA , który służy jako prekursor sukcynylo-CoA , który może zostać przekształcony w pirogronian i wejść w glukoneogenezę. W przeciwieństwie do tego, kwasy tłuszczowe o parzystym łańcuchu są utleniane, dając tylko acetylo-CoA, którego wejście w glukoneogenezę wymaga obecności cyklu glioksylanowego (znanego również jako bocznik glioksylanowy), aby wytworzyć prekursory czterowęglowego kwasu dikarboksylowego. Bocznik glioksylanowy zawiera dwa enzymy, syntazę jabłczanową i liazę izocytrynianową, i występuje w grzybach, roślinach i bakteriach. Pomimo pewnych doniesień o aktywności enzymatycznej bocznikowania glioksylanu wykrytego w tkankach zwierzęcych, geny kodujące obie funkcje enzymatyczne znaleziono tylko u nicieni , w których występują one jako pojedynczy enzym dwufunkcyjny. Geny kodujące samą syntazę jabłczanową (ale nie liazę izocytrynianową) zidentyfikowano u innych zwierząt, w tym u stawonogów , szkarłupni , a nawet niektórych kręgowców . Ssaki posiadające gen syntazy jabłczanowej obejmują stekowce ( dziobak ) i torbacze ( oposy ), ale nie ssaki łożyskowe .
Istnienie cyklu glioksylanowego u ludzi nie zostało ustalone i powszechnie uważa się, że kwasy tłuszczowe nie mogą być bezpośrednio przekształcone w glukozę u ludzi. Wykazano, że węgiel-14 kończy się w glukozie, gdy jest dostarczany w kwasach tłuszczowych, ale można się tego spodziewać po włączeniu znakowanych atomów pochodzących z acetylo-CoA do półproduktów cyklu kwasu cytrynowego, które są wymienne z tymi pochodzącymi z innych źródeł fizjologicznych , takie jak aminokwasy glukogenne. W przypadku braku innych źródeł glukogennych, 2-węglowy acetylo-CoA pochodzący z utleniania kwasów tłuszczowych nie może wytwarzać wydajności netto glukozy w cyklu kwasu cytrynowego , ponieważ równoważne dwa atomy węgla są uwalniane jako dwutlenek węgla podczas cyklu. Jednak podczas ketozy acetylo-CoA z kwasów tłuszczowych wytwarza ciała ketonowe , w tym aceton , a do ~60% acetonu może zostać utlenione w wątrobie do prekursorów pirogronianowych acetolu i metyloglioksalu . Tak więc ciała ketonowe pochodzące z kwasów tłuszczowych mogą odpowiadać za do 11% glukoneogenezy podczas głodu. Katabolizm kwasów tłuszczowych wytwarza również energię w postaci ATP, która jest niezbędna w szlaku glukoneogenezy.
Lokalizacja
Uważa się, że u ssaków glukoneogeneza jest ograniczona do wątroby, nerek, jelit i mięśni, ale ostatnie dowody wskazują, że glukoneogeneza zachodzi w astrocytach mózgu. Narządy te wykorzystują nieco inne prekursory glukoneogenne. Wątroba preferencyjnie wykorzystuje mleczan, glicerol i aminokwasy glukogenne (zwłaszcza alaninę ), podczas gdy nerka preferencyjnie wykorzystuje mleczan, glutaminę i glicerol. Mleczan z cyklu Cori jest ilościowo największym źródłem substratu dla glukoneogenezy, zwłaszcza dla nerek. Wątroba wykorzystuje zarówno glikogenolizę, jak i glukoneogenezę do produkcji glukozy, podczas gdy nerka wykorzystuje tylko glukoneogenezę. Po posiłku wątroba przechodzi do syntezy glikogenu , podczas gdy nerka zwiększa glukoneogenezę. Jelito wykorzystuje głównie glutaminę i glicerol.
Propionian jest głównym substratem glukoneogenezy w wątrobie przeżuwaczy, a wątroba przeżuwaczy może w większym stopniu wykorzystywać aminokwasy glukoneogenne (np. alaninę) w przypadku zwiększonego zapotrzebowania na glukozę. U cieląt i jagniąt zdolność komórek wątroby do wykorzystania mleczanu do glukoneogenezy spada od stadium przedprzeżuwającego do stadium przeżuwacza. W tkance nerek owiec zaobserwowano bardzo wysokie tempo glukoneogenezy z propionianu.
U wszystkich gatunków tworzenie szczawiooctanu z pirogronianu i produktów pośrednich cyklu TCA jest ograniczone do mitochondrium, a enzymy przekształcające kwas fosfoenolopirogronowy (PEP) w glukozo-6-fosforan znajdują się w cytozolu. Lokalizacja enzymu, który łączy te dwie części glukoneogenezy poprzez przekształcanie szczawiooctanu w PEP – karboksykinaza PEP (PEPCK) – jest zmienna w zależności od gatunku: można go znaleźć w całości w mitochondriach , w całości w cytozolu lub równomiernie rozproszony między nimi, tak jak u ludzi. Transport PEP przez błonę mitochondrialną jest realizowany przez dedykowane białka transportowe; jednak takie białka nie istnieją dla szczawiooctanu . Dlatego u gatunków, które nie mają wewnątrzmitochondrialnego PEPCK, szczawiooctan musi zostać przekształcony w jabłczan lub asparaginian , wyeksportowany z mitochondrium i ponownie przekształcony w szczawiooctan , aby umożliwić kontynuację glukoneogenezy.
Ścieżka
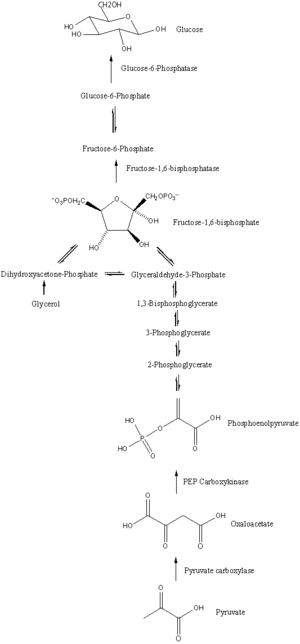
Glukoneogeneza to szlak składający się z serii jedenastu reakcji katalizowanych enzymami. Szlak rozpocznie się w wątrobie lub nerkach, w mitochondriach lub cytoplazmie tych komórek, w zależności od użytego substratu. Wiele reakcji jest odwrotnością etapów występujących w glikolizie .
- Glukoneogeneza rozpoczyna się w mitochondriach wraz z wytworzeniem szczawiooctanu poprzez karboksylację pirogronianu. Ta reakcja również wymaga jednej cząsteczki ATP i jest katalizowana przez karboksylazę pirogronianową . Enzym ten jest stymulowany przez wysoki poziom acetylo-CoA (wytwarzanego w β-oksydacji w wątrobie) i hamowany przez wysoki poziom ADP i glukozy.
- Szczawiooctan jest redukowany do jabłczanu za pomocą NADH , etapu wymaganego do jego transportu z mitochondriów.
- Jabłczan jest utleniany do szczawiooctanu za pomocą NAD + w cytozolu, gdzie zachodzą pozostałe etapy glukoneogenezy.
- Szczawiooctan jest dekarboksylowany, a następnie fosforylowany z wytworzeniem fosfoenolopirogronianu przy użyciu enzymu PEPCK . Podczas tej reakcji cząsteczka GTP jest hydrolizowana do GDP .
- Kolejne etapy reakcji są takie same jak w przypadku glikolizy odwróconej . Jednakże fruktozo-1,6-bisfosfatazy przekształca fruktozo-1,6-bisfosforan do fruktozo-6-fosforanu , przy użyciu jednej cząsteczki wody i uwalniania jednego fosforanu (glikoliza, fosfofruktokinaza 1 konwertuje F6P i ATP do F1,6BP i ADP ). Jest to również etap ograniczający tempo glukoneogenezy.
- Glukozo-6-fosforan jest tworzony z fruktozo- 6fosforanu przez fosfoglukoizomerazę (odwrotność etapu 2 w glikolizie). Glukozo-6-fosforan może być stosowany w innych szlakach metabolicznych lub defosforylowany do wolnej glukozy. Podczas gdy wolna glukoza może łatwo dyfundować do iz komórki, forma fosforylowana (glukozo-6-fosforan) jest zablokowana w komórce, mechanizm, dzięki któremu wewnątrzkomórkowy poziom glukozy jest kontrolowany przez komórki.
- Końcowa glukoneogenezy, tworzenie glukozy występuje w prześwicie w retikulum endoplazmatycznego , gdzie glukozo-6-fosforan hydrolizuje glukozo-6-fosfatazy do wytwarzania glukozy i uwalniania nieorganicznego fosforanu. Podobnie jak dwa kroki wcześniej, ten krok nie jest prostym odwróceniem glikolizy, w której heksokinaza katalizuje konwersję glukozy i ATP do G6P i ADP. Glukoza jest transportowana do cytoplazmy przez transportery glukozy zlokalizowane w błonie retikulum endoplazmatycznego.
| Metabolizm powszechnych cukrów prostych , w tym glikoliza , glukoneogeneza, glikogeneza i glikogenoliza |
|---|
Rozporządzenie
Podczas gdy większość etapów glukoneogenezy jest odwrotnością tych występujących w glikolizie , trzy regulowane i silnie endergoniczne reakcje są zastępowane reakcjami bardziej korzystnymi kinetycznie. Enzymy glikolizy heksokinaza / glukokinaza , fosfofruktokinaza i kinaza pirogronianowa są zastąpione przez glukozo-6-fosfatazę , fruktozo-1,6-bisfosfatazę i karboksykinazę PEP /karboksylazę pirogronianową. Enzymy te są zazwyczaj regulowane przez podobne cząsteczki, ale z odwrotnymi skutkami. Na przykład acetylo-CoA i cytrynian aktywują enzymy glukoneogenezy (odpowiednio karboksylazę pirogronianową i fruktozo-1,6-bisfosfatazę), jednocześnie hamując enzym glikolityczny kinazę pirogronianową . Ten system wzajemnej kontroli pozwala glikolizie i glukoneogenezie na wzajemne hamowanie i zapobiega jałowemu cyklowi syntezy glukozy, aby tylko ją rozłożyć. Kinazę pirogronianową można również ominąć 86 szlakami niezwiązanymi z glukoneogenezą, w celu utworzenia pirogronianu, a następnie mleczanu; niektóre z tych szlaków wykorzystują atomy węgla pochodzące z glukozy.
Większość enzymów odpowiedzialnych za glukoneogenezę znajduje się w cytozolu ; wyjątkami są mitochondrialna karboksylaza pirogronianowa i, u zwierząt, karboksykinaza fosfoenolopirogronianowa . Ten ostatni istnieje jako izoenzym znajdujący się zarówno w mitochondrium, jak iw cytozolu . Szybkość glukoneogenezy jest ostatecznie kontrolowana przez działanie kluczowego enzymu, fruktozo-1,6-bisfosfatazy , który jest również regulowany poprzez transdukcję sygnału przez cAMP i jego fosforylację.
W globalnej kontroli glukoneogenezy pośredniczy glukagon ( uwalniany, gdy poziom glukozy we krwi jest niski ); wyzwala fosforylację enzymów i białek regulatorowych przez Kinazę Proteinową A (kinazę regulowaną cykliczną AMP), powodując zahamowanie glikolizy i stymulację glukoneogenezy. Insulina przeciwdziała glukagonowi poprzez hamowanie glukoneogenezy. Cukrzyca typu 2 charakteryzuje się nadmiarem glukagonu i insulinoopornością organizmu. Insulina nie może już hamować ekspresji genów enzymów takich jak PEPCK, co prowadzi do zwiększonego poziomu hiperglikemii w organizmie. Lek przeciwcukrzycowy metformina zmniejsza stężenie glukozy we krwi głównie poprzez hamowanie glukoneogenezy, przezwyciężając niezdolność insuliny do hamowania glukoneogenezy spowodowaną insulinoopornością.
Badania wykazały, że brak wytwarzania glukozy w wątrobie nie ma większego wpływu na kontrolę stężenia glukozy w osoczu na czczo. Kompensacyjna indukcja glukoneogenezy zachodzi w nerkach i jelicie pod wpływem glukagonu , glikokortykoidów i kwasicy.
Insulinooporność
W wątrobie białko FOX FOXO6 normalnie promuje glukoneogenezę na czczo, ale insulina blokuje FOXO6 podczas karmienia. W warunkach insulinooporności insulina nie blokuje FOXO6, co prowadzi do kontynuacji glukoneogenezy nawet po karmieniu, co skutkuje wysokim poziomem glukozy we krwi ( hiperglikemią ).
Insulinooporność jest częstą cechą zespołu metabolicznego i cukrzycy typu 2 . Z tego powodu glukoneogeneza jest celem terapii cukrzycy typu 2, takiej jak lek przeciwcukrzycowy metformina , który hamuje glukoneogenne tworzenie glukozy i stymuluje wychwyt glukozy przez komórki.