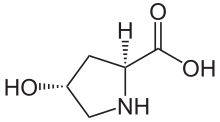
Hydroksyprolina - Hydroxyproline
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Kwas ( 2S , 4R )-4-hydroksypirolidyno-2-karboksylowy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA |
100.000.084 |
| Siatka | Hydroksyprolina |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 5 H 9 N O 3 | |
| Masa cząsteczkowa | 131,131 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
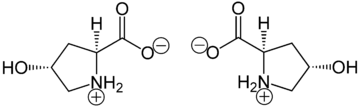
(2 S , 4 R ) -4-hydroksyprolina lub L -hydroksyproliny ( C 5 H 9 O 3 N ), jest aminokwasem , w skrócie Hyp lub O , na przykład w Protein Data Bank .
Struktura i odkrycie
W 1902 Hermann Emil Fischer wyizolował hydroksyprolinę z hydrolizowanej żelatyny . W 1905 Hermann Leuchs zsyntetyzował racemiczną mieszaninę 4-hydroksyproliny.
Hydroksyprolina różni się od proliny obecnością grupy hydroksylowej (OH) przyłączonej do atomu węgla gamma.
Produkcja i funkcja
Hydroksyprolina jest wytwarzana przez hydroksylację aminokwasu proliny przez enzym hydroksylazę prolilową po syntezie białka (jako modyfikacja potranslacyjna ). Reakcja enzymatyczna katalizowana odbywa się w prześwicie w retikulum endoplazmatycznym . Chociaż nie jest bezpośrednio włączana do białek, hydroksyprolina zawiera około 4% wszystkich aminokwasów znajdujących się w tkance zwierzęcej, ilość większą niż siedem innych aminokwasów, które są włączone translująco.
Zwierząt
Kolagen
Hydroksyprolina jest głównym składnikiem kolagenu białkowego , zawierającym około 13,5% kolagenu ssaków. Hydroksyprolina i prolina odgrywają kluczową rolę w stabilności kolagenu. Pozwalają na ostre skręcenie spirali kolagenowej. W kanonicznej triadzie kolagenu Xaa-Yaa-Gly (gdzie Xaa i Yaa są dowolnymi aminokwasami), prolina zajmująca pozycję Yaa jest hydroksylowana z wytworzeniem sekwencji Xaa-Hyp-Gly. Ta modyfikacja reszty proliny zwiększa stabilność potrójnej helisy kolagenu . Początkowo proponowano, że stabilizacja była spowodowana tworzeniem przez cząsteczki wody sieci wiązań wodorowych, łączącej grupy hydroksylowe prolilu i grupy karbonylowe łańcucha głównego. Następnie wykazano, że wzrost stabilności wynika głównie z efektów stereoelektronicznych i że uwodnienie reszt hydroksyproliny zapewnia niewielką dodatkową stabilność lub nie zapewnia jej wcale.
Bez kolagenu
Oprócz kolagenu białka ssaków, elastyna i argonauta 2, mają domeny kolagenopodobne, w których tworzy się hydroksyprolina. Niektóre trucizny ślimaków, konotoksyny , zawierają hydroksyprolinę, ale nie zawierają sekwencji podobnych do kolagenu.
Wykazano, że hydroksylacja proliny jest zaangażowana w kierowanie podjednostki alfa czynnika indukowanego niedotlenieniem (HIF) (HIF-1 alfa) do rozkładu przez proteolizę . W normoksji (normalne warunki tlenowe) białko EGLN1 [1] hydroksyluje prolinę w pozycji 564 HIF-1 alfa, co umożliwia ubikwitylację przez supresor nowotworu von Hippela-Lindaua (pVHL) i późniejsze ukierunkowanie na degradację proteasomu .
Hydroksyprolina znajduje się w kilku białkach innych niż kolagen. Z tego powodu zawartość hydroksyproliny została wykorzystana jako wskaźnik do określenia ilości kolagenu i/lub żelatyny .
Rośliny
Glikoproteiny bogate w hydroksyprolinę (HRGP) znajdują się również w ścianach komórkowych roślin . Te hydroksyproliny służą jako punkty przyłączenia łańcuchów glikanów, które dodaje się jako modyfikacje potranslacyjne .
Znaczenie kliniczne
Hydroksylacja proliny wymaga kwasu askorbinowego ( witaminy C ). Najbardziej oczywistym, pierwsze efekty (dziąsła i włosów problemy) braku kwasu askorbinowego u ludzi się z otrzymanej wady hydroksylacji z proliny pozostałości kolagenu , o ograniczonej trwałości cząsteczki kolagenu, powodując szkorbutu .
W chorobie Pageta wykazano również zwiększone stężenie hydroksyproliny w surowicy i moczu .
Inne hydroksyproliny
W naturze występują również inne hydroksyproliny. Najbardziej godne uwagi są 2,3- cis- , 3,4- trans- i 3,4-dihydroksyprolina, która występuje w ścianach komórek okrzemek i postuluje się, że odgrywa rolę w odkładaniu krzemionki . Hydroksyprolina znajduje się również w ścianach lęgniowców , grzybopodobnych protistów spokrewnionych z okrzemkami. (2 S , 4 S ) - cis -4-hydroksyproliny znajduje toksycznego cyklicznych peptydów z Amanita grzybów ( np , falloidyna ).