Staphylococcus aureus oporny na metycylinę -Methicillin-resistant Staphylococcus aureus
Oporny na metycylinę aureus, Staphylococcus ( MRSA ) jest grupą bakterii Gram-dodatnich , które są genetycznie różni się od innych szczepów z Staphylococcus aureus . MRSA jest odpowiedzialny za kilka trudnych do leczenia infekcji u ludzi. MRSA to każdy szczep S. aureus , który rozwinął (poprzez naturalną selekcję ) lub nabył (poprzez horyzontalny transfer genu ) wielolekową oporność na antybiotyki beta-laktamowe . Antybiotyki beta-laktamowe (β-laktamowe) to grupa o szerokim spektrum działania obejmująca niektóre penamy ( pochodne penicyliny , takie jak metycylina i oksacylina ) oraz cefemy, takie jak cefalosporyny . Szczepy, które nie są w stanie oprzeć się tym antybiotykom, są klasyfikowane jako wrażliwe na metycylinę S. aureus lub MSSA.
MRSA jest powszechny w szpitalach, więzieniach i domach opieki, gdzie osoby z otwartymi ranami , inwazyjnymi urządzeniami, takimi jak cewniki i osłabiony układ odpornościowy, są bardziej narażone na zakażenia szpitalne . MRSA rozpoczęło się jako infekcja nabyta w szpitalu, ale stała się chorobą nabytą zarówno przez społeczność, jak i inwentarza żywego. Odzwierciedlają to terminy HA-MRSA (MRSA związane z opieką zdrowotną lub szpitalne), CA-MRSA (MRSA związane ze społecznością) i LA-MRSA (MRSA związane z żywym inwentarzem).
Symptomy i objawy
U ludzi, Staphylococcus aureus jest częścią normalnej flory bakteryjnej występującej w górnych drogach oddechowych, na skórze, a i w błonie śluzowej jelita. Jednak wraz z podobnymi gatunkami bakterii, które mogą kolonizować i działać symbiotycznie, mogą powodować choroby, jeśli zaczną przejmować skolonizowane przez siebie tkanki lub atakują inne tkanki; powstałą infekcję nazwano „patobiontem”.
Po 72 godzinach MRSA może zatrzymywać się w ludzkich tkankach i ostatecznie stać się opornymi na leczenie. Początkowa postać MRSA to małe czerwone guzki przypominające pryszcze, ukąszenia pająków lub czyraki; może im towarzyszyć gorączka i czasami wysypki. W ciągu kilku dni guzki stają się większe i bardziej bolesne; w końcu otwierają się na głębokie, wypełnione ropą czyraki. Około 75 procent infekcji CA-MRSA jest zlokalizowanych na skórze i tkankach miękkich i zazwyczaj można je skutecznie leczyć.
Czynniki ryzyka
Wybrane kilka zagrożonych populacji to:
- Osoby z implantami, protezami, drenami i cewnikami na stałe
- Osoby często przebywające w zatłoczonych miejscach, zwłaszcza ze wspólnym sprzętem i kontaktem skóra do skóry
- Osoby ze słabym układem odpornościowym ( HIV / AIDS , toczeń lub chorzy na raka ; biorcy przeszczepów ; ciężcy astmatycy ; itp.)
- Diabetycy
- Osoby używające narkotyków dożylnie
- Regularny kontakt z kimś, kto w ciągu ostatniego roku wstrzykiwał sobie narkotyki
- Użytkownicy antybiotyków chinolonowych
- Starsi ludzie
- Dzieci w wieku szkolnym dzielące się sprzętem sportowym i innym
- Studenci mieszkający w akademikach
- Osoby przebywające lub pracujące w zakładzie opieki zdrowotnej przez dłuższy czas
- Osoby spędzające czas na wodach przybrzeżnych, na których występuje MRSA, takich jak niektóre plaże na Florydzie i na zachodnim wybrzeżu Stanów Zjednoczonych
- Osoby spędzające czas w zamkniętych przestrzeniach z innymi ludźmi, w tym mieszkańcy schronisk dla bezdomnych, więźniowie więzień i rekrutów wojskowych w podstawowym szkoleniu
- Lekarze weterynarii, osoby zajmujące się hodowlą zwierząt gospodarskich i właściciele zwierząt domowych
- Osoby spożywające mleko niepasteryzowane
- Osoby z obniżoną odpornością, a także skolonizowane
- Osoby z przewlekłą obturacyjną chorobą płuc
- Osoby, które przeszły operację klatki piersiowej
Aż 22% osób zarażonych MRSA nie ma żadnych dostrzegalnych czynników ryzyka.
Osoby hospitalizowane
Osoby hospitalizowane, w tym osoby starsze, często mają obniżoną odporność i są podatne na wszelkiego rodzaju infekcje, w tym MRSA; zakażenie MRSA nazywane jest opornym na metycylinę S. aureus związanym z opieką zdrowotną lub nabytym w szpitalu (HA-MRSA). Ogólnie rzecz biorąc, osoby zakażone MRSA pozostają zakażone przez mniej niż 10 dni, jeśli są leczone przez lekarza, chociaż skutki mogą się różnić w zależności od osoby.
Zarówno rany chirurgiczne, jak i niechirurgiczne mogą być zakażone HA-MRSA. Zakażenia w miejscu chirurgicznym występują na powierzchni skóry, ale mogą rozprzestrzenić się na narządy wewnętrzne i krew, powodując posocznicę . Transmisja może wystąpić między świadczeniodawcami a pacjentami, ponieważ niektórzy świadczeniodawcy mogą zaniedbywać profilaktyczne mycie rąk między badaniami.
Osoby przebywające w domach opieki są zagrożone ze wszystkich powyższych powodów, co dodatkowo komplikuje ich ogólnie słabszy układ odpornościowy.
Więźniowie i personel wojskowy
Więzienia i koszary wojskowe mogą być zatłoczone i odosobnione, a złe praktyki higieniczne mogą się rozprzestrzeniać, narażając w ten sposób mieszkańców na zwiększone ryzyko zarażenia się MRSA. Przypadki MRSA w takich populacjach zostały po raz pierwszy zgłoszone w Stanach Zjednoczonych, a później w Kanadzie. Najwcześniejsze raporty zostały sporządzone przez Centers for Disease Control and Prevention w amerykańskich więzieniach stanowych. W mediach pojawiły się setki doniesień o wybuchach epidemii MRSA w więzieniach między 2000 a 2008 rokiem. Na przykład w lutym 2008 roku więzienie Tulsa County w Oklahomie zaczęło leczyć średnio 12 przypadków S. aureus miesięcznie.
Zwierząt
Stosowanie antybiotyków u zwierząt gospodarskich zwiększa ryzyko rozwoju MRSA wśród zwierząt gospodarskich; szczepy MRSA ST 398 i CC398 mogą być przenoszone na ludzi. Na ogół zwierzęta są bezobjawowe.
Zwierzęta domowe są podatne na zakażenie MRSA poprzez przeniesienie od ich właścicieli; przeciwnie, zwierzęta zakażone MRSA mogą również przenosić MRSA na ludzi.
Sportowcy
Szatnie , sale gimnastyczne i związane z nimi obiekty sportowe stanowią potencjalne miejsca skażenia i infekcji MRSA. Sportowcy zostali zidentyfikowani jako grupa wysokiego ryzyka. Badanie powiązało MRSA z otarciami powodowanymi przez sztuczną murawę . Trzy badania przeprowadzone przez Departament Zdrowia Stanu Teksas wykazały, że wskaźnik infekcji wśród piłkarzy był 16 razy większy niż średnia krajowa. W październiku 2006 roku piłkarz z liceum został tymczasowo sparaliżowany z powodu oparzeń murawy zakażonych MRSA. Jego infekcja powróciła w styczniu 2007 roku i wymagała trzech operacji usunięcia zainfekowanej tkanki oraz trzech tygodni pobytu w szpitalu.
W 2013 roku u Lawrence Tynesa , Carla Nicksa i Johnthana Banksa z Tampa Bay Buccaneers zdiagnozowano MRSA. Tynes i Nicks najwyraźniej nie zarazili się tą infekcją od siebie nawzajem, ale nie wiadomo, czy Banks zaraził się tą infekcją. W 2015 roku infielder Los Angeles Dodgers, Justin Turner, został zainfekowany, gdy zespół odwiedził New York Mets . W październiku 2015 roku, New York Giants tight end Daniel Fells był hospitalizowany z poważnym zakażeniem MRSA.
Dzieci
MRSA staje się krytycznym problemem u dzieci; Badania wykazały, że 4,6% pacjentów w placówkach opieki zdrowotnej w USA, (przypuszczalnie), w tym w żłobkach szpitalnych, było zakażonych lub skolonizowanych MRSA. Dzieci i dorośli, którzy mają kontakt z żłobkami, placami zabaw, szatniami, obozami, akademikami, salami lekcyjnymi i innymi ustawieniami szkolnymi oraz salami gimnastycznymi i treningami, są bardziej narażeni na zarażenie MRSA. Rodzice powinni szczególnie uważać na dzieci uczestniczące w zajęciach, w których udostępniany jest sprzęt sportowy, taki jak kaski piłkarskie i mundurki.
Osoby nadużywające narkotyków iniekcyjnych
Leki wymagające użycia igły spowodowały wzrost MRSA, przy czym zażywanie narkotyków iniekcyjnych (IDU) stanowiło 24,1% (1839 osób) w systemie wypisowym szpitala Tennessee. Niehigieniczne metody wstrzykiwania powodują, że punkt dostępu dla MRSA przedostaje się do krwiobiegu i zaczyna zarażać gospodarza. Co więcej, przy wysokim wskaźniku zarażenia MRSA, powszechnym czynnikiem ryzyka są osoby, które są w stałym kontakcie z kimś, kto wstrzyknął narkotyki w ciągu ostatniego roku. To nadal zależy od tego, jak silny jest układ odpornościowy osoby niezainfekowanej i jak długo obie osoby pozostają w kontakcie.
Mechanizm
Oporność na środki przeciwdrobnoustrojowe ma podłoże genetyczne; W oporności pośredniczy pozyskiwanie pozachromosomalnych elementów genetycznych zawierających geny nadające oporność na niektóre antybiotyki. Przykładami takich elementów są plazmidy , transpozycyjne elementy genetyczne i wyspy genomowe , które mogą być przenoszone między bakteriami poprzez horyzontalny transfer genów . Cechą definiującą MRSA jest jego zdolność do rozwoju w obecności antybiotyków podobnych do penicyliny , które normalnie zapobiegają wzrostowi bakterii poprzez hamowanie syntezy materiału ściany komórkowej . Wynika to z genu oporności mecA , który powstrzymuje antybiotyki β-laktamowe przed inaktywacją enzymów (transpeptydaz) kluczowych dla syntezy ściany komórkowej.
SCC mec
Gronkowcowy chromosom kasetowy mec ( SCC mec ) to genomowa wyspa niewiadomego pochodzenia zawierająca gen oporności na antybiotyki mecA . SCC mec zawiera dodatkowe geny poza mecA , w tym gen cytolizyny psm-mec , który może hamować zjadliwość szczepów MRSA nabytych przez HA. Ponadto ten locus koduje RNA regulujące geny zależne od szczepu, znane jako RNA psm-mec . SCC mec zawiera również ccrA i ccrB ; oba geny kodują rekombinazy, które pośredniczą w specyficznej dla miejsca integracji i wycięciu elementu SCC mec z chromosomu S. aureus . Obecnie zidentyfikowano sześć unikalnych typów mec SCC o wielkości od 21 do 67 kb; są one oznaczone jako typy I–VI i wyróżniają się zmiennością w kompleksach genów mec i ccr . Ze względu na wielkość elementu SCC mec i ograniczenia związane z poziomym transferem genów uważa się, że za rozprzestrzenianie się infekcji MRSA odpowiada co najmniej pięć klonów, przy czym najbardziej rozpowszechniony jest kompleks klonalny (CC). Uważa się, że SCC mec pochodzi z blisko spokrewnionego gatunku Staphylococcus sciuri i został przeniesiony poziomo do S. aureus.
Różne genotypy mec SCC nadają różne cechy mikrobiologiczne, takie jak różne wskaźniki oporności na środki przeciwdrobnoustrojowe. Różne genotypy są również związane z różnymi rodzajami infekcji. Typy I–III SCC mec to duże elementy, które zazwyczaj zawierają dodatkowe geny odporności i są charakterystycznie izolowane ze szczepów HA-MRSA. Odwrotnie, CA-MRSA jest związany z typami IV i V, które są mniejsze i nie mają genów odporności innych niż mecA .
Te różnice zostały dokładnie zbadane przez Collins i in. w 2001 r. i można to wytłumaczyć różnicami sprawności związanymi z przenoszeniem dużego lub małego plazmidu mec SCC . Przenoszenie dużych plazmidów, takich jak SCC mec I–III, jest kosztowne dla bakterii, powodując kompensacyjny spadek ekspresji zjadliwości . MRSA może dobrze prosperować w warunkach szpitalnych ze zwiększoną opornością na antybiotyki, ale zmniejszoną zjadliwością – HA-MRSA jest skierowany do hospitalizowanych gospodarzy z obniżoną odpornością, dlatego spadek zjadliwości nie jest nieprzystosowany. W przeciwieństwie do tego, CA-MRSA ma tendencję do przenoszenia elementów mec SCC mec o niższym koszcie sprawności, aby zrównoważyć zwiększoną ekspresję zjadliwości i toksyczności wymaganą do zakażenia zdrowych gospodarzy.
mecA
mecA jestgenem biomarkerowym odpowiedzialnym za oporność na metycylinę i inne antybiotyki β-laktamowe. Po nabyciu mecA gen musi zostać zintegrowany i zlokalizowany wchromosomie S. aureus . mecA koduje białko wiążące penicylinę 2a (PBP2a), które różni się od innych białek wiążących penicylinę tym, że jego miejsce aktywne nie wiąże metycyliny ani innych antybiotyków β-laktamowych. Jako taki, PBP2a może nadal katalizować reakcję transpeptydacji wymaganą dousieciowania peptydoglikanu , umożliwiając syntezę ściany komórkowej nawet w obecności antybiotyków. W konsekwencji niezdolności PBP2a do interakcji z ugrupowaniami β-laktamowymi, nabycie mecA nadaje oporność na wszystkie antybiotyki β-laktamowe oprócz metycyliny.
mecA jest pod kontrolą dwóch genów regulatorowych , mecI i mecR1 . MecI jest zwykle związany z promotorem mecA i działa jako represor . W obecności antybiotyku β-laktamowego MecR1 inicjuje kaskadę przekazywania sygnału, która prowadzi do aktywacji transkrypcyjnej mecA . Osiąga się to poprzez rozszczepianie MecI za pośrednictwem MecR1, co łagodzi represję MecI. mecA jest dalej kontrolowana przez dwa korepresory , blaI i blaR1 . blaI i blaR1 są homologiczne odpowiednio do mecI i mecR1 i normalnie funkcjonują jako regulatory blaZ , który jest odpowiedzialny za oporność na penicylinę. Sekwencje DNA związane przez mecI i blaI są identyczne; dlatego blaI może również wiązać się z operatorem mecA , aby zahamować transkrypcję mecA .
Mobilny element kataboliczny argininy
Element ruchomy arginina kataboliczne (ACME) jest czynnikiem wirulencji, obecne w wielu szczepów MRSA, ale powszechne w MSSA. SpeG-dodatni ACME kompensuje nadwrażliwość na poliaminy S. aureus i ułatwia stabilną kolonizację skóry, infekcję rany i przenoszenie między ludźmi .
Szczepy

Nabycie SCC mec u wrażliwego na metycylinę S. aureus (MSSA) prowadzi do powstania wielu genetycznie różnych linii MRSA. Te zmienności genetyczne w obrębie różnych szczepów MRSA prawdopodobnie wyjaśniają zmienność zjadliwości i powiązanych infekcji MRSA. Pierwszy szczep MRSA, ST250 MRSA-1, pochodził z integracji SCC mec i ST250-MSSA. Historycznie rzecz biorąc, główne klony MRSA ST2470-MRSA-I, ST239-MRSA-III, ST5-MRSA-II i ST5-MRSA-IV były odpowiedzialne za wywoływanie szpitalnych zakażeń MRSA (HA-MRSA). ST239-MRSA-III, znany jako klon brazylijski, był wysoce zakaźny w porównaniu z innymi i był dystrybuowany w Argentynie, Czechach i Portugalii.
W Wielkiej Brytanii najczęstszymi szczepami MRSA są EMRSA15 i EMRSA16. Stwierdzono, że EMRSA16 jest identyczny ze szczepem ST 36:USA200, który krąży w Stanach Zjednoczonych i zawiera geny SCC mec typu II, enterotoksyny A i toksyny 1 zespołu wstrząsu toksycznego . Zgodnie z nowym międzynarodowym systemem typowania, szczep ten nazywa się teraz MRSA252. Stwierdzono również, że EMRSA 15 jest jednym z powszechnych szczepów MRSA w Azji. Inne popularne szczepy to ST5:USA100 i EMRSA 1. Te szczepy są genetyczną charakterystyką HA-MRSA.
Pozaszpitalne szczepy MRSA (CA-MRSA) pojawiły się pod koniec 1990 do 2000 roku, zarażając zdrowe osoby, które nie miały kontaktu z placówkami służby zdrowia. Naukowcy sugerują, że CA-MRSA nie wyewoluował z HA-MRSA. Zostało to dodatkowo udowodnione przez typowanie molekularne szczepów CA-MRSA i porównanie genomu między CA-MRSA i HA-MRSA, które wskazują, że nowe szczepy MRSA samodzielnie zintegrowały mec SCC z MSSA. W połowie 2000 roku CA-MRSA został wprowadzony do systemów opieki zdrowotnej i odróżnienie CA-MRSA od HA-MRSA stało się trudnym procesem. Pozaszpitalne MRSA jest łatwiej leczone i bardziej zjadliwe niż MRSA nabyte w szpitalu (HA-MRSA). Genetyczny mechanizm zwiększonej zjadliwości CA-MRSA pozostaje aktywnym obszarem badań. W Panton-Valentine leukocidin (PVL) genów są szczególnie interesujące, ponieważ są one unikalną cechą CA-MRSA.
W Stanach Zjednoczonych większość przypadków CA-MRSA jest spowodowanych przez szczep CC8 oznaczony ST8:USA300 , który niesie SCC mec typu IV, leukocydynę Panton-Valentine , PSM-alfa i enterotoksyny Q i K oraz ST1:USA400 . Szczep ST8:USA300 powoduje infekcje skóry, martwicze zapalenie powięzi i zespół wstrząsu toksycznego, podczas gdy szczep ST1:USA400 powoduje martwicze zapalenie płuc i posocznicę płucną. Inne szczepy MRSA nabyte przez społeczność to ST8:USA500 i ST59:USA1000. W wielu krajach świata wśród szczepów CA-MRSA dominują szczepy MRSA o różnych typach tła genetycznego; USA300 z łatwością znajduje się na szczycie listy w USA i staje się coraz bardziej powszechny w Kanadzie po swoim pierwszym pojawieniu się tam w 2004 roku. Na przykład w Australii szczepy ST93 są powszechne, podczas gdy w Europie kontynentalnej dominują szczepy ST80, które przenoszą SCC mec typu IV. Na Tajwanie szczepy ST59, z których niektóre są oporne na wiele antybiotyków innych niż beta-laktamowe, stały się częstą przyczyną infekcji skóry i tkanek miękkich w społeczności. W odległym regionie Alaski, w przeciwieństwie do większości kontynentalnych Stanów Zjednoczonych, USA300 znaleziono bardzo rzadko w badaniach nad szczepami MRSA z epidemii w 1996 i 2000 r., a także w nadzorze z lat 2004–2006.
Szczep MRSA, CC398 , występuje u intensywnie hodowanych zwierząt produkcyjnych (głównie świń, ale także bydła i drobiu), gdzie może być przenoszony na ludzi jako LA-MRSA (ang. livestock-associated MRSA).
Diagnoza

Laboratoria mikrobiologiczne diagnostyczne i laboratoria referencyjne są kluczem do identyfikacji ognisk MRSA. Zwykle bakteria musi być wyhodowana z krwi, moczu, plwociny lub innych próbek płynów ustrojowych w ilościach wystarczających do wykonania na wczesnym etapie testów potwierdzających. Mimo to, ponieważ nie istnieje szybka i łatwa metoda diagnozowania MRSA, wstępne leczenie infekcji często opiera się na „silnym podejrzeniu” i technikach stosowanych przez lekarza prowadzącego; obejmują one ilościowe procedury PCR , które są stosowane w laboratoriach klinicznych do szybkiego wykrywania i identyfikacji szczepów MRSA.
Innym powszechnym testem laboratoryjnym jest szybki test aglutynacji lateksu, który wykrywa białko PBP2a. PBP2a to wariant białka wiążącego penicylinę, który nadaje oporność S. aureus na oksacylinę.
Mikrobiologia
Podobnie jak wszystkie S. aureus (w skrócie SA w czasie), oporne na metycylinę Staphylococcus aureus jest Gram-dodatnią, kuliste ( coccus ) bakteria około 1 mikrona w średnicy . Nie tworzy zarodników i nie jest ruchliwy . Często występuje w gronach lub łańcuchach podobnych do winogron. W przeciwieństwie do S. aureus wrażliwego na metycylinę (MSSA), MRSA rozwija się powoli na różnych podłożach i stwierdzono, że występuje w mieszanych koloniach MSSA. MecA gen, który nadaje oporność na wiele antybiotyków, jest zawsze obecny w MRSA i zwykle występuje w MSSA; jednak w niektórych przypadkach gen mecA jest obecny w MSSA, ale nie ulega ekspresji . Testowanie reakcji łańcuchowej polimerazy (PCR) jest najdokładniejszą metodą identyfikacji szczepów MRSA. Opracowano specjalistyczne podłoża hodowlane, aby lepiej różnicować MSSA i MRSA, a w niektórych przypadkach takie podłoża można stosować do identyfikacji określonych szczepów, które są oporne na różne antybiotyki.
Pojawiły się inne szczepy S. aureus , które są oporne na oksacylinę , klindamycynę, teikoplaninę i erytromycynę . Te oporne szczepy mogą, ale nie muszą posiadać genu mecA . S. aureus rozwinął również oporność na wankomycynę (VRSA). Jeden szczep jest tylko częściowo wrażliwy na wankomycynę i jest nazywany wankomycyną pośrednią S. aureus (VISA). GISA, szczep opornego S. aureus , jest pośrednikiem glikopeptydowym S. aureus i jest mniej podatny na działanie wankomycyny i teikoplaniny. Oporność S. aureus na antybiotyki można określić ilościowo, określając ilość antybiotyku, którą należy zastosować do zahamowania wzrostu. Jeśli S. aureus jest hamowany przy stężeniu wankomycyny mniejszym lub równym 4 μg/ml, mówi się, że jest wrażliwy. Jeśli do zahamowania wzrostu konieczne jest stężenie większe niż 32 μg/ml, mówi się, że jest oporne.
Zapobieganie
Ekranizacja
W placówkach opieki zdrowotnej izolowanie osób z MRSA od osób bez infekcji jest jedną z metod zapobiegania transmisji. Szybkie testy posiewu i wrażliwości oraz testy molekularne identyfikują nosicieli i zmniejszają wskaźniki infekcji. Szczególnie ważne jest badanie pacjentów w takich warunkach, ponieważ 2% osób jest nosicielami MRSA, chociaż w wielu z tych przypadków bakterie bytują w nozdrzu, a pacjent nie będzie wykazywał żadnych objawów.
MRSA można zidentyfikować, wymazując nozdrza i izolując znajdujące się tam bakterie. W połączeniu z dodatkowymi środkami sanitarnymi dla osób mających kontakt z osobami zakażonymi, badania przesiewowe osób przyjmowanych do szpitali okazały się skuteczne w minimalizowaniu rozprzestrzeniania się MRSA w szpitalach w Stanach Zjednoczonych, Danii , Finlandii i Holandii .
Mycie rąk
W Centrum Kontroli i Zapobiegania Chorobom sugestie dotyczące zapobiegania skurczu i rozprzestrzenianiu się infekcji MRSA, które mają zastosowanie do tych ustawień w społeczności, w tym populacji osadzonych, pracowników centrum opieki nad dziećmi oraz sportowców. Aby zapobiec rozprzestrzenianiu się MRSA, zaleca się dokładne i regularne mycie rąk przy użyciu wody z mydłem lub środka dezynfekującego na bazie alkoholu. Dodatkowe zalecenia to utrzymywanie ran w czystości i zakrywaniu, unikanie kontaktu z ranami innych osób, unikanie dzielenia się przedmiotami osobistymi, takimi jak brzytwy lub ręczniki, branie prysznica po ćwiczeniach w obiektach sportowych oraz branie prysznica przed skorzystaniem z basenu lub jacuzzi.
Izolacja
Wyłączając placówki medyczne , obecne wytyczne USA nie wymagają rutynowego wykluczania pracowników zakażonych MRSA z ogólnego miejsca pracy. Narodowe Instytuty Zdrowia zaleca, aby osoby z drenażu ran, które nie mogą być pokryte i zawierał z czystym, suchym bandażem i tych, którzy nie mogą utrzymać dobre praktyki higieniczne być przeniesiony, a pacjenci z drenażu rany powinny także automatycznie położyć na „ Kontakt ostrożności ” niezależnie od tego, czy mają znaną infekcję. Pracownicy z aktywnymi zakażeniami są wykluczeni z czynności, w których istnieje prawdopodobieństwo kontaktu skóry ze skórą. Aby zapobiec rozprzestrzenianiu się gronkowców lub MRSA w miejscu pracy, zachęca się pracodawców do udostępnienia odpowiednich obiektów zapewniających dobrą higienę. Ponadto dezynfekcja powierzchni i sprzętu powinna być zgodna z zarejestrowanymi przez Agencję Ochrony Środowiska środkami dezynfekcyjnymi. W warunkach szpitalnych izolację kontaktową można przerwać po uzyskaniu ujemnego wyniku od jednego do trzech posiewów. Przed zwolnieniem pacjenta z izolacji zaleca się, aby dla tego konkretnego pacjenta był przeznaczony sprzęt do opieki nad pacjentem lub sprzęt jednorazowego użytku. Jeśli nie jest to możliwe, sprzęt należy odpowiednio zdezynfekować przed użyciem go u innego pacjenta.
Aby zapobiec rozprzestrzenianiu się MRSA w domu, departamenty zdrowia zalecają pranie materiałów, które miały kontakt z zakażonymi osobami, oddzielnie i przy użyciu rozcieńczonego roztworu wybielacza; zmniejszyć ilość bakterii w nosie i skórze; oraz do czyszczenia i dezynfekcji tych rzeczy w domu, których ludzie regularnie dotykają, takich jak zlewy, wanny, blaty kuchenne, telefony komórkowe, włączniki światła, klamki, telefony, toalety i klawiatury komputerowe.
Ograniczenie stosowania antybiotyków
Glikopeptydy , cefalosporyny , aw szczególności chinolony są związane ze zwiększonym ryzykiem kolonizacji MRSA. W aktualnych wytycznych zaleca się ograniczenie stosowania klas antybiotyków promujących kolonizację MRSA, zwłaszcza fluorochinolonów.
Względy zdrowia publicznego
Modele matematyczne opisują jeden ze sposobów, w jaki może dojść do utraty kontroli infekcji po tym, jak środki służące do badań przesiewowych i izolacji wydają się skuteczne przez lata, jak to miało miejsce w Wielkiej Brytanii. W strategii „szukaj i niszcz”, która była stosowana przez wszystkie szpitale w Wielkiej Brytanii do połowy lat 90., wszystkie hospitalizowane osoby z MRSA zostały natychmiast odizolowane, a wszyscy pracownicy zostali przebadani pod kątem MRSA i uniemożliwiono im pracę do czasu zakończenia kursu eliminacji terapia, która okazała się skuteczna. Utrata kontroli następuje, ponieważ skolonizowani ludzie są wypuszczani z powrotem do społeczności, a następnie ponownie przyjmowani; kiedy liczba skolonizowanych ludzi w społeczności osiągnie pewien próg, strategia „szukaj i niszcz” zostaje przytłoczona. Jednym z niewielu krajów, które nie zostały przytłoczone przez MRSA, jest Holandia: ważną częścią sukcesu holenderskiej strategii mogła być próba wyeliminowania nosicielstwa po wypisaniu ze szpitala.
Dekolonizacja
Do 2013 r. nie przeprowadzono żadnych randomizowanych badań klinicznych, aby zrozumieć, jak leczyć rany niechirurgiczne, które zostały skolonizowane, ale niezakażone MRSA, i przeprowadzono niewystarczające badania, aby zrozumieć, jak leczyć rany chirurgiczne skolonizowane MRSA. Od 2013 r. nie było wiadomo, czy strategie zwalczania kolonizacji MRSA u osób przebywających w domach opieki zmniejszają wskaźniki zakażeń.
Należy zachować ostrożność przy próbie odprowadzenia wrzodów, ponieważ rozerwanie otaczającej tkanki może prowadzić do większych infekcji, w tym zakażenia krwi . Maść z mupirocyną 2% może być skuteczna w zmniejszaniu wielkości zmian. Preferowane jest wtórne pokrycie odzieży. Jak pokazano w badaniu na zwierzętach na myszach z cukrzycą, miejscowe stosowanie mieszaniny cukru (70%) i 3% pasty powidonowo-jodowej jest skutecznym środkiem w leczeniu wrzodów cukrzycowych z zakażeniem MRSA.
Ustawienia społeczności
Utrzymanie niezbędnej czystości może być trudne dla ludzi, którzy nie mają dostępu do takich udogodnień, jak toalety publiczne z urządzeniami do mycia rąk. W Wielkiej Brytanii przepisy Workplace (Health, Safety and Welfare) z 1992 r. wymagają, aby firmy zapewniały swoim pracownikom toalety wraz z urządzeniami do mycia, w tym mydłem lub innymi odpowiednimi środkami czyszczącymi. Wytyczne dotyczące liczby toalet i urządzeń sanitarnych, które należy zapewnić obok nich, znajdują się w zatwierdzonym kodeksie postępowania w miejscu pracy (zdrowie, bezpieczeństwo i opieka społeczna) L24, dostępnym w Książkach wykonawczych BHP , ale nie ma zobowiązań prawnych istnieje na władzach lokalnych w Wielkiej Brytanii, aby zapewnić toalety publiczne , i chociaż w 2008 r. Izba Gmin Wspólnoty Wspólnoty i Komitet Samorządu Lokalnego wezwał do nałożenia na władze lokalne obowiązku opracowania strategii toalet publicznych, zostało to odrzucone przez rząd.
Rolnictwo
Światowa Organizacja Zdrowia zaleca regulacje dotyczące stosowania antybiotyków w paszach dla zwierząt, aby zapobiec powstawaniu szczepów lekoopornych szczepów MRSA. MRSA występuje u zwierząt i ptaków.
Leczenie
Antybiotyki
Leczenie zakażenia MRSA jest pilne, a opóźnienia mogą być śmiertelne. Lokalizacja i historia związana z infekcją determinuje leczenie. Droga podania antybiotyku jest różna. Antybiotyki skuteczne przeciwko MRSA mogą być podawane dożylnie, doustnie lub w połączeniu obu i zależą od konkretnych okoliczności i cech pacjenta. Stosowanie równoczesnego leczenia wankomycyną lub innymi lekami beta-laktamowymi może mieć efekt synergistyczny.
Zarówno CA- MRSA , jak i HA- MRSA są oporne na tradycyjne antybiotyki beta-laktamowe przeciw gronkowcom , takie jak cefaleksyna . CA-MRSA widmo większą przeciwdrobnoustrojowe wrażliwości na leki sulfonamidowe (jak kotrimoksazol ( trimetoprim / ), tetracykliny (np doksycyklinę i minocyklina ) i klindamycyna (w przypadku zapalenia szpiku i kości ). MRSA, można wyeliminować za pomocą schematu linezolidu , chociaż leczenie Protokoły różnią się, a poziomy antybiotyków w surowicy różnią się znacznie w zależności od osoby i mogą wpływać na wyniki.Skuteczne leczenie MRSA za pomocą linezolidu było skuteczne u 87% osób.Linezolid jest skuteczniejszy w zakażeniach tkanek miękkich niż wankomycyna.W porównaniu do eradykacji zakażeń, w tym MRSA potraktowano wankomycyna. Leczenie wankomycyny powodzeniem w około 49% ludzi. Linezolid należy do nowej oksazolidynonu klasy antybiotyków, które, jak wykazano, są skuteczne zarówno przeciwko CA-MRSA i HA-MRSA. Ten zakaźny Disease Society of America zaleca wankomycynę, linezolid lub klindamycynę (jeśli są podatne) w leczeniu zapalenia płuc wywołanego przez MRSA. Ceftarolina , cefalosporyna piątej generacji, jest pierwszym antybiotykiem beta-laktamowym zatwierdzonym w USA do leczenia zakażeń MRSA skóry i tkanek miękkich oraz pozaszpitalnego zapalenia płuc.
Wankomycyna i teikoplanina to antybiotyki glikopeptydowe stosowane w leczeniu zakażeń MRSA. Teikoplanina jest strukturalnym kongenerem wankomycyny o podobnym spektrum działania, ale o dłuższym okresie półtrwania . Ponieważ wchłanianie doustne wankomycyny i teikoplaniny jest bardzo niskie, środki te można podawać dożylnie w celu opanowania infekcji ogólnoustrojowych. Leczenie zakażenia MRSA wankomycyną może być skomplikowane ze względu na niewygodną drogę podania. Ponadto skuteczność wankomycyny przeciwko MRSA jest gorsza niż antybiotyków beta-laktamowych przeciwko gronkowcom przeciwko wrażliwym na metycylinę gronkowcom złocistym (MSSA).
Kilka nowo odkrytych szczepów MRSA wykazuje oporność na antybiotyki nawet na wankomycynę i teikoplaninę . Te nowe szczepy bakterii MRSA nazwano S. aureus o średniej oporności na wankomycynę (VISA) . Linezolid , chinuprystyna/dalfoprystyna , daptomycyna , ceftarolina i tygecyklina są stosowane w leczeniu cięższych zakażeń, które nie reagują na glikopeptydy, takie jak wankomycyna. Aktualne wytyczne zalecają stosowanie daptomycyny w przypadku infekcji krwi VISA i zapalenia wsierdzia.
To pozostawiło wankomycynę jako jedyny skuteczny środek dostępny w tym czasie. Jednak pod koniec lat 90. zaczęły pojawiać się szczepy o pośrednim (4–8 μg/ml) poziomie oporności, określane jako pośredni glikopeptyd S. aureus (GISA) lub pośrednio wankomycyna S. aureus (VISA). Pierwszy zidentyfikowany przypadek miał miejsce w Japonii w 1996 roku, a od tego czasu szczepy znaleziono w szpitalach w Anglii, Francji i USA. Pierwszy udokumentowany szczepu z kompletnym (> 16 ng / ml), oporności na wankomycynę, określane wankomycynę Staphylococcus aureus (VRSA) pojawiła się w Stanach Zjednoczonych w roku 2002. Jednakże, w 2011 roku, wariant wankomycyny badano który wiąże się z zmienność mleczanu, a także dobrze wiąże się z pierwotnym celem, przywracając w ten sposób silną aktywność przeciwdrobnoustrojową.
Oksazolidynony, takie jak linezolid, stały się dostępne w latach 90. i są porównywalne z wankomycyną pod względem skuteczności przeciwko MRSA. Oporność na linezolid S. aureus została zgłoszona w 2001 r., ale wskaźniki infekcji utrzymywały się na stałym niskim poziomie. W Wielkiej Brytanii i Irlandii nie wykryto oporności u gronkowców pobranych z przypadków bakteriemii w latach 2001-2006.
Infekcje skóry i tkanek miękkich
W ropniach skóry podstawowym zalecanym leczeniem jest usunięcie martwej tkanki, nacięcie i drenaż. Potrzeba więcej informacji, aby określić skuteczność określonej antybiotykoterapii w zakażeniach miejsca operowanego (SSI). Przykłady infekcji tkanek miękkich wywołanych przez MRSA obejmują wrzody, liszajec , ropnie i ZMO. W przypadku ran chirurgicznych dowody są słabe (wysokie ryzyko błędu systematycznego ), że linezolid może być lepszy niż wankomycyna w eliminowaniu ZMO MRSA.
MRSA jest również w niechirurgicznych ran, takich jak traumatyczne ran, oparzeń , przewlekłych i wrzodów (tj wrzód cukrzycowe , odleżyny , tętniczego niewydolności wrzód , owrzodzenie żylne ). Nie znaleziono rozstrzygających dowodów na temat najlepszego schematu antybiotyków w leczeniu kolonizacji MRSA.
Dzieci
W infekcjach skóry i miejscach infekcji wtórnych z powodzeniem stosuje się miejscowo mupirocynę . W przypadku bakteriemii i zapalenia wsierdzia bierze się pod uwagę wankomycynę lub daptomycynę. W przypadku dzieci z kośćmi lub stawami zakażonymi MRSA leczenie jest zindywidualizowane i długotrwałe. Noworodki mogą rozwinąć krostkowicę u noworodków w wyniku miejscowego zakażenia MRSA. Klindamycyna nie jest zatwierdzona do leczenia infekcji MRSA, ale nadal jest stosowana u dzieci w przypadku infekcji tkanek miękkich.
Zapalenie wsierdzia i bakteriemia
Rozważa się ocenę wymiany protezy zastawki. Odpowiednia terapia antybiotykowa może być stosowana do sześciu tygodni. Często zaleca się terapię antybiotykową przez cztery do sześciu tygodni i jest ona uzależniona od stopnia zakażenia MRSA.
Infekcje dróg oddechowych
CA-MRSA u hospitalizowanych pacjentów leczenie zapalenia płuc rozpoczyna się przed uzyskaniem wyników posiewu. Po stwierdzeniu wrażliwości na antybiotyki zakażenie można leczyć wankomycyną lub linezolidem do 21 dni. Jeśli zapalenie płuc jest powikłane nagromadzeniem ropy w jamie opłucnej otaczającej płuca, można wykonać drenaż wraz z antybiotykoterapią. Osoby z mukowiscydozą mogą rozwinąć komplikacje oddechowe związane z zakażeniem MRSA. Częstość występowania MRSA u osób z mukowiscydozą wzrosła w latach 2000-2015 pięciokrotnie. Większość z tych infekcji to HA-MRSA. MRSA odpowiada za 26% infekcji płuc u osób z mukowiscydozą.
Nie ma wystarczających dowodów na poparcie stosowania miejscowych lub systematycznych antybiotyków w przypadku donosowego lub pozanosowego zakażenia MRSA.
Infekcje kości i stawów
Oczyszczenie rany z martwej tkanki i osuszenie ropni to pierwsze działanie w leczeniu zakażenia MRSA. Podawanie antybiotyków nie jest wystandaryzowane i jest dostosowywane indywidualnie do każdego przypadku. Terapia antybiotykami może trwać do 3 miesięcy, a czasem nawet dłużej.
Zainfekowane implanty
Infekcja MRSA może wystąpić w związku z implantami i protezami stawów. Zalecenia dotyczące leczenia opierają się na czasie, w którym implant był na miejscu. W przypadku niedawnego umieszczenia implantu chirurgicznego lub sztucznego stawu, urządzenie może zostać zachowane podczas kontynuowania antybiotykoterapii. Jeśli umieszczenie urządzenia nastąpiło ponad 3 tygodnie temu, urządzenie można usunąć. Terapia antybiotykowa jest stosowana w każdym przypadku czasami długoterminowo.
Ośrodkowy układ nerwowy
MRSA może infekować ośrodkowy układ nerwowy i tworzyć ropień mózgu, ropniak podtwardówkowy i ropień nadtwardówkowy kręgosłupa. Wycięcie i drenaż można wykonać wraz z leczeniem antybiotykami. Powikłaniem może być niekiedy zakrzepica septyczna zatoki żylnej jamistej lub opony twardej .
Inne infekcje
Leczenie nie jest ustandaryzowane dla innych przypadków infekcji MRSA w wielu tkankach. Leczenie różni się w przypadku infekcji MRSA związanych z: ropniami podokostnowymi, martwiczym zapaleniem płuc, zapaleniem tkanki łącznej, ropnym zapaleniem mięśni, martwiczym zapaleniem powięzi, zapaleniem śródpiersia, ropniami mięśnia sercowego, okołonerkowego, wątroby i śledziony, septycznym zakrzepowym zapaleniem żył i ciężkimi infekcjami oczu, w tym zapaleniem wnętrza gałki ocznej. Zwierzęta mogą być rezerwuarami i przenosić MRSA na ludzi. W niektórych przypadkach infekcja może być objawowa i zwierzę może cierpieć na infekcję MRSA. Departamenty zdrowia zalecają zabranie zwierzęcia do weterynarza, jeśli infekcja MRSA nadal występuje u osób, które mają kontakt ze zwierzęciem.
Epidemiologia
Szacuje się, że na całym świecie około 2 miliardy ludzi jest nosicielami jakiejś formy S. aureus ; z nich uważa się, że do 53 milionów (2,7% przewoźników) jest nosicielami MRSA.
HA-MRSA
W amerykańskim badaniu kohortowym 1300 zdrowych dzieci, 2,4% nosiło MRSA w nosie. Sepsa bakteryjna występuje w większości (75%) przypadków inwazyjnego zakażenia MRSA. Szacuje się, że w 2009 roku było 463 017 hospitalizacji z powodu MRSA, czyli 11,74 na 1000 hospitalizacji. Wiele z tych infekcji jest mniej poważnych, ale Centers for Disease Control and Prevention (CDC) szacuje, że rocznie występuje 80 461 inwazyjnych infekcji MRSA i 11285 zgonów z powodu MRSA. W 2003 r. koszt hospitalizacji z powodu zakażenia MRSA wyniósł 92 363 USD; pobyt w szpitalu dla MSSA wyniósł 52 791 $.
Infekcja pooperacyjna jest stosunkowo rzadka, ale występuje nawet w 33% w określonych rodzajach operacji. Zakażenia operowanych miejsc wahają się od 1% do 33%. Posocznica MRSA, która pojawia się w ciągu 30 dni po zakażeniu chirurgicznym, ma 15–38% śmiertelność; Posocznica MRSA, która pojawia się w ciągu jednego roku, ma śmiertelność około 55%. Może wystąpić zwiększona śmiertelność związana z operacją kardiochirurgiczną. Odsetek osób zakażonych MRSA wynosi 12,9%, podczas gdy innymi organizmami tylko 3%. SSI zakażone MRSA miały dłuższe pobyty w szpitalu niż osoby, które tego nie zrobiły.
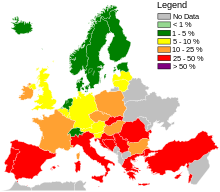
Na całym świecie wskaźniki zakażeń MRSA są dynamiczne i zmieniają się z roku na rok. Według raportu SENTRY Antimicrobial Surveillance Program z 2006 r., częstość występowania zakażeń krwi przez MRSA wynosiła 35,9 procent w Ameryce Północnej. Zakażenia krwi MRSA w Ameryce Łacińskiej wynosiły 29%. Częstość występowania w Europie wyniosła 22,8%. Wskaźnik wszystkich infekcji MRSA w Europie wahał się od 50% procent w Portugalii do 0,8 procent w Szwecji. Ogólne wskaźniki infekcji MRSA różniły się w Ameryce Łacińskiej: Kolumbia i Wenezuela łącznie miały 3%, Meksyk 50%, Chile 38%, Brazylia 29% i Argentyna 28%.
The Centers for Disease Control and Prevention (CDC) szacuje się, że około 1,7 miliona zakażeń szpitalnych wystąpił w Stanach Zjednoczonych w 2002 roku z 99.000 zgonów związanych. Szacowana częstość występowania wynosi 4,5 zakażeń szpitalnych na 100 przyjęć, z kosztami bezpośrednimi (w cenach z 2004 r.) w zakresie od 10 500 USD (5300 GBP, 8000 EUR w cenach z 2006 r.) na przypadek (w przypadku infekcji krwi, dróg moczowych lub dróg oddechowych u osób z prawidłową odpornością) do 111 000 USD (57 000 £, 85 000 €) na przypadek opornych na antybiotyki infekcji w krwiobiegu u osób po przeszczepach. Biorąc pod uwagę te liczby, ostrożne szacunki całkowitych bezpośrednich kosztów zakażeń szpitalnych wynoszą ponad 17 miliardów dolarów. Redukcja takich zakażeń stanowi ważny element działań na rzecz poprawy bezpieczeństwa opieki zdrowotnej. (BMJ 2007) Samo MRSA było związane z 8% zakażeń szpitalnych zgłoszonych do CDC National Healthcare Safety Network od stycznia 2006 do października 2007.
Narodowy Urząd Kontroli brytyjski Szacuje się, że częstość występowania zakażeń szpitalnych w Europie waha się od 4% do 10% wszystkich hospitalizacji. Od początku 2005 r. liczba zgonów w Wielkiej Brytanii przypisywanych MRSA została oszacowana przez różne źródła na około 3000 rocznie.
W Stanach Zjednoczonych około 95 milionów ludzi nosi w nosie S. aureus ; z tego 2,5 miliona (2,6% przewoźników) nosi MRSA. Przegląd populacji przeprowadzony w trzech społecznościach amerykańskich wykazał, że roczna zapadalność na CA-MRSA w latach 2001-2002 wynosiła 18-25,7/100 000; większość izolatów CA-MRSA wiązała się z klinicznie istotnymi zakażeniami, a 23% osób wymagało hospitalizacji.
CA-MRSA
W amerykańskim badaniu kohortowym 1300 zdrowych dzieci 2,4% nosiło MRSA w nosie. Istnieją obawy, że obecność MRSA w środowisku może umożliwić przeniesienie oporności na inne bakterie poprzez fagi (wirusy, które infekują bakterie). Źródłem MRSA mogą być odpady szpitalne, ścieki z gospodarstw rolnych lub inne ścieki.
LA-MRSA
MRSA związane z żywym inwentarzem (LA-MRSA) zaobserwowano w Korei, Brazylii, Szwajcarii, Malezji, Indiach, Wielkiej Brytanii, Danii i Chinach.
Historia
W 1961 roku w brytyjskim badaniu zgłoszono pierwsze znane izolaty MRSA, a od 1961 do 1967 rzadko dochodziło do wybuchów epidemii w szpitalach w Europie Zachodniej i Australii, a metycylina została następnie zarejestrowana w Anglii do leczenia opornych infekcji. Inne doniesienia o MRSA zaczęto opisywać w latach siedemdziesiątych. U niektórych szczepów S. aureus udokumentowano oporność na inne antybiotyki . W 1996 roku w Japonii odnotowano oporność na wankomycynę. W wielu krajach ogniska zakażenia MRSA były przekazywane między szpitalami. Wskaźnik wzrósł do 22% do 1995 roku, a do 1997 roku poziom zakażeń szpitalnych S. aureus przypisywanych MRSA osiągnął 50%.
Pierwsze doniesienie o pozaszpitalnym MRSA (CA-MRSA) miało miejsce w 1981 r., a w 1982 r. doszło do dużego wybuchu CA-MRSA wśród osób zażywających narkotyki dożylnie w Detroit w stanie Michigan. Dodatkowe ogniska CA-MRSA zgłaszano w latach 80. i 90. XX wieku, w tym ogniska wśród populacji australijskich Aborygenów, które nigdy nie były eksponowane w szpitalach. W połowie lat 90. pojawiły się rozproszone doniesienia o epidemiach CA-MRSA wśród amerykańskich dzieci. Podczas gdy wskaźniki HA-MRSA ustabilizowały się w latach 1998-2008, wskaźniki CA-MRSA nadal rosły. Raport wydany przez Szpital Dziecięcy Uniwersytetu w Chicago porównujący dwa okresy (1993-1995 i 1995-1997) wykazał 25-krotny wzrost liczby hospitalizacji z powodu MRSA wśród dzieci w Stanach Zjednoczonych. W 1999 roku University of Chicago poinformował o pierwszych zgonach z powodu inwazyjnego MRSA wśród skądinąd zdrowych dzieci w Stanach Zjednoczonych. Do 2004 roku opisano genom różnych szczepów MRSA.
Obserwowana zwiększona śmiertelność wśród osób zakażonych MRSA może być prawdopodobnie wynikiem zwiększonej zachorowalności tych osób. Jednak kilka badań, w tym jedno przeprowadzone przez Blot i współpracowników, które dostosowano do choroby podstawowej, nadal wykazało, że bakteriemia MRSA ma wyższą śmiertelność przypisywaną niż bakteriemia podatna na metycylinę S. aureus (MSSA).
Badanie populacyjne dotyczące częstości występowania zakażeń MRSA w San Francisco w latach 2004–2005 wykazało, że prawie jedna na 300 mieszkańców cierpiała na taką infekcję w ciągu roku, a ponad 85% tych zakażeń wystąpiło poza opieką zdrowotną ustawienie. Badanie z 2004 r. wykazało, że osoby w Stanach Zjednoczonych z zakażeniem S. aureus przebywały w szpitalu średnio trzy razy dłużej (14,3 w porównaniu z 4,5 dniami), poniosły trzykrotnie łączne koszty (48 824 USD w porównaniu z 14 141 USD) i doświadczyli pięciokrotnie większe ryzyko zgonu w szpitalu (11,2% vs 2,3%) niż osoby bez tej infekcji. W metaanalizie 31 badań Cosgrove i in. , doszli do wniosku, że bakteriemia MRSA jest związana ze zwiększoną śmiertelnością w porównaniu z bakteriemią MSSA (iloraz szans = 1,93; 95% CI = 1,93 ± 0,39 ). Ponadto Wyllie i in. zgłaszają śmiertelność 34% w ciągu 30 dni wśród osób zakażonych MRSA, wskaźnik podobny do wskaźnika zgonów 27% obserwowanego wśród osób zakażonych MSSA.
W Stanach Zjednoczonych CDC wydała wytyczne w dniu 19 października 2006 r., powołując się na potrzebę dodatkowych badań, ale odmówiła zalecenia takich badań. Według CDC najnowsze szacunki dotyczące częstości występowania zakażeń związanych z opieką zdrowotną, które można przypisać MRSA w Stanach Zjednoczonych, wskazują na spadek takich wskaźników zakażeń. Częstość występowania zakażeń krwi MRSA związanych z linią centralną zgłoszona przez setki oddziałów intensywnej terapii zmniejszyła się o 50-70% w latach 2001-2007. Oddzielny system śledzący wszystkie szpitalne zakażenia krwi MRSA wykazał całkowity spadek o 34% w latach 2005-2008. W 2010 r. lekiem z wyboru była wankomycyna.
W całej Europie, w oparciu głównie o dane z 2013 r., siedem krajów (Islandia, Norwegia, Szwecja, Holandia, Dania, Finlandia i Estonia, od najniższego do najwyższego) miało niski poziom zakażeń szpitalnych MRSA w porównaniu z innymi, a wśród W krajach o wyższych poziomach, znaczna poprawa została dokonana tylko w Bułgarii, Polsce i na Wyspach Brytyjskich.
Odkryto, że 1000-letnia receptura maści do oczu znaleziona w średniowiecznej Bald's Leechbook w British Library , jednym z najwcześniejszych znanych podręczników medycznych, wykazuje działanie przeciwko MRSA in vitro oraz w ranach skóry u myszy.
W mediach
MRSA jest często tematem medialnym, zwłaszcza jeśli znane osobistości ogłosiły, że mają lub przeszły infekcję. Informacje o wybuchach infekcji pojawiają się regularnie w gazetach i telewizyjnych programach informacyjnych. Raport na temat infekcji skóry i tkanek miękkich w więzieniu Cook County w Chicago w latach 2004–2005 wykazał, że MRSA jest najczęstszą przyczyną tych infekcji wśród osadzonych tam. Pozwy wnoszone przeciwko osobom oskarżonym o zarażanie innych MRSA są również popularnymi artykułami w mediach.
MRSA jest tematem programów radiowych, programów telewizyjnych, książek i filmów.
Badania
Różne przeciwbakteryjne ekstrakty chemiczne z różnych gatunków drzewa cukrowego (rodzaj Liquidambar ) zostały zbadane pod kątem ich aktywności w hamowaniu MRSA. W szczególności są to: kwas cynamonowy , cynamonian cynamonowy, cynamonian etylu , cynamonian benzylu , styren , wanilina , alkohol cynamonowy , alkohol 2-fenylopropyl i 3-fenylopropyl cynamonowy.
Trwają prace nad dostarczaniem wziewnych antybiotyków wraz z systematycznym podawaniem w leczeniu MRSA. Może to poprawić wyniki osób z mukowiscydozą i innymi infekcjami dróg oddechowych. Terapia fagowa jest stosowana od lat w przypadku MRSA w krajach wschodnich, a badania trwają w krajach zachodnich.
MRSA zostanie włączona do eksperymentów i będzie hodowana na Międzynarodowej Stacji Kosmicznej, aby obserwować wpływ zerowej grawitacji na jej ewolucję.
Przegląd systematyczny Cochrane z 2015 r. miał na celu ocenę skuteczności noszenia rękawiczek, fartuchów i masek w celu powstrzymania rozprzestrzeniania się MRSA w szpitalach, jednak nie zidentyfikowano badań kwalifikujących się do włączenia. Autorzy przeglądu doszli do wniosku, że istnieje potrzeba przeprowadzenia randomizowanych, kontrolowanych badań, które pomogą ustalić, czy stosowanie rękawiczek, fartuchów i masek zmniejsza przenoszenie MRSA w szpitalach.
Bibliografia
Dalsza lektura
- Centra Kontroli i Zapobiegania Chorobom informacje, profilaktyka, statystyki, grupy ryzyka, przyczyny, zasoby edukacyjne i czynniki środowiskowe.
- Informacje Narodowego Instytutu Bezpieczeństwa i Higieny Pracy dotyczące bakterii, narażenia w miejscu pracy i zmniejszania ryzyka zakażenia.