Malaria - Malaria
| Malaria | |
|---|---|
 | |
| Pasożyt malarii łączący się z czerwoną krwinką | |
| Wymowa | |
| Specjalność | Choroba zakaźna |
| Objawy | Gorączka, wymioty, ból głowy, żółta skóra |
| Komplikacje | Drgawki , śpiączka |
| Zwykły początek | 10-15 dni po ekspozycji |
| Powoduje | Plasmodium przenoszone przez komary |
| Metoda diagnostyczna | Badanie krwi, testy na wykrywanie antygenu |
| Zapobieganie | Moskitiery , środki odstraszające owady , zwalczanie komarów , leki |
| Lek | Leki przeciwmalaryczne |
| Częstotliwość | 229 mln (2019) |
| Zgony | 409 000 w 2019 r. |
Malaria to choroba zakaźna przenoszona przez komary, która dotyka ludzi i inne zwierzęta. Malaria powoduje objawy, które zazwyczaj obejmują gorączkę , zmęczenie , wymioty i bóle głowy . W ciężkich przypadkach może powodować zażółcenie skóry , drgawki , śpiączkę lub śmierć . Objawy zwykle zaczynają się dziesięć do piętnastu dni po ukąszeniu przez zarażonego komara . Jeśli nie są odpowiednio leczone, ludzie mogą mieć nawrót choroby kilka miesięcy później. U osób, które niedawno przeżyły infekcję , ponowna infekcja zwykle powoduje łagodniejsze objawy. Ta częściowa odporność zanika z upływem miesięcy, a nawet lat, jeśli dana osoba nie jest narażona na stałą ekspozycję na malarię.
Malarię wywołują jednokomórkowe mikroorganizmy z grupy Plasmodium . Rozprzestrzenia się wyłącznie poprzez ukąszenia zarażonych komarów Anopheles , zgodnie z arkuszem informacyjnym WHO z 2014 roku. Ukąszenie komara wprowadza pasożyty ze śliny komara do krwi człowieka . Pasożyty wędrują do wątroby, gdzie dojrzewają i rozmnażają się . Pięć gatunków Plasmodium może zarażać i rozprzestrzeniać się przez ludzi. Większość zgonów jest spowodowana przez P. falciparum , podczas gdy P. vivax , P. ovale i P. malariae generalnie powodują łagodniejszą postać malarii . Gatunek P. knowlesi rzadko powoduje choroby u ludzi. Malarię zazwyczaj rozpoznaje się na podstawie mikroskopowego badania krwi przy użyciu rozmazów krwi lub szybkich testów diagnostycznych opartych na antygenie . Opracowano metody wykorzystujące reakcję łańcuchową polimerazy do wykrywania DNA pasożyta , ale nie są one powszechnie stosowane na obszarach, gdzie malaria jest powszechna ze względu na ich koszt i złożoność.
Ryzyko choroby można zmniejszyć, zapobiegając ukąszeniom komarów, stosując moskitiery i środki odstraszające owady lub stosując środki zwalczania komarów, takie jak rozpylanie środków owadobójczych i odprowadzanie stojącej wody . Dostępnych jest kilka leków zapobiegających malarii u osób podróżujących do obszarów, w których choroba jest powszechna. Miejscami dawki kombinacja leków sulfadoksyną / pirymetaminą zalecane są niemowlęta i po pierwszym trymestrze w ciąży na obszarach o wysokiej stopie malarii. Od 2020 r. istnieje jedna szczepionka, która, jak wykazano, zmniejsza ryzyko malarii u dzieci w Afryce o około 40%. Wstępne badanie innej szczepionki wykazało 77% skuteczność szczepionki, ale to badanie nie przeszło jeszcze recenzji naukowej. Trwają prace nad opracowaniem skuteczniejszych szczepionek. Zalecane leczenie malarii jest połączenie z przeciwmalarycznych leków , który zawiera artemizyny . Drugim lekiem może być meflochina , lumefantryna lub sulfadoksyna/pirymetamina. Chinina wraz z doksycykliną może być stosowana, jeśli artemizynina nie jest dostępna. Zaleca się, aby na obszarach, gdzie choroba jest powszechna, malarię potwierdzić, jeśli to możliwe, przed rozpoczęciem leczenia ze względu na obawy o zwiększenie lekooporności . Oporność pasożytów rozwinęła się na kilka leków przeciwmalarycznych; na przykład, chlorochina oporny P. falciparum rozprzestrzenił się na większości obszarów dotkniętych malarią, a odporność na artemisininu stał się problemem w niektórych częściach Azji Południowo-Wschodniej.
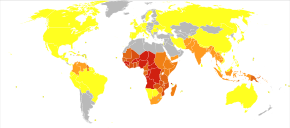
Choroba jest szeroko rozpowszechniona w regionach tropikalnych i subtropikalnych , które występują w szerokim paśmie wokół równika . Obejmuje to znaczną część Afryki Subsaharyjskiej , Azji i Ameryki Łacińskiej . W 2019 r. na całym świecie odnotowano 229 milionów przypadków malarii, co spowodowało około 409 000 zgonów. Około 94% przypadków i zgonów miało miejsce w Afryce Subsaharyjskiej. Wskaźniki zachorowań spadły od 2010 do 2014, ale wzrosły od 2015 do 2019. Malaria jest powszechnie kojarzona z ubóstwem i ma znaczący negatywny wpływ na rozwój gospodarczy . Szacuje się, że w Afryce powoduje to straty w wysokości 12 miliardów USD rocznie z powodu zwiększonych kosztów opieki zdrowotnej, utraty zdolności do pracy i niekorzystnego wpływu na turystykę.
Symptomy i objawy
Objawy malarii zwykle pojawiają się od 8 do 25 dni po zakażeniu, ale mogą wystąpić później u osób, które przyjmowały leki przeciwmalaryczne jako profilaktykę . Początkowe objawy choroby – wspólne dla wszystkich gatunków malarii – są podobne do objawów grypopodobnych i mogą przypominać inne stany, takie jak posocznica , zapalenie żołądka i jelit oraz choroby wirusowe . Objawy mogą obejmować ból głowy , gorączkę , dreszcze , ból stawów , wymioty , anemię hemolityczną , żółtaczkę , hemoglobinę w moczu , uszkodzenie siatkówki i drgawki .
Klasycznym objawem malarii jest napad — cykliczne występowanie nagłego zimna, po którym następują dreszcze, a następnie gorączka i pocenie się, występujące co dwa dni ( gorączka trzeciorzędowa ) w przypadku infekcji P. vivax i P. ovale oraz co trzy dni ( gorączka kwartanowa ) w przypadku infekcji P. vivax i P. ovale. P. malariae . Zakażenie P. falciparum może powodować nawracającą gorączkę co 36–48 godzin lub gorączkę mniej wyraźną i prawie ciągłą.
Ciężka malaria jest zwykle wywoływana przez P. falciparum (często nazywaną malarią falciparum). Objawy malarii falciparum pojawiają się 9-30 dni po zakażeniu. Osoby z malarią mózgową często wykazują objawy neurologiczne , w tym nieprawidłową postawę , oczopląs , sprzężone porażenie wzroku (brak skręcania się oczu w tym samym kierunku), opistotonus , drgawki lub śpiączkę .
Komplikacje
Malaria ma kilka poważnych powikłań . Wśród nich jest rozwój niewydolności oddechowej , która występuje nawet u 25% dorosłych i 40% dzieci z ciężką malarią wywołaną przez P. falciparum . Możliwe przyczyny to kompensacja oddechowa kwasicy metabolicznej , niekardiogenny obrzęk płuc , współistniejące zapalenie płuc i ciężka niedokrwistość . Chociaż zespół ostrej niewydolności oddechowej występuje rzadko u małych dzieci z ciężką malarią, występuje u 5–25% dorosłych i do 29% kobiet w ciąży. Koinfekcji z HIV ze wzrostem śmiertelności malarii. Niewydolność nerek jest cechą gorączki czarnej wody , w której hemoglobina ze zlizowanych czerwonych krwinek przedostaje się do moczu.
Zakażenie P. falciparum może skutkować malarią mózgową, postacią ciężkiej malarii, która obejmuje encefalopatię . Wiąże się to z wybielaniem siatkówki, które może być użytecznym objawem klinicznym w odróżnianiu malarii od innych przyczyn gorączki. Powiększona śledziona , powiększenie wątroby lub obu z nich , ciężkie bóle głowy, niski poziom cukru we krwi i hemoglobiny z moczem z niewydolnością nerek może wystąpić. Powikłania mogą obejmować spontaniczne krwawienie, koagulopatię i wstrząs .
Malaria u kobiet w ciąży jest ważną przyczyną martwych urodzeń , śmiertelności noworodków , poronień i niskiej masy urodzeniowej , szczególnie w przypadku infekcji P. falciparum , ale także P. vivax .
Przyczyna
Pasożyty malarii należą do rodzaju Plasmodium ( typ Apicomplexa ). U ludzi malaria jest wywoływana głównie przez pięć gatunków Plasmodium spp . licząc P. falciparum , P. malariae , P. ovale , P. vivax i P. knowlesi . Wśród zarażonych najczęściej identyfikowanym gatunkiem jest P. falciparum (~75%), a następnie P. vivax (~20%). Chociaż P. falciparum tradycyjnie odpowiada za większość zgonów, najnowsze dowody sugerują, że malaria wywołana przez P. vivax jest związana z chorobami potencjalnie zagrażającymi życiu mniej więcej tak często, jak przy diagnozie zakażenia P. falciparum . P. vivax proporcjonalnie częściej występuje poza Afryką. Udokumentowano infekcje ludzi kilkoma gatunkami Plasmodium z wyższych małp człekokształtnych ; jednak z wyjątkiem P. knowlesi – gatunku odzwierzęcego wywołującego malarię u makaków – mają one w większości ograniczone znaczenie dla zdrowia publicznego.
Koło życia
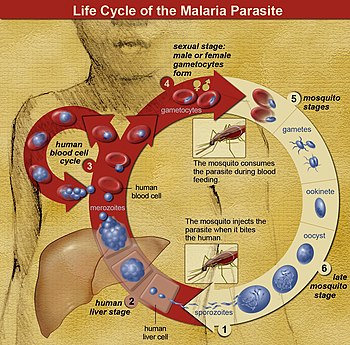
W cyklu z Plasmodium , kobieta Anopheles komar (The żywiciela ostatecznego ) transmituje ruchomy zakaźnego forma (zwany sporozoitów ) gospodarzowi kręgowca, takiego jak człowiek (przyjmujące drugorzędowe), działając w ten sposób jako transmisji wektora . Sporozoit wędruje przez naczynia krwionośne do komórek wątroby ( hepatocytów ), gdzie rozmnaża się bezpłciowo ( schizogonia tkankowa ), wytwarzając tysiące merozoitów . Zarażają one nowe czerwone krwinki i inicjują serię bezpłciowych cykli rozmnażania (schizogonia krwi), które wytwarzają od 8 do 24 nowych zakaźnych merozoitów, w którym to momencie komórki pękają i cykl zakaźny rozpoczyna się od nowa.
Inne merozoity rozwijają się w niedojrzałe gametocyty , które są prekursorami gamet męskich i żeńskich . Kiedy zapłodniony komar ugryzie zarażoną osobę, gametocyty są pobierane z krwią i dojrzewają w jelicie komara. Gametocyty męskie i żeńskie łączą się i tworzą okinetę – zapłodnioną, ruchliwą zygotę . Ookinety rozwijają się w nowe sporozoity, które migrują do gruczołów ślinowych owadów , gotowe do zarażenia nowego żywiciela kręgowca. Sporozoity są wstrzykiwane w skórę, w ślinie, gdy komar pobiera kolejny posiłek z krwi.
Tylko samice komarów żywią się krwią; samce komarów żywią się nektarem roślinnym i nie przenoszą choroby. Samice z rodzaju Anopheles wolą żerować w nocy. Zwykle zaczynają szukać posiłku o zmierzchu i kontynuują noc, aż im się uda. Pasożyty malarii mogą być również przenoszone przez transfuzje krwi , chociaż zdarza się to rzadko.
Malaria nawracająca
Objawy malarii mogą nawracać po różnych okresach bezobjawowych. W zależności od przyczyny nawrót można sklasyfikować jako nawrót , nawrót lub ponowną infekcję. Nawrót objawów występuje, gdy objawy powracają po okresie bezobjawowym. Jest to spowodowane przez pasożyty żyjące we krwi w wyniku nieodpowiedniego lub nieskutecznego leczenia. Nawrót ma miejsce, gdy objawy pojawiają się ponownie po usunięciu pasożytów z krwi, ale utrzymują się jako uśpione hipnozoity w komórkach wątroby. Nawrót występuje zwykle między 8 a 24 tygodniem i jest często obserwowany w zakażeniach P. vivax i P. ovale . Jednak nawroty podobne do nawrotów P. vivax są prawdopodobnie nadmiernie przypisywane aktywacji hipnozoitów. Niektóre z nich mogą mieć pozanaczyniowe pochodzenie merozoitowe, co sprawia, że te nawroty są nawrotami, a nie nawrotami. Jednym z nowo rozpoznanych, niehipnozoitowych źródeł, które może przyczyniać się do nawracającej obwodowej parazytemii P. vivax, są postacie erytrocytów w szpiku kostnym. P. vivax malarii przypadki w umiarkowanych obszarach często wiąże zimowania przez hipnozoity z nawroty początku roku po ukąszeniu komara. Ponowna infekcja oznacza, że pasożyt, który spowodował poprzednią infekcję, został usunięty z organizmu, ale wprowadzono nowego pasożyta. Nawrotu zakażenia nie można łatwo odróżnić od nawrotu, chociaż nawrót zakażenia w ciągu dwóch tygodni od leczenia początkowego zakażenia jest zazwyczaj przypisywany niepowodzeniu leczenia. Ludzie mogą rozwinąć pewną odporność, gdy są narażeni na częste infekcje.
Patofizjologia
Infekcja malarią rozwija się w dwóch fazach: jedna, która obejmuje wątrobę (faza egzoerytrocytowa), druga, która obejmuje czerwone krwinki lub erytrocyty (faza erytrocytowa). Kiedy zarażony komar przebije skórę człowieka, aby pobrać posiłek z krwi, sporozoity w ślinie komara dostają się do krwiobiegu i migrują do wątroby, gdzie infekują hepatocyty, rozmnażając się bezpłciowo i bezobjawowo przez okres 8–30 dni.
Po potencjalnym okresie uśpienia w wątrobie organizmy te różnicują się, tworząc tysiące merozoitów, które po pęknięciu komórek gospodarza przedostają się do krwi i infekują czerwone krwinki, rozpoczynając erytrocytarny etap cyklu życiowego. Pasożyt ucieka z wątroby niepostrzeżenie, owijając się w błonę komórkową zakażonej komórki wątroby gospodarza.
W czerwonych krwinkach pasożyty rozmnażają się dalej, ponownie bezpłciowo, okresowo wyrywając się z komórek gospodarza, aby zaatakować świeże czerwone krwinki. Zachodzi kilka takich cykli amplifikacji. Tak więc klasyczne opisy fal gorączki wynikają z równoczesnych fal merozoitów uciekających i zakażających czerwone krwinki.
Niektóre sporozoity P. vivax nie rozwijają się natychmiast w merozoity w fazie egzoerytrocytów, ale zamiast tego wytwarzają hipnozoity, które pozostają uśpione przez okres od kilku miesięcy (typowo 7-10 miesięcy) do kilku lat. Po okresie uśpienia reaktywują się i produkują merozoity. Hipnozoity są odpowiedzialne za długą inkubację i późne nawroty infekcji P. vivax , chociaż ich istnienie w P. ovale jest niepewne.
Pasożyt jest stosunkowo chroniony przed atakiem układu odpornościowego organizmu, ponieważ przez większość ludzkiego cyklu życiowego przebywa w wątrobie i komórkach krwi i jest stosunkowo niewidoczny dla nadzoru immunologicznego. Jednak krążące zakażone komórki krwi są niszczone w śledzionie . Aby uniknąć tego losu, pasożyt P. falciparum wyświetla adhezyjne białka na powierzchni zakażonych komórek krwi, powodując przyklejanie się komórek krwi do ścianek małych naczyń krwionośnych, tym samym uniemożliwiając pasożytowi przejście przez krążenie ogólne i śledzionę. Zablokowanie mikronaczyń powoduje objawy, takie jak malaria łożyskowa. Sekwestrowane krwinki czerwone mogą naruszać barierę krew-mózg i powodować malarię mózgową.
Odporność genetyczna
Według przeglądu z 2005 r., ze względu na wysoki poziom śmiertelności i zachorowalności spowodowanych malarią – zwłaszcza gatunkiem P. falciparum – wywarł on największą presję selekcyjną na genom człowieka w najnowszej historii. Kilka czynników genetycznych zapewnić pewną odporność na niej łącznie cechy sierpowatej , talasemią cech, niedobór dehydrogenazy glukozo-6-fosforanowej , a przy braku antygenu Duffy z czerwonych krwinek.
Wpływ anemii sierpowatej na odporność na malarię ilustruje pewne ewolucyjne kompromisy, które pojawiły się z powodu endemicznej malarii. Cecha sierpowatokrwinkowa powoduje zmianę w cząsteczce hemoglobiny we krwi. Zwykle czerwone krwinki mają bardzo elastyczny, dwuwklęsły kształt, który umożliwia im poruszanie się przez wąskie naczynia włosowate ; jednak, gdy zmodyfikowane cząsteczki hemoglobiny S są wystawione na działanie małych ilości tlenu lub sklejają się z powodu odwodnienia, mogą sklejać się, tworząc pasma, które powodują zniekształcenie komórki w zakrzywiony kształt sierpa. W tych niciach cząsteczka nie jest tak skuteczna w pobieraniu lub uwalnianiu tlenu, a komórka nie jest wystarczająco elastyczna, aby swobodnie krążyć. We wczesnych stadiach malarii pasożyt może powodować sierpienie zakażonych krwinek czerwonych, dzięki czemu są one wcześniej usuwane z krążenia. Zmniejsza to częstotliwość, z jaką pasożyty malarii kończą swój cykl życiowy w komórce. Osoby, które są homozygotyczne (z dwoma kopiami nieprawidłowego allelu hemoglobiny beta ) mają anemię sierpowatą , podczas gdy osoby heterozygotyczne (z jednym nieprawidłowym allelem i jednym normalnym allelem) doświadczają odporności na malarię bez ciężkiej niedokrwistości. Chociaż krótsza oczekiwana długość życia dla osób z chorobą homozygotyczną może nie sprzyjać przetrwaniu cechy, cecha ta jest zachowana w regionach podatnych na malarię ze względu na korzyści zapewniane przez formę heterozygotyczną.
Dysfunkcja wątroby
Dysfunkcja wątroby w wyniku malarii jest rzadka i zwykle występuje tylko u osób z inną chorobą wątroby, taką jak wirusowe zapalenie wątroby lub przewlekła choroba wątroby . Zespół ten jest czasami nazywany malaryjnym zapaleniem wątroby . Chociaż uważa się to za rzadkie zjawisko, hepatopatia malarii odnotowała wzrost, szczególnie w Azji Południowo-Wschodniej i Indiach. Uszkodzenie wątroby u osób z malarią koreluje z większym prawdopodobieństwem powikłań i śmierci.
Diagnoza
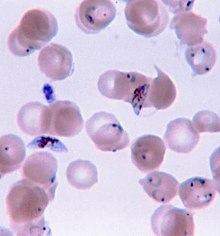
Ze względu na niespecyficzny charakter objawów rozpoznanie malarii na terenach nieendemicznych wymaga dużego podejrzenia, które może wywołać: niedawna historia podróży, powiększenie śledziony , gorączka, mała liczba płytek krwi we krwi i wyższe niż normalne stężenie bilirubiny we krwi w połączeniu z prawidłowym poziomem białych krwinek . Raporty z 2016 i 2017 roku z krajów, w których malaria jest powszechna, sugerują wysoki poziom przediagnozowania z powodu niewystarczających lub niedokładnych badań laboratoryjnych.
Malaria jest potwierdzona przez badanie mikroskopowe rozmazu krwi lub antygenu -na szybkich testów diagnostycznych (RTD). W niektórych obszarach RDT muszą być w stanie odróżnić, czy objawy malarii są spowodowane przez Plasmodium falciparum, czy przez inne gatunki pasożytów, ponieważ strategie leczenia mogą się różnić w przypadku infekcji innych niż P. falciparum . Mikroskopia jest najczęściej stosowaną metodą wykrywania pasożyta malarii — w 2010 r. zbadano około 165 milionów filmów krwi pod kątem malarii. test, a dokładność wyników zależy zarówno od umiejętności osoby badającej rozmaz krwi, jak i od poziomu pasożyta we krwi. Czułości filmów krwi mieści się w zakresie od 75 do 90%, w warunkach optymalnych, do poziomu 50%. Dostępne na rynku RDT są często dokładniejsze niż rozmazy krwi w przewidywaniu obecności pasożytów malarii, ale ich czułość i swoistość diagnostyczna jest bardzo zróżnicowana w zależności od producenta i nie są w stanie określić, ile pasożytów jest obecnych. Jednak włączenie RDT do diagnozy malarii może ograniczyć przepisywanie leków przeciwmalarycznych. Chociaż RDT nie poprawia wyników zdrowotnych osób zakażonych malarią, nie prowadzi również do gorszych wyników w porównaniu z przypuszczalnym leczeniem przeciwmalarycznym.
W regionach, w których testy laboratoryjne są łatwo dostępne, należy podejrzewać malarię i badać ją u każdej chorej osoby, która przebywała na obszarze endemicznym występowania malarii. W rejonach, których nie stać na laboratoryjne testy diagnostyczne, powszechne stało się wykorzystywanie historii gorączki jako wskazania do leczenia malarii – stąd powszechna nauka „gorączka równa się malarii, o ile nie udowodniono inaczej”. Wadą tej praktyki jest nadmierna diagnoza malarii i złe postępowanie z gorączką niemalaryczną , co marnuje ograniczone zasoby, podważa zaufanie do systemu opieki zdrowotnej i przyczynia się do lekooporności. Chociaż opracowano testy oparte na reakcji łańcuchowej polimerazy , nie są one szeroko stosowane w obszarach, w których malaria jest powszechna od 2012 r., ze względu na ich złożoność.
Klasyfikacja
Malaria jest klasyfikowana przez Światową Organizację Zdrowia (WHO) jako „ciężka” lub „nieskomplikowana” . Jest uważany za poważny, gdy spełnione jest którekolwiek z poniższych kryteriów, w przeciwnym razie jest uważany za nieskomplikowany.
- Zmniejszona świadomość
- Znaczna słabość, taka, że osoba nie jest w stanie chodzić
- Niezdolność do karmienia
- Dwa lub więcej drgawek
- Niskie ciśnienie krwi (mniej niż 70 mmHg u dorosłych i 50 mmHg u dzieci)
- Problemy z oddychaniem
- Wstrząs krążeniowy
- Niewydolność nerek lub hemoglobina w moczu
- Problemy z krwawieniem lub hemoglobina poniżej 50 g/l (5 g/dl)
- Obrzęk płuc
- Poziom glukozy we krwi poniżej 2,2 mmol/L (40 mg/dL)
- Kwasica lub poziom mleczanu powyżej 5 mmol/L
- Poziom pasożytów we krwi przekraczający 100 000 na mikrolitr (µl) w obszarach przenoszenia o niskiej intensywności lub 250 000 na µl w obszarach przenoszenia o wysokiej intensywności
Malarię mózgową definiuje się jako ciężką P. falciparum – malarię objawiającą się objawami neurologicznymi, w tym śpiączką (w skali Glasgow poniżej 11 lub w skali Blantyre poniżej 3) lub ze śpiączką trwającą dłużej niż 30 minut po napad.
Różne rodzaje malarii zostały nazwane poniższymi nazwami:
| Nazwa | Patogen | Uwagi |
|---|---|---|
| algi malaria | Plasmodium falciparum | ciężka malaria wpływająca na układ sercowo-naczyniowy i powodująca dreszcze oraz wstrząs krążeniowy |
| malaria żółciowa | Plasmodium falciparum | ciężka malaria atakująca wątrobę i powodująca wymioty i żółtaczkę |
| malaria mózgowa | Plasmodium falciparum | ciężka malaria atakująca mózg |
| wrodzona malaria | różne plazmodia | plazmodium wprowadzone od matki przez krążenie płodowe |
| złośliwa malaria | Plasmodium falciparum | ciężka malaria prowadząca do ciężkiej choroby |
| złośliwa malaria | Plasmodium falciparum | ciężka malaria prowadząca do śmierci |
| malaria falciparum, malaria Plasmodium falciparum , | Plasmodium falciparum | |
| ovale malarii Plasmodium ovale malaria | Plasmodium owalne | |
| malaria kwartanowa, malariae malaria, malariae Plasmodium malaria | Malariae Plasmodium | napady co czwarty dzień ( kwartan ), licząc dzień wystąpienia jako pierwszy dzień |
| malaria codzienna | Plasmodium falciparum , Plasmodium vivax , Plasmodium knowlesi | napady codziennie ( codziennie ) |
| malaria tercjańska | Plasmodium falciparum , Plasmodium ovale , Plasmodium vivax | napady co trzeci dzień ( tertian ), licząc dzień wystąpienia jako pierwszy |
| malaria transfuzyjna | różne plazmodia | plazmodium wprowadzone przez transfuzję krwi , wspólne używanie igły lub ukłucie igłą |
| vivax malarii Plasmodium vivax malaria | Plasmodium vivax |
Zapobieganie

Metody stosowane w zapobieganiu malarii obejmują leki, eliminację komarów i zapobieganie ukąszeniom. Od 2020 roku istnieje jedna szczepionka na malarię (znana jako RTS,S ), która jest dopuszczona do użytku. Obecność malarii na danym obszarze wymaga połączenia wysokiej gęstości populacji ludzkiej, wysokiej gęstości populacji komarów anopheles oraz wysokiego wskaźnika przenoszenia z ludzi na komary iz komarów na ludzi. Jeśli którykolwiek z nich zostanie wystarczająco obniżony, pasożyt ostatecznie zniknie z tego obszaru, jak to miało miejsce w Ameryce Północnej, Europie i niektórych częściach Bliskiego Wschodu. Jednakże, o ile pasożyt nie zostanie wyeliminowany z całego świata, może ponownie się zadomowić, jeśli warunki powrócą do kombinacji, która sprzyja rozmnażaniu się pasożyta. Co więcej, koszt eliminacji komarów anopheles na osobę rośnie wraz ze zmniejszaniem się gęstości zaludnienia, co na niektórych obszarach jest ekonomicznie niewykonalne.
Na dłuższą metę zapobieganie malarii może być bardziej opłacalne niż leczenie choroby, ale początkowe wymagane koszty są poza zasięgiem wielu najbiedniejszych ludzi na świecie. Istnieje duża różnica w kosztach kontroli (tj. utrzymania niskiej endemiczności) i programów eliminacyjnych pomiędzy krajami. Na przykład w Chinach – których rząd w 2010 roku ogłosił strategię dążenia do eliminacji malarii w chińskich prowincjach – wymagana inwestycja to niewielka część wydatków publicznych na zdrowie. W przeciwieństwie do tego, podobny program w Tanzanii kosztowałby szacunkowo jedną piątą budżetu zdrowia publicznego.
Na obszarach, gdzie malaria jest powszechna, dzieci poniżej piątego roku życia często cierpią na anemię , która czasami jest spowodowana malarią. Podawanie dzieciom z niedokrwistością w tych obszarach profilaktycznych leków przeciwmalarycznych nieznacznie poprawia poziom czerwonych krwinek, ale nie wpływa na ryzyko zgonu lub konieczność hospitalizacji.
Kontrola komarów

Kontrola wektora odnosi się do metod stosowanych w celu zmniejszenia malarii poprzez zmniejszenie poziomu przenoszenia przez komary. Dla indywidualnej ochrony najskuteczniejsze środki odstraszające owady oparte są na DEET lub pikarydynie . Jednak nie ma wystarczających dowodów na to, że środki odstraszające komary mogą zapobiegać zakażeniu malarią. Siatki nasączone środkami owadobójczymi (ITN) i opryski szczątkowe w pomieszczeniach (IRS) są skuteczne, są powszechnie stosowane w zapobieganiu malarii, a ich stosowanie znacząco przyczyniło się do zmniejszenia zachorowalności na malarię w XXI wieku. ITN i IRS mogą nie być wystarczające do całkowitego wyeliminowania choroby, ponieważ interwencje te zależą od tego, ile osób korzysta z siatek, ile jest luk w środkach owadobójczych (obszary o niskim zasięgu), czy ludzie nie są chronieni poza domem oraz wzrost komarów odpornych na środki owadobójcze. Modyfikacje domów w celu zapobiegania narażeniu na komary mogą być ważnym długoterminowym środkiem zapobiegawczym.
Siatki nasączone środkiem owadobójczym
Moskitiery pomagają trzymać komary z dala od ludzi i zmniejszają wskaźniki infekcji i przenoszenia malarii. Siatki nie są idealną barierą i często są traktowane środkiem owadobójczym przeznaczonym do zabicia komara, zanim zdąży znaleźć drogę przez sieć. Szacuje się, że siatki nasączone środkiem owadobójczym (ITN) są dwa razy bardziej skuteczne niż siatki nienaprawiane i zapewniają ponad 70% ochronę w porównaniu z siatką bez siatki. W latach 2000-2008 wykorzystanie ITN uratowało życie około 250 000 niemowląt w Afryce Subsaharyjskiej. Około 13% gospodarstw domowych w krajach subsaharyjskich posiadało sieci ITN w 2007 r., a szacuje się, że w 2008 r. 31% gospodarstw domowych w Afryce posiadało co najmniej jedną sieć ITN. W 2000 r. 1,7 miliona (1,8%) afrykańskich dzieci mieszkało na obszarach świata, gdzie jest powszechne, były chronione przez ITN. Liczba ta wzrosła do 20,3 miliona (18,5%) afrykańskich dzieci używających ITN w 2007 r., pozostawiając 89,6 miliona dzieci bez ochrony, a do 68% afrykańskich dzieci używających moskitier w 2015 r. Większość moskitier jest impregnowana pyretroidami , klasą środków owadobójczych o niskiej toksyczności . Najskuteczniejsze są stosowane od zmierzchu do świtu. Zaleca się zawieszenie dużej „siatki na łóżko” nad środkiem łóżka i wsunięcie krawędzi pod materac lub upewnienie się, że jest wystarczająco duża, aby dotykała podłoża. ITN mają korzystny wpływ na wyniki ciąży w regionach Afryki, w których występuje malaria, ale potrzeba więcej danych w Azji i Ameryce Łacińskiej.
Na obszarach o wysokiej odporności na malarię, butanolan piperonylu (PBO) w połączeniu z pyretroidami w moskitierach skutecznie zmniejsza wskaźniki infekcji malarią. Pozostają pytania dotyczące trwałości PBO na siatkach, ponieważ wpływ na śmiertelność komarów nie utrzymał się po dwudziestu praniach w próbach eksperymentalnych.
Opryskiwanie resztkowe w pomieszczeniach
Opryskiwanie szczątkowe w pomieszczeniach to rozpylanie insektycydów na ścianach w domu. Po jedzeniu wiele komarów odpoczywa na pobliskiej powierzchni, trawiąc mączkę krwi, więc jeśli ściany domów zostały pokryte środkami owadobójczymi, odpoczywające komary mogą zostać zabite, zanim zdążą ugryźć inną osobę i przenieść pasożyta malarii. Od 2006 roku Światowa Organizacja Zdrowia zaleca stosowanie 12 insektycydów w operacjach IRS, w tym DDT oraz pyretroidy cyflutrynę i deltametrynę . Stosowanie niewielkich ilości DDT w służbie zdrowia publicznego jest dozwolone na mocy konwencji sztokholmskiej , która zakazuje jego stosowania w rolnictwie. Jednym z problemów związanych ze wszystkimi formami IRS jest odporność na środki owadobójcze . Komary dotknięte IRS zwykle odpoczywają i żyją w pomieszczeniach, a ze względu na podrażnienia spowodowane opryskiwaniem ich potomkowie odpoczywają i żyją na zewnątrz, co oznacza, że są mniej podatne na IRS. Nie ma pewności, czy stosowanie IRS razem z ITN jest skuteczne w ograniczaniu przypadków malarii ze względu na dużą różnorodność geograficzną rozmieszczenia malarii, przenoszenie malarii i odporność na środki owadobójcze.
Modyfikacje obudowy
Mieszkanie jest czynnikiem ryzyka malarii, a modyfikacja domu jako środek zapobiegawczy może być zrównoważoną strategią, która nie opiera się na skuteczności insektycydów, takich jak pyretroidy . Rozważane jest fizyczne środowisko wewnątrz i na zewnątrz domu, które może poprawić zagęszczenie komarów. Przykłady potencjalnych modyfikacji obejmują odległość domu od miejsc lęgowych komarów, drenaż i zaopatrzenie w wodę w pobliżu domu, dostępność miejsc odpoczynku komarów (roślinność wokół domu), bliskość żywego inwentarza i zwierząt domowych oraz fizyczne ulepszenia lub modyfikacje projekt domu, aby zapobiec przedostawaniu się komarów.
Inne metody zwalczania komarów
Ludzie próbowali wielu innych metod ograniczania ukąszeń komarów i spowolnienia rozprzestrzeniania się malarii. Wysiłki mające na celu zmniejszenie liczby larw komarów poprzez zmniejszenie dostępności otwartej wody, w której się rozwijają, lub poprzez dodanie substancji ograniczających ich rozwój, są skuteczne w niektórych lokalizacjach. Elektroniczne urządzenia odstraszające komary, które wydają dźwięki o bardzo wysokiej częstotliwości, które mają odstraszać samice komarów, nie mają potwierdzających dowodów skuteczności. Istnieją dowody na niską pewność, że zamglenie może mieć wpływ na przenoszenie malarii. Larwicydowanie przez ręczne dostarczanie chemicznych lub mikrobiologicznych insektycydów do zbiorników wodnych o niskim rozmieszczeniu larw może zmniejszyć przenoszenie malarii. Nie ma wystarczających dowodów, aby określić, czy ryby larwalne mogą zmniejszyć zagęszczenie i transmisję komarów na tym obszarze.
Leki
Istnieje wiele leków, które mogą pomóc w zapobieganiu lub przerywaniu malarii u osób podróżujących do miejsc, w których infekcja jest powszechna. Wiele z tych leków jest również stosowanych w leczeniu. W miejscach, w których Plasmodium jest oporny na jeden lub więcej leków, w celach profilaktycznych często stosuje się trzy leki — meflochinę , doksycyklinę lub połączenie atowakwonu/proguanilu ( Malarone ). Doksycyklina i atowakwon/proguanil są lepiej tolerowane, podczas gdy meflochina jest przyjmowana raz w tygodniu. Obszary świata z malarią wrażliwą na chlorochinę są rzadkie. Masowe podawanie leków przeciwmalarycznych całej populacji w tym samym czasie może zmniejszyć ryzyko zarażenia malarią w populacji.
Działanie ochronne nie zaczyna się natychmiast, a osoby odwiedzające obszary, w których występuje malaria, zwykle zaczynają brać leki na tydzień lub dwa przed przybyciem i kontynuują je przez cztery tygodnie po wyjeździe (z wyjątkiem atowakwonu/proguanilu, który należy tylko rozpocząć). dwa dni przed i kontynuowane przez siedem dni później). Stosowanie leków zapobiegawczych często jest niepraktyczne dla osób mieszkających na obszarach, na których występuje malaria, a ich stosowanie jest zwykle stosowane tylko dla kobiet w ciąży i krótkoterminowych gości. Wynika to z kosztów leków, skutków ubocznych długotrwałego stosowania i trudności w uzyskaniu leków przeciwmalarycznych poza bogatymi krajami. Stwierdzono, że podczas ciąży leki zapobiegające malarii poprawiają wagę dziecka po urodzeniu i zmniejszają ryzyko niedokrwistości u matki. Stosowanie leków zapobiegawczych w przypadku występowania komarów przenoszących malarię może sprzyjać rozwojowi częściowej odporności.
Podawanie niemowlętom leków przeciwmalarycznych w ramach okresowej terapii zapobiegawczej może zmniejszyć ryzyko zakażenia malarią, hospitalizacji i anemii.
Meflochina jest skuteczniejsza niż sulfadoksyno-pirymetamina w zapobieganiu malarii u kobiet ciężarnych bez wirusa HIV. Kotrimoksazol skutecznie zapobiega zakażeniom malarią i zmniejsza ryzyko wystąpienia anemii u kobiet zakażonych wirusem HIV. Podawanie sulfadoksyny-pirymetaminy w trzech lub więcej dawkach jako przerywanej terapii zapobiegawczej jest lepsze niż dwie dawki dla kobiet zakażonych wirusem HIV żyjących na obszarach endemicznych malarii.
Szybkie leczenie potwierdzonych przypadków za pomocą terapii skojarzonych opartych na artemizynie (ACT) może również zmniejszyć transmisję.
Inni
Strategie uczestnictwa społeczności i edukacji zdrowotnej promujące świadomość malarii i znaczenie środków kontroli zostały z powodzeniem wykorzystane do zmniejszenia zachorowalności na malarię w niektórych obszarach świata rozwijającego się. Rozpoznanie choroby we wczesnym stadium może zapobiec jej śmierci. Edukacja może również informować ludzi, aby pokryli obszary stojącej, stojącej wody, takie jak zbiorniki wodne, które są idealną pożywką dla pasożytów i komarów, zmniejszając w ten sposób ryzyko przenoszenia między ludźmi. Jest to powszechnie stosowane na obszarach miejskich, gdzie na ograniczonej przestrzeni znajdują się duże skupiska ludności i na tych obszarach najprawdopodobniej nastąpiłaby transmisja. Przerywana terapia zapobiegawcza to kolejna interwencja, którą z powodzeniem stosowano w celu kontrolowania malarii u kobiet w ciąży i niemowląt oraz dzieci w wieku przedszkolnym, gdzie zarażenie ma charakter sezonowy.
Leczenie

Malarię leczy się lekami przeciwmalarycznymi ; stosowane zależą od rodzaju i ciężkości choroby. Chociaż leki przeciw gorączce są powszechnie stosowane, ich wpływ na wyniki nie jest jasny. Zapewnienie gospodarstwom domowym bezpłatnych leków przeciwmalarycznych może zmniejszyć liczbę zgonów w dzieciństwie, jeśli są odpowiednio stosowane. Programy, które przypuszczalnie leczą wszystkie przyczyny gorączki lekami przeciwmalarycznymi, mogą prowadzić do nadużywania leków przeciwmalarycznych i niedostatecznego leczenia innych przyczyn gorączki. Niemniej jednak stosowanie zestawów do szybkiej diagnostyki malarii może pomóc w ograniczeniu nadużywania leków przeciwmalarycznych.
Nieskomplikowana malaria
Prostą lub niepowikłaną malarię można leczyć lekami doustnymi. Leki artemizyniny są skuteczne i bezpieczne w leczeniu niepowikłanej malarii. Artemizynina w połączeniu z innymi lekami przeciwmalarycznymi (znanymi jako terapia skojarzona z artemizyną lub ACT) jest skuteczna w około 90%, gdy jest stosowana w leczeniu niepowikłanej malarii. Najskuteczniejszym sposobem leczenia infekcji P. falciparum jest zastosowanie ACT, który zmniejsza oporność na jakikolwiek pojedynczy składnik leku. Artemeter-lumefantryna (schemat sześciodawkowy) jest skuteczniejszy niż artemeter-lumefantryna (schemat czterodawkowy) lub inne schematy nie zawierające pochodnych artemizyniny w leczeniu malarii falciparum. Inną zalecaną kombinacją jest dihydroartemizynina i piperachina . Terapia skojarzona artemizyniną i naftochiną przyniosła obiecujące wyniki w leczeniu malarii falciparum. Jednak potrzebne są dalsze badania, aby ustalić jego skuteczność jako niezawodnego leczenia. Artesunat plus meflochina działa lepiej niż sama meflochina w leczeniu niepowikłanej malarii falciparum w warunkach niskiej transmisji. Atowakwon-proguanil jest skuteczny przeciwko nieskomplikowanym falciparum z możliwym wskaźnikiem niepowodzenia od 5% do 10%; dodanie artesunatu może zmniejszyć odsetek niepowodzeń. Monoterapia azytromycyną lub terapia skojarzona nie wykazała skuteczności w leczeniu malarii Plasmodium lub vivax. Amodiachina w połączeniu z sulfadoksyną-pirymetaminą może spowodować mniej niepowodzeń leczenia w porównaniu z samą sulfadoksyno-pirymetaminą w niepowikłanej malarii wywołanej przez falciparum. Nie ma wystarczających danych dotyczących stosowania chlorproguanilu-dapsonu w leczeniu niepowikłanej malarii wywołanej przez falciparum. Dodanie prymachiny z terapią skojarzoną opartą na artemizynie w leczeniu malarii falciparum zmniejsza jej przenoszenie w 3-4 i 8 dniu zakażenia. Sulfadoksyna-pirymetamina plus artesunat są lepsze niż sulfadoksyna-pirymetamina plus amodiachina w kontrolowaniu niepowodzenia leczenia w dniu 28. Jednak ta druga jest lepsza niż pierwsza w redukcji gametocytów we krwi w dniu 7.
Zakażenie P. vivax , P. ovale lub P. malariae zwykle nie wymaga hospitalizacji. Leczenie P. vivax wymaga zarówno leczenia stadiów krwi (chlorochiną lub ACT), jak i usuwania form wątroby prymachiną . Terapia skojarzona oparta na artemizynie jest tak samo skuteczna jak chlorochina w leczeniu niepowikłanej malarii P. vivax . Leczenie tafenochiną zapobiega nawrotom po potwierdzonej malarii wywołanej przez P. vivax . Jednak w przypadku osób leczonych chlorochiną z powodu infekcji stadium krwi wymagane jest 14 dni leczenia prymachiną, aby zapobiec nawrotom. Krótsze schematy leczenia prymachiną mogą prowadzić do wyższych wskaźników nawrotów. Nie ma różnicy w skuteczności pomiędzy prymachiną podawaną przez 7 lub 14 dni w zapobieganiu nawrotom malarii vivax. Krótszy schemat może być przydatny dla osób z problemami z przestrzeganiem zaleceń terapeutycznych.
W celu leczenia malarii podczas ciąży WHO zaleca stosowanie chininy z klindamycyną na wczesnym etapie ciąży (pierwszy trymestr) oraz ACT w późniejszych stadiach (drugi i trzeci trymestr). Dane dotyczące bezpieczeństwa stosowania leków przeciwmalarycznych w ciąży są ograniczone.
Ciężka i skomplikowana malaria
Przypadki ciężkiej i skomplikowanej malarii są prawie zawsze spowodowane zakażeniem P. falciparum . Inne gatunki zwykle powodują tylko choroby przebiegające z gorączką. Ciężkie i skomplikowane przypadki malarii są nagłymi przypadkami medycznymi, ponieważ wskaźniki śmiertelności są wysokie (10 do 50%).
Zalecanym sposobem leczenia ciężkiej malarii jest dożylne stosowanie leków przeciwmalarycznych. W przypadku ciężkiej malarii artesunat podawany pozajelitowo był lepszy od chininy zarówno u dzieci, jak iu dorosłych. W innym przeglądzie systematycznym pochodne artemizyniny (artemeter i arteether) były równie skuteczne jak chinina w leczeniu malarii mózgowej u dzieci. Leczenie ciężkiej malarii obejmuje środki wspomagające, które najlepiej wykonywać na oddziale intensywnej opieki medycznej . Obejmuje to radzenie sobie z wysoką gorączką i napadami, które mogą z niej wynikać. Obejmuje również monitorowanie słabego wysiłku oddechowego , niskiego poziomu cukru we krwi i niskiego poziomu potasu we krwi . Pochodne artemizyniny mają taką samą lub lepszą skuteczność niż chinolony w zapobieganiu zgonom w przypadku ciężkiej lub powikłanej malarii. Dawka nasycająca chininy pomaga skrócić czas trwania gorączki i zwiększa usuwanie pasożytów z organizmu. W leczeniu niepowikłanej/powikłanej malarii wywołanej przez falciparum nie ma różnicy w skuteczności chininy podawanej doodbytniczo w porównaniu z chininą dożylną lub domięśniową. Nie ma wystarczających dowodów na to, że tętnica domięśniowa może leczyć ciężką malarię. Dostarczenie artesunatu doodbytniczego przed przeniesieniem do szpitala może zmniejszyć śmiertelność dzieci z ciężką malarią.
Malaria mózgowa jest postacią ciężkiej i skomplikowanej malarii z najgorszymi objawami neurologicznymi. Nie ma wystarczających danych na temat skuteczności środków osmotycznych, takich jak mannitol lub mocznik, w leczeniu malarii mózgowej. Rutynowy fenobarbiton w malarii mózgowej wiąże się z mniejszą liczbą drgawek, ale prawdopodobnie większą liczbą zgonów. Nie ma dowodów na to, że sterydy przyniosłyby korzyści w leczeniu malarii mózgowej.
Nie ma wystarczających dowodów, aby wykazać, że transfuzja krwi jest użyteczna albo w zmniejszeniu liczby zgonów dzieci z ciężką anemią, albo w poprawie ich hematokrytu w ciągu jednego miesiąca. Nie ma wystarczających dowodów na to, że środki chelatujące żelazo, takie jak deferoksamina i deferypron, poprawiają wyniki leczenia osób zakażonych malarią falciparum.
Opór
Lekooporność stanowi coraz większy problem w leczeniu malarii w XXI wieku. W 2000 roku (dekada) w Azji Południowo-Wschodniej pojawiła się malaria z częściową opornością na artemizyny. Oporność jest obecnie powszechna wobec wszystkich klas leków przeciwmalarycznych z wyjątkiem artemizyniny . Leczenie opornych szczepów stawało się coraz bardziej zależne od tej klasy leków. Koszt artemizyniny ogranicza ich zastosowanie w krajach rozwijających się. Szczepy malarii znalezione na granicy Kambodży i Tajlandii są oporne na terapie skojarzone, które zawierają artemizyniny, i dlatego mogą być nieuleczalne. Ekspozycja populacji pasożytów na monoterapie artemizyninami w subterapeutycznych dawkach przez ponad 30 lat oraz dostępność substandardowych artemizynin prawdopodobnie wpłynęły na wybór opornego fenotypu. Oporność na artemizyninę wykryto w Kambodży, Birmie, Tajlandii i Wietnamie, a opór pojawił się w Laosie. Oporność na kombinację artemizyniny i piperachiny została po raz pierwszy wykryta w 2013 r. w Kambodży, a do 2019 r. rozprzestrzeniła się w Kambodży oraz w Laosie , Tajlandii i Wietnamie (w niektórych regionach do 80 procent pasożytów malarii jest odpornych).
Nie ma wystarczających dowodów dotyczących leków przeciwmalarycznych w opakowaniach jednostkowych w zapobieganiu niepowodzeniu leczenia infekcji malarii. Jednakże, jeśli jest wsparte szkoleniem świadczeniodawców i informowaniem pacjentów, następuje poprawa przestrzegania zaleceń przez osoby otrzymujące leczenie.
Rokowanie
Właściwie leczone osoby z malarią mogą zwykle oczekiwać całkowitego wyzdrowienia. Jednak ciężka malaria może postępować bardzo szybko i spowodować śmierć w ciągu kilku godzin lub dni. W najcięższych przypadkach choroby śmiertelność może sięgać 20%, nawet przy intensywnej opiece i leczeniu. W dłuższej perspektywie udokumentowano zaburzenia rozwojowe u dzieci, które przeszły epizody ciężkiej malarii. Przewlekłe zakażenie bez ciężkiej choroby może wystąpić w zespole niedoboru odporności związanego ze zmniejszoną odpowiedzią na bakterie Salmonella i wirus Epstein-Barr .
W dzieciństwie malaria powoduje anemię w okresie szybkiego rozwoju mózgu, a także bezpośrednie uszkodzenie mózgu wynikające z malarii mózgowej. Niektóre osoby, które przeżyły malarię mózgową, mają zwiększone ryzyko deficytów neurologicznych i poznawczych, zaburzeń behawioralnych i epilepsji . Wykazano, że profilaktyka malarii poprawia funkcje poznawcze i wyniki w szkole w badaniach klinicznych w porównaniu z grupami placebo .
Epidemiologia
Światowa Organizacja Zdrowia szacuje, że w 2019 r. odnotowano 229 milionów nowych przypadków malarii, które spowodowały 409 000 zgonów. Najbardziej dotknięte są dzieci poniżej 5 roku życia, które odpowiadają za 67% zgonów z powodu malarii na całym świecie w 2019 roku. Około 125 milionów kobiet w ciąży jest co roku zagrożonych zakażeniem; w Afryce Subsaharyjskiej malaria matek jest związana z około 200 000 zgonów niemowląt rocznie. W Europie Zachodniej występuje około 10 000 przypadków malarii rocznie, a w Stanach Zjednoczonych 1300–1500. Stany Zjednoczone wyeliminowały malarię jako główny problem zdrowia publicznego w 1951 r., chociaż utrzymują się niewielkie epidemie. Około 900 osób zmarło z powodu tej choroby w Europie w latach 1993-2003. Zarówno globalna zachorowalność na tę chorobę, jak i wynikająca z niej śmiertelność spadły w ostatnich latach. Według WHO i UNICEF liczba zgonów związanych z malarią w 2015 r. zmniejszyła się o 60% z szacowanych na 2000 r. 985 tys., głównie ze względu na powszechne stosowanie siatek nasączanych środkami owadobójczymi i terapii skojarzonych opartych na artemizynie. W 2012 roku było 207 milionów przypadków malarii. Szacuje się, że w tym roku choroba zabiła od 473 000 do 789 000 osób, z których wiele było dziećmi w Afryce. Wysiłki na rzecz zmniejszenia zachorowalności w Afryce od 2000 roku były częściowo skuteczne, a wskaźniki zachorowań spadły o około czterdzieści procent na kontynencie.
Malaria jest obecnie endemiczna w szerokim paśmie wokół równika, na obszarach obu Ameryk, wielu częściach Azji i znacznej części Afryki; w Afryce Subsaharyjskiej występuje 85–90% zgonów z powodu malarii. Według szacunków z 2009 r. krajami o najwyższym wskaźniku śmiertelności na 100 000 ludności były Wybrzeże Kości Słoniowej (86,15), Angola (56,93) i Burkina Faso (50,66). Szacunki z 2010 r. wskazują, że najbardziej zabójczymi krajami na populację były Burkina Faso, Mozambik i Mali . Projekt Atlas Malaria ma na celu zmapowanie globalnych poziomów malarii , zapewniając sposób na określenie globalnych ograniczeń przestrzennych choroby i ocenę obciążenia chorobą . Wysiłki te doprowadziły do opublikowania mapy endemizmu P. falciparum w 2010 r. i aktualizacji w 2019 r. W 2010 r. malarię endemiczną występuje w około 100 krajach. Każdego roku 125 milionów międzynarodowych podróżnych odwiedza te kraje, a ponad 30 000 zapada na tę chorobę.
Rozkład geograficzny malarii w dużych regionach jest złożony, a obszary dotknięte malarią i wolne od malarii często znajdują się blisko siebie. Malaria jest powszechna w regionach tropikalnych i subtropikalnych ze względu na opady deszczu, stałe wysokie temperatury i wysoką wilgotność, a także stojące wody, w których larwy komarów łatwo dojrzewają, zapewniając im środowisko, którego potrzebują do ciągłego rozmnażania. Na suchych obszarach epidemie malarii przewidywano z rozsądną dokładnością poprzez mapowanie opadów. Malaria występuje częściej na obszarach wiejskich niż w miastach. Na przykład kilka miast w podregionie Wielkiego Mekongu w Azji Południowo-Wschodniej jest zasadniczo wolnych od malarii, ale choroba ta występuje powszechnie w wielu regionach wiejskich, w tym wzdłuż granic międzynarodowych i obrzeży lasów. Z kolei malaria w Afryce występuje zarówno na obszarach wiejskich, jak i miejskich, choć ryzyko jest mniejsze w większych miastach.
Zmiana klimatu
Zmiana klimatu prawdopodobnie wpłynie na przenoszenie malarii, ale stopień jej wpływu i dotknięte obszary są niepewne. Większe opady deszczu na niektórych obszarach Indii oraz po El Niño wiążą się ze zwiększoną liczbą komarów.
Od 1900 r. w Afryce nastąpiły znaczne zmiany temperatury i opadów. Jednak czynniki, które wpływają na to, jak opady wpływają na wodę do rozmnażania się komarów, są złożone i obejmują na przykład stopień, w jakim jest ona wchłaniana przez glebę i roślinność, lub tempo spływu i parowania. Ostatnie badania dostarczyły bardziej dogłębnego obrazu warunków w Afryce, łącząc model przydatności klimatycznej malarii z modelem w skali kontynentalnej reprezentującym rzeczywiste procesy hydrologiczne.
Historia

Chociaż pasożyt odpowiedzialny za malarię P. falciparum istnieje od 50 000–100 000 lat, liczebność pasożyta nie wzrosła aż do około 10 000 lat temu, równolegle z postępem w rolnictwie i rozwojem osiedli ludzkich. Bliscy krewni ludzkich pasożytów malarii są powszechni u szympansów. Niektóre dowody sugerują, że malaria wywołana przez P. falciparum mogła pochodzić od goryli.
W historii można znaleźć wzmianki o wyjątkowych okresowych gorączkach malarii. Hipokrates opisał okresowe gorączki, nazywając je tertianem, kwartanem, subtertianem i codziennością. Kolumella rzymska kojarzyła chorobę z owadami bagiennymi. Malaria mogła przyczynić się do upadku Cesarstwa Rzymskiego i była tak wszechobecna w Rzymie, że była znana jako „ rzymska gorączka ”. Kilka regionów starożytnego Rzymu uznano za zagrożone chorobą ze względu na sprzyjające warunki dla wektorów malarii. Obejmowały one takie obszary, jak południowe Włochy, wyspa Sardynia , Bagna Pontyjskie , niższe regiony przybrzeżnej Etrurii i miasto Rzym wzdłuż Tybru . Obecność wody stojącej w tych miejscach była preferowana przez komary na lęgowiska. Nawadniane ogrody, tereny bagienne, spływy z rolnictwa i problemy z odwadnianiem z budowy dróg doprowadziły do wzrostu stojącej wody.

Termin malaria pochodzi ze średniowiecznego włoskiego : mala aria — „ złe powietrze ”; choroba była dawniej nazywana gorączką agową lub bagienną ze względu na jej związek z bagnami i mokradłami. Termin ten pojawił się po raz pierwszy w literaturze angielskiej około 1829 roku. Malaria była kiedyś powszechna w większości krajów Europy i Ameryki Północnej, gdzie nie jest już endemiczna, chociaż zdarzają się przypadki importowane.
Malaria nie jest wymieniona w „księgach medycznych” Majów czy Azteków . Europejscy osadnicy i zniewoleni przez nich mieszkańcy Afryki Zachodniej prawdopodobnie przynieśli malarię do obu Ameryk począwszy od XVI wieku.
Badania naukowe nad malarią poczyniły pierwszy znaczący postęp w 1880 roku, kiedy Charles Louis Alphonse Laveran – francuski lekarz wojskowy pracujący w szpitalu wojskowym Konstantyna w Algierii – po raz pierwszy zaobserwował pasożyty w czerwonych krwinkach zakażonych ludzi. Dlatego też zaproponował, że malaria jest powodowana przez ten organizm, po raz pierwszy zidentyfikowano protisty jako powodującego chorobę. Za to i późniejsze odkrycia otrzymał w 1907 roku Nagrodę Nobla w dziedzinie fizjologii lub medycyny . Rok później Carlos Finlay , kubański lekarz leczący ludzi z żółtą febrą w Hawanie , dostarczył mocnych dowodów na to, że komary przenoszą choroby na i od ludzi. Praca ta podążała za wcześniejszymi sugestiami Josiaha C. Notta i Sir Patricka Mansona , „ojca medycyny tropikalnej”, na temat przenoszenia filariozy .

W kwietniu 1894 roku szkocki lekarz Sir Ronald Ross odwiedził Sir Patricka Mansona w jego domu przy Queen Anne Street w Londynie. Wizyta ta była początkiem czterech lat współpracy i żarliwych badań, których kulminacją był rok 1897, kiedy Ross, który pracował w Szpitalu Prezydenckim w Kalkucie , udowodnił pełny cykl życia pasożyta malarii u komarów. W ten sposób udowodnił, że komar był wektorem malarii u ludzi, pokazując, że niektóre gatunki komarów przenoszą malarię na ptaki. Wyizolował pasożyty malarii z gruczołów ślinowych komarów, które żywiły się zarażonymi ptakami. Za tę pracę Ross otrzymał w 1902 roku Nagrodę Nobla w dziedzinie medycyny. Po rezygnacji z indyjskiej służby medycznej Ross pracował w nowo utworzonej Szkole Medycyny Tropikalnej w Liverpoolu i kierował działaniami na rzecz kontroli malarii w Egipcie , Panamie , Grecji i na Mauritiusie . Odkrycia Finlaya i Rossa zostały później potwierdzone przez komisję lekarską kierowaną przez Waltera Reeda w 1900 roku. Jej zalecenia zostały wdrożone przez Williama C. Gorgasa w działaniach zdrowotnych podjętych podczas budowy Kanału Panamskiego . Ta praca w zakresie zdrowia publicznego uratowała życie tysiącom pracowników i pomogła w opracowaniu metod stosowanych w przyszłych kampaniach zdrowia publicznego przeciwko tej chorobie.
W 1896 roku Amico Bignami omówił rolę komarów w malarii. W 1898 Bignami, Giovanni Battista Grassi i Giuseppe Bastianelli zdołali eksperymentalnie wykazać przenoszenie malarii u ludzi, używając zarażonych komarów do zarażenia się malarią, które przedstawili w listopadzie 1898 Accademia dei Lincei .

Pierwsze skuteczne lekarstwo na malarię pochodziło z kory drzewa chinowego , która zawiera chininę . Drzewo to rośnie na zboczach Andów , głównie w Peru . Do rdzennych ludów Peru popełnił nalewki z kory chinowej gorączki sterowania. Stwierdzono jego skuteczność w walce z malarią i około 1640 roku jezuici wprowadzili leczenie do Europy; do 1677 roku został włączony do Farmakopei Londyńskiej jako lek przeciwmalaryczny. Dopiero w 1820 roku aktywny składnik, chinina, został wyekstrahowany z kory, wyizolowany i nazwany przez francuskich chemików Pierre'a Josepha Pelletiera i Josepha Bienaimé Caventou .
Chinina była dominującym lekiem przeciw malarii do lat dwudziestych, kiedy zaczęły pojawiać się inne leki. W latach czterdziestych chlorochina zastąpiła chininę w leczeniu zarówno nieskomplikowanej, jak i ciężkiej malarii, dopóki nie pojawiła się odporność, najpierw w Azji Południowo-Wschodniej i Ameryce Południowej w latach pięćdziesiątych, a następnie na całym świecie w latach osiemdziesiątych.
Lecznicza wartość Artemisia annua jest wykorzystywana przez chińskich zielarzy w tradycyjnych chińskich lekach od 2000 lat. W 1596 roku Li Shizhen w swoim „ Kompendium Materii Medica ” zalecił herbatę z qinghao specjalnie do leczenia objawów malarii . Artemizyniny, odkryte przez chińskiego naukowca Tu Youyou i jego współpracowników w latach 70. z rośliny Artemisia annua , stały się zalecanym lekiem na malarię P. falciparum , podawanym w ciężkich przypadkach w połączeniu z innymi lekami przeciwmalarycznymi. Tu mówi, że była pod wpływem tradycyjnego chińskiego źródła medycyny ziołowego , The Handbook of Prescriptions for Emergency Treatments , napisanego w 340 przez Ge Honga . Za swoją pracę nad malarią Tu Youyou otrzymała Nagrodę Nobla 2015 w dziedzinie fizjologii lub medycyny .
Plasmodium vivax stosowano w latach 1917-1940 w malarioterapii – celowym wstrzykiwaniu pasożytów malarii w celu wywołania gorączki w celu zwalczania niektórych chorób, takich jak kiła trzeciorzędowa . W 1927 roku wynalazca tej techniki, Julius Wagner-Jauregg , otrzymał za swoje odkrycia Nagrodę Nobla w dziedzinie fizjologii lub medycyny. Technika była niebezpieczna, zabijając około 15% pacjentów, więc nie jest już używana.

Pierwszym pestycydem stosowanym do opryskiwania pozostałości w pomieszczeniach był DDT . Chociaż początkowo był używany wyłącznie do zwalczania malarii, jego zastosowanie szybko rozprzestrzeniło się na rolnictwo . Z czasem w stosowaniu DDT dominowało zwalczanie szkodników, a nie zwalczanie chorób, a to rolnictwo na dużą skalę doprowadziło do ewolucji komarów odpornych na pestycydy w wielu regionach. Oporność na DDT wykazywaną przez komary Anopheles można porównać z opornością na antybiotyki wykazywaną przez bakterie. W latach sześćdziesiątych wzrosła świadomość negatywnych konsekwencji jego masowego używania, co ostatecznie doprowadziło do zakazów stosowania DDT w rolnictwie w wielu krajach w latach siedemdziesiątych. Przed DDT malaria była skutecznie eliminowana lub kontrolowana w obszarach tropikalnych, takich jak Brazylia i Egipt, poprzez usuwanie lub zatruwanie terenów lęgowych komarów lub siedlisk wodnych stadiów larwalnych, na przykład poprzez stosowanie wysoce toksycznego związku arsenu Paris Green w miejscach stojących woda.
Szczepionki na malarię były nieuchwytnym celem badań. Pierwsze obiecujące badania wykazujące potencjał szczepionki przeciw malarii przeprowadzono w 1967 r. poprzez immunizację myszy żywymi, atenuowanymi sporozoitami, które zapewniały znaczną ochronę myszom po wstrzyknięciu normalnych, żywotnych sporozoitów. Od lat 70. podejmowano znaczne wysiłki w celu opracowania podobnych strategii szczepień dla ludzi. Pierwsza szczepionka o nazwie RTS,S została zatwierdzona przez europejskie organy regulacyjne w 2015 roku.
Społeczeństwo i kultura
Wpływ ekonomiczny
Malaria to nie tylko choroba powszechnie kojarzona z ubóstwem : niektóre dowody sugerują, że jest ona również przyczyną ubóstwa i główną przeszkodą w rozwoju gospodarczym . Chociaż najbardziej dotknięte są regiony tropikalne , najdalszy wpływ malarii dociera do niektórych stref umiarkowanych, w których występują ekstremalne zmiany sezonowe. Chorobie powiązano z poważnymi negatywnymi skutkami gospodarczymi w regionach, w których jest szeroko rozpowszechniona. Pod koniec XIX i na początku XX wieku był głównym czynnikiem powolnego rozwoju gospodarczego amerykańskich stanów południowych.
Porównanie średniego PKB na mieszkańca w 1995 r., skorygowanego o parytet siły nabywczej , między krajami z malarią i krajami bez malarii daje pięciokrotną różnicę (1526 USD w porównaniu z 8268 USD). W latach 1965-1990, kraje, w których malaria była powszechna, miały średni PKB na mieszkańca, który wzrastał tylko o 0,4% rocznie, w porównaniu do 2,4% rocznie w innych krajach.
Ubóstwo może zwiększać ryzyko malarii, ponieważ osoby ubogie nie mają możliwości finansowych, aby zapobiegać tej chorobie lub ją leczyć. Ocenia się, że w całości ekonomiczny wpływ malarii kosztuje Afrykę 12 miliardów dolarów rocznie. Skutki ekonomiczne obejmują koszty opieki zdrowotnej, dni pracy stracone z powodu choroby, dni stracone na edukację, zmniejszoną produktywność z powodu uszkodzenia mózgu spowodowanego malarią mózgową oraz utratę inwestycji i turystyki. Choroba jest bardzo obciążona w niektórych krajach, gdzie może odpowiadać za 30–50% przyjęć do szpitala, do 50% wizyt ambulatoryjnych i do 40% wydatków na zdrowie publiczne.

Malaria mózgowa jest jedną z głównych przyczyn zaburzeń neurologicznych u dzieci afrykańskich. Badania porównujące funkcje poznawcze przed i po leczeniu ciężkiej choroby malarii nadal wykazywały znacznie upośledzone wyniki w szkole i zdolności poznawcze, nawet po wyzdrowieniu. W konsekwencji, ciężka i mózgowa malaria ma daleko idące konsekwencje społeczno - ekonomiczne, które wykraczają poza bezpośrednie skutki choroby.
Podrabiane i niespełniające norm leki
Wyrafinowane podróbki zostały znalezione w kilku krajach azjatyckich, takich jak Kambodża , Chiny , Indonezja , Laos , Tajlandia i Wietnam i są główną przyczyną zgonów, których można by uniknąć w tych krajach. WHO stwierdziła, że badania wskazują, że do 40% leków przeciw malarii opartych na artesunacie jest podrobionych, zwłaszcza w regionie Wielkiego Mekongu . Ustanowili system szybkiego ostrzegania, aby szybko zgłaszać informacje o podrabianych lekach odpowiednim władzom w krajach uczestniczących. Lekarze i laicy nie mają niezawodnego sposobu na wykrycie podrabianych leków bez pomocy laboratorium. Firmy próbują walczyć z uporczywością podrabianych leków, wykorzystując nowe technologie, aby zapewnić bezpieczeństwo od źródła do dystrybucji.
Innym problemem klinicznym i zdrowia publicznego jest proliferacja leków przeciwmalarycznych niespełniających norm, wynikająca z niewłaściwego stężenia składników, zanieczyszczenia innymi lekami lub toksycznymi zanieczyszczeniami, złej jakości składników, słabej stabilności i nieodpowiedniego opakowania. Badanie z 2012 r. wykazało, że około jedna trzecia leków przeciwmalarycznych w Azji Południowo-Wschodniej i Afryce Subsaharyjskiej nie przeszła analizy chemicznej, analizy opakowań lub została sfałszowana.
Wojna
Na przestrzeni dziejów kurczenie się malarii odgrywało znaczącą rolę w losach rządzących, państw narodowych, personelu wojskowego i działań wojskowych. W 1910 roku zdobywca Nagrody Nobla w dziedzinie medycyny Ronald Ross (sam przeżył malarię) opublikował książkę zatytułowaną „Zapobieganie malarii”, która zawierała rozdział zatytułowany „Zapobieganie malarii podczas wojny”. Autor rozdziału, pułkownik CH Melville, profesor higieny w Royal Army Medical College w Londynie, odniósł się do znaczącej roli, jaką malaria odgrywała w historii podczas wojen: „Historia malarii podczas wojny może być niemal traktowana jako historia samej wojny, na pewno historia wojen w epoce chrześcijańskiej... Prawdopodobnie jest tak, że wiele tak zwanych gorączek obozowych, a prawdopodobnie także znaczna część dyzenterii obozowej, wojen XVI, XVII i XVIII wieku miały pochodzenie malaryczne”. W okupowanych przez Brytyjczyków Indiach koktajl gin z tonikiem mógł być sposobem przyjmowania chininy, znanej ze swoich właściwości przeciwmalarycznych.
Malaria była najpoważniejszym zagrożeniem dla zdrowia, na jakie napotkały wojska amerykańskie na południowym Pacyfiku podczas II wojny światowej , gdzie zarażonych zostało około 500 000 mężczyzn. Według Josepha Patricka Byrne'a „60 tysięcy amerykańskich żołnierzy zmarło na malarię podczas kampanii w Afryce i na Południowym Pacyfiku”.
Poczyniono znaczne inwestycje finansowe, aby pozyskać istniejące i stworzyć nowe środki przeciwmalaryczne. Podczas I i II wojny światowej niespójne dostawy naturalnych leków przeciwmalarycznych, kory chinowca i chininy, skłoniły do znacznego finansowania badań i rozwoju innych leków i szczepionek. Amerykańskie organizacje wojskowe prowadzące takie inicjatywy badawcze obejmują Centrum Badań Medycznych Marynarki Wojennej, Instytut Badawczy Armii im. Waltera Reeda oraz Instytut Chorób Zakaźnych Armii Amerykańskiej Sił Zbrojnych USA.
Dodatkowo powstały inicjatywy, takie jak Malaria Control in War Areas (MCWA), założona w 1942 roku i jego następca, Communicable Disease Center (obecnie znane jako Centers for Disease Control and Prevention , lub CDC) założone w 1946 roku. CDC, MCWA „została założona w celu kontrolowania malarii wokół wojskowych baz szkoleniowych w południowych Stanach Zjednoczonych i na ich terytoriach, gdzie malaria była nadal problematyczna”.
Wysiłki na rzecz zwalczania
Podejmowanych jest kilka godnych uwagi prób wyeliminowania pasożyta z części świata lub wytępienia go na całym świecie . W 2006 r. organizacja Malaria No More wyznaczyła publiczny cel wyeliminowania malarii z Afryki do 2015 r., a organizacja twierdziła, że planuje się rozwiązać, jeśli ten cel zostanie osiągnięty. W 2007 roku na 60. sesji Światowego Zgromadzenia Zdrowia ustanowiono Światowy Dzień Malaria . Od 2018 roku nadal funkcjonują. Tylko jedna szczepionka przeciw malarii jest dopuszczona do stosowania, podczas gdy kilka innych znajduje się w badaniach klinicznych, które mają zapewnić ochronę dzieciom na terenach endemicznych i zmniejszyć szybkość przenoszenia choroby. Do 2012 r . Światowy Fundusz na rzecz Walki z AIDS, Gruźlicą i Malarią rozdał 230 milionów moskitier nasączanych środkami owadobójczymi, które miały powstrzymać przenoszenie malarii przez komary. Fundacja Clintona z siedzibą w USA pracowała nad zarządzaniem popytem i stabilizacją cen na rynku artemisinin. Inne wysiłki, takie jak Malaria Atlas Project, koncentrują się na analizie informacji o klimacie i pogodzie wymaganych do dokładnego przewidywania rozprzestrzeniania się malarii w oparciu o dostępność siedlisk pasożytów przenoszących malarię. Komitet Doradczy Polityki Malaria (MPAC) od Światowej Organizacji Zdrowia (WHO) została utworzona w 2012 roku, „zapewnienie doradztwa strategicznego i wejście techniczne WHO na temat wszystkich aspektów kontroli malarii i eliminacji”. W listopadzie 2013 r. WHO i grupa fundatorów szczepionek przeciw malarii wyznaczyły sobie cel opracowania szczepionek mających na celu przerwanie transmisji malarii, co jest długoterminowym celem eradykacji malarii.
Malaria została z powodzeniem wyeliminowana lub znacznie zmniejszona w niektórych obszarach. Malaria była kiedyś powszechna w Stanach Zjednoczonych i południowej Europie, ale programy kontroli wektorów w połączeniu z monitorowaniem i leczeniem zakażonych ludzi wyeliminowały ją z tych regionów. Przyczyniło się do tego kilka czynników, takich jak osuszanie terenów podmokłych na potrzeby rolnictwa i inne zmiany w praktykach gospodarki wodnej oraz postępy w zakresie warunków sanitarnych, w tym większe wykorzystanie szklanych okien i ekranów w mieszkaniach. Malaria została wyeliminowana z większości części Stanów Zjednoczonych na początku XX wieku takimi metodami. Użycie pestycydu DDT i innych środków wyeliminowało go z pozostałych kieszeni Południa w latach pięćdziesiątych w ramach Narodowego Programu Zwalczania Malaria .
Jednym z celów Cel 3 z ONZ „s celów zrównoważonego rozwoju ma się zakończyć epidemię malarii we wszystkich krajach w 2030 r.
W 2015 roku WHO dążyła do zmniejszenia o 90% liczby zgonów z powodu malarii do 2030 roku, a Bill Gates powiedział w 2016 roku, że uważa, że globalna eradykacja będzie możliwa do 2040 roku.
W 2018 r. WHO ogłosiła, że Paragwaj jest wolny od malarii, po wysiłkach na rzecz wykorzenienia, które rozpoczęły się w 1950 r.
W 2000 roku Narody Zjednoczone rozpoczęły program „zwalczania malarii” i wyznaczyły jeden z kluczowych celów Milenijnych Celów Rozwoju. Prowadzono go w zasadzie w celu zapobiegania śmierci i chorobom dzieci poniżej 5 roku życia. Przed 2016 r. Światowy Fundusz na rzecz walki z HIV/AIDS, Gruźlicą i Malarią dostarczył 659 milionów ITN (moskitier na łóżka nasączone środkiem owadobójczym), zorganizował wsparcie i edukację, aby zapobiegać malarii. Wyzwania są wysokie ze względu na brak funduszy, delikatną strukturę zdrowia i odległą ludność tubylczą, do której trudno jest dotrzeć i wykształcić. Większość rdzennej populacji polega na samodiagnozie, samoleczeniu, uzdrowicielu i medycynie tradycyjnej. WHO wystąpiła o fundusze do Fundacji Gatesa, która wspiera działania na rzecz zwalczania malarii w 2007 roku. Sześć krajów Zjednoczone Emiraty Arabskie, Maroko, Armenia, Turkmenistan, Kirgistan i Sri Lanka nie odnotowały żadnych przypadków zachorowań na rodzimą malarię przez trzy kolejne lata i potwierdzona przez WHO wolna od malarii pomimo stagnacji finansowania w 2010 r. Fundusze są niezbędne do sfinansowania kosztów leków i hospitalizacji nie mogą być wspierane przez biedne kraje, w których choroba jest szeroko rozpowszechniona. Cel eradykacji nie został osiągnięty, niemniej jednak tempo spadku choroby jest znaczne.
Od 2019 r. proces zwalczania trwa, ale przy obecnych metodach i narzędziach trudno będzie osiągnąć świat wolny od malarii. Podejścia mogą wymagać większych inwestycji w badania i większej powszechnej opieki zdrowotnej. Ciągły nadzór będzie również ważny, aby zapobiec nawrotowi malarii w krajach, w których choroba została wyeliminowana.
Badania
Inicjatywa programu badań nad malarią (malERA) była procesem konsultacyjnym mającym na celu określenie, które obszary badań i rozwoju (B+R) należy uwzględnić w celu wyeliminowania malarii na całym świecie.
Szczepionka
Szczepionka przeciwko malarii o nazwie RTS,S/AS01 (RTS,S) została zatwierdzona przez europejskie organy regulacyjne w 2015 r. Od 2019 r. przechodzi testy pilotażowe w 3 krajach Afryki Subsaharyjskiej – Ghanie, Kenii i Malawi – w ramach WHO Program wdrażania szczepionek przeciw malarii (MVIP).
Odporność (a dokładniej tolerancja ) na malarię P. falciparum występuje naturalnie, ale tylko w odpowiedzi na lata powtarzających się infekcji. Jednostka może być chroniony z P. falciparum infekcji jeśli otrzyma około tysiąca ukąszenia komarów przenoszących wersji pasożyta pozbawionej aplikuje się dawki promieniowania rentgenowskiego napromieniowania . Wysoce polimorficzny charakter wielu białek P. falciparum wiąże się ze znacznymi wyzwaniami w projektowaniu szczepionek. Kandydaci do szczepień, których celem są antygeny na gametach, zygotach lub okinetach w jelicie środkowym komara, mają na celu zablokowanie przenoszenia malarii. Te szczepionki blokujące transmisję indukują przeciwciała w ludzkiej krwi; kiedy komar pobiera mączkę z krwi chronionej osoby, przeciwciała te zapobiegają zakończeniu rozwoju pasożyta u komara. Inne kandydatki na szczepionki, ukierunkowane na etap cyklu życiowego pasożyta, same w sobie były niewystarczające. Na przykład SPf66 był szeroko testowany na obszarach, gdzie choroba była powszechna w latach 90., ale badania wykazały, że jest niewystarczająco skuteczny.
W 2021 r. naukowcy z Uniwersytetu Oksfordzkiego poinformowali o wynikach badania fazy IIb potencjalnej szczepionki przeciw malarii, R21/Matrix-M, która wykazała skuteczność na poziomie 77% w ciągu 12 miesięcy obserwacji. Ta szczepionka jest pierwszą, która spełnia cel Mapy drogowej technologii szczepionek przeciw malarii Światowej Organizacji Zdrowia dotyczący szczepionki o skuteczności co najmniej 75%.
Leki
Pasożyty malarii zawierają apikoplasty , organelle zwykle występujące w roślinach, wraz z własnymi genomami . Uważa się , że te apikoplasty powstały w wyniku endosymbiozy alg i odgrywają kluczową rolę w różnych aspektach metabolizmu pasożytów , takich jak biosynteza kwasów tłuszczowych . Odkryto, że apikoplasty wytwarzają ponad 400 białek, które są obecnie badane jako możliwe cele dla nowych leków przeciwmalarycznych.
Wraz z pojawieniem się lekoopornych pasożytów Plasmodium , opracowywane są nowe strategie zwalczania szeroko rozpowszechnionej choroby. Jedno podejście takie leży we wstępie z syntetycznych pirydoksalu aminokwasu adduktów , które są pobierane przez pasożyta i ostatecznie zakłócić jego zdolność do tworzenia kilka istotnych witamin B . Zainteresowanie badawcze budzą leki przeciwmalaryczne wykorzystujące syntetyczne kompleksy oparte na metalach .
- (+)-SJ733: Część szerszej klasy leków eksperymentalnych zwanych spiroindolonem . Hamuje białko ATP4 zakażonych czerwonych krwinek, które powodują kurczenie się i sztywność komórek, podobnie jak starzejące się komórki. Powoduje to, że układ odpornościowy eliminuje zainfekowane komórki z systemu, jak pokazano na modelu mysim. Od 2014 r . Instytut Medyczny Howarda Hughesa planuje badanie kliniczne fazy 1 mające na celu ocenę profilu bezpieczeństwa u ludzi .
- NITD246 i NITD609 : Należały również do klasy spiroindolonu i celują w białko ATP4.
Na podstawie wyników dokowania molekularnego związki 3j, 4b, 4h, 4m wykazały selektywność względem PfLDH. Analiza po dokowaniu wykazała stabilne zachowanie dynamiczne wszystkich wybranych związków w porównaniu z Chlorochiną. Analiza termodynamiki stanu końcowego wykazała związek 3j jako selektywny i silny inhibitor PfLDH.
Nowe cele
Kierowanie Plasmodium pasożyty wątroby etap selektywnego staje się alternatywną strategię w obliczu odporności na najnowsze terapii skojarzonych przeciwko szeregowi etapów krwi pasożyta.
W badaniu przeprowadzonym w 2019 roku, wykorzystując analizę eksperymentalną z mutantami knockout (KO) Plasmodium berguei, autorzy byli w stanie zidentyfikować geny, które są potencjalnie niezbędne w stadium wątroby. Ponadto stworzyli model obliczeniowy do analizy rozwoju przederytrocytów i metabolizmu w wątrobie. Łącząc obie metody, zidentyfikowali siedem podsystemów metabolicznych, które stają się niezbędne w porównaniu ze stadium krwi. Niektóre z tych szlaków metabolicznych to między innymi synteza i wydłużanie kwasów tłuszczowych, metabolizm kwasów trikarboksylowych, aminokwasów i hemu.
W szczególności zbadali 3 podsystemy: syntezę i elongację kwasów tłuszczowych oraz biosyntezę aminokwasów cukrów. W przypadku pierwszych dwóch szlaków wykazali wyraźną zależność stadium wątroby od jej własnego metabolizmu kwasów tłuszczowych.
Udowodnili po raz pierwszy krytyczną rolę biosyntezy aminokwasów cukrów w stadium wątrobowym P. berghei . Wychwyt N–acetylo-glukozaminy wydaje się być ograniczony w stadium wątrobowym, jako jej synteza potrzebna do rozwoju pasożyta.
Te odkrycia oraz model obliczeniowy stanowią podstawę do projektowania terapii przeciwmalarycznych ukierunkowanych na białka metaboliczne.
Inne
Niechemiczna strategia kontroli wektora obejmuje manipulację genetyczną komarów wywołujących malarię. Postępy w technologiach inżynierii genetycznej umożliwiają wprowadzenie obcego DNA do genomu komara i albo skrócenie życia komara, albo uczynienie go bardziej odpornym na pasożyta malarii. Technika sterylnych owadów to metoda kontroli genetycznej, dzięki której duża liczba sterylnych samców komarów jest hodowana i uwalniana. Kojarzenie się z dzikimi samicami zmniejsza dziką populację w kolejnym pokoleniu; powtarzające się wydania ostatecznie eliminują populację docelową.
Genomika ma kluczowe znaczenie dla badań nad malarią. Dzięki sekwencjonowaniu z P. falciparum , jeden z jego wektorów Anopheles gambiae , a ludzkiego genomu , genetyki wszystkich trzech organizmów w cyklu malarii może być badana. Innym nowym zastosowaniem technologii genetycznej jest możliwość produkcji genetycznie zmodyfikowanych komarów, które nie przenoszą malarii, co potencjalnie umożliwia biologiczną kontrolę przenoszenia malarii.
W jednym z badań stworzono genetycznie zmodyfikowany szczep Anopheles stephensi, który nie wspierał już przenoszenia malarii, a odporność ta została przekazana potomstwu komarów.
Napęd genowy to technika zmiany dzikich populacji, na przykład w celu zwalczania lub eliminacji owadów, aby nie mogły przenosić chorób (w szczególności komarów w przypadku malarii, zika , dengi i żółtej febry).
W grudniu 2020 r. artykuł przeglądowy wykazał, że regiony endemiczne malarii miały średnio niższy zgłoszony wskaźnik śmiertelności z powodu COVID-19 niż regiony, w których malaria nie była endemiczna.
Inne zwierzęta
Chociaż nie ma rezerwuarów zwierzęcych dla szczepów malarii wywołujących infekcje u ludzi, zidentyfikowano prawie 200 pasożytniczych gatunków Plasmodium, które zarażają ptaki , gady i inne ssaki , a około 30 gatunków naturalnie zakaża naczelne inne niż człowiek. Niektóre pasożyty malarii, które atakują naczelne inne niż człowiek (NHP), służą jako organizmy modelowe dla ludzkich pasożytów malarii, takie jak P. coatneyi (model P. falciparum ) i P. cynomolgi ( P. vivax ). Techniki diagnostyczne stosowane do wykrywania pasożytów w NHP są podobne do tych stosowanych u ludzi. Pasożyty malarii, które zarażają gryzonie, są powszechnie wykorzystywane jako modele w badaniach, takie jak P. berghei . Malaria ptasia dotyka przede wszystkim gatunki z rzędu Passeriformes i stanowi poważne zagrożenie dla ptaków Hawajów , Galapagos i innych archipelagów . Wiadomo, że pasożyt P. relictum odgrywa rolę w ograniczaniu rozmieszczenia i liczebności endemicznych ptaków hawajskich . Oczekuje się, że globalne ocieplenie zwiększy częstość występowania i globalną dystrybucję ptasiej malarii , ponieważ podwyższone temperatury zapewniają optymalne warunki do rozmnażania się pasożytów.
Bibliografia
Cytaty
Źródła
- WHO (2010). Wytyczne dotyczące leczenia malarii (PDF) (raport) (2nd ed.). Światowa Organizacja Zdrowia. Numer ISBN 978-92-4-154792-5.
- Schlagenhauf-Lawlor P (2008). Malaria podróżnych . PMPH-USA. Numer ISBN 978-1-55009-336-0.
Dalsza lektura
- de Kruif P (1926). „X Ross vs Grassi: Malaria”. Łowcy mikrobów . Książki z niebieską wstążką. Nowy Jork: Harcourt Brace & Company Inc. str. 208-310 . Źródło 14 października 2020 .
- Bynum WF , Overy C, wyd. (1998). Bestia w komara: korespondencja Ronalda Rossa i Patricka Mansona . Wellcome Institute Series w historii medycyny. Rodopi. Numer ISBN 978-90-420-0721-5.
- Wytyczne dotyczące leczenia malarii (3rd ed.). Światowa Organizacja Zdrowia. 2015. Numer ISBN 978-92-4-154912-7.
- Jarvis B (29 lipca 2019). „Jak komary wszystko zmieniły” . Źródło 8 sierpnia 2019 .
-
„Dokręcanie uchwytu na malarię” . Metody natury (redakcja). 16 (4): 271. 28 marca 2019 r. doi : 10.1038/s41592-019-0390-2 . PMID 30923375 .
Dzień poświęcony podnoszeniu świadomości choroby to dobra okazja, aby zapytać, jak daleko zaszły badania nad malarią i jakie metody są potrzebne do dalszych odkryć.
Zewnętrzne linki
- Malaria w Curlie
- Strona WHO na temat malarii
- Strona UNHCO dotycząca malarii
- Globalny Plan Działania na Malarię (2008)
- Lekarze bez Granic/Lekarze bez Granic – strony informacyjne dotyczące malarii
- Baza danych WHO/TDR malarii za pośrednictwem Wayback Machine
- Antymalaria i zrównoważony rozwój
- Ogólnoświatowa Sieć Oporności Przeciwmalarycznej (WWARN)
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |