Mikrotom - Microtome
Mikrotomu (od greckiego MIKROS , czyli „mały” i temnein , oznacza „cut”) jest narzędzie skrawające stosuje się do wytwarzania bardzo cienkich plasterków materiału znanego jako części . Istotne w nauce mikrotomy znajdują zastosowanie w mikroskopii , pozwalając na przygotowanie próbek do obserwacji w świetle przechodzącym lub promieniowaniu elektronowym .
Mikrotomy wykorzystują ostrza stalowe , szklane lub diamentowe w zależności od krojonej próbki i pożądanej grubości ciętych skrawków. Ostrza stalowe służą do przygotowania skrawków histologicznych tkanek zwierzęcych lub roślinnych do mikroskopii świetlnej . Noże szklane są używane do krojenia skrawków do mikroskopii świetlnej oraz do krojenia bardzo cienkich skrawków do mikroskopii elektronowej . Noże diamentowe klasy przemysłowej są używane do krojenia twardych materiałów, takich jak kości , zęby i twarda materia roślinna, zarówno w mikroskopii świetlnej, jak i elektronowej. Diamentowe noże jakości Gem są również używane do krojenia cienkich skrawków do mikroskopii elektronowej .
Mikrotomia to metoda przygotowania cienkich przekrojów z materiałów takich jak kości, minerały i zęby oraz alternatywa dla elektropolerowania i frezowania jonowego . Skrawki mikrotomu mogą być wystarczająco cienkie, aby przeciąć ludzki włos na całej jego szerokości, przy grubości przekroju od 50 nm do 100 μm .
Historia
W początkach rozwoju mikroskopu świetlnego skrawki roślin i zwierząt przygotowywano ręcznie za pomocą żyletek. Stwierdzono, że dla obserwacji struktury obserwowanej próbki ważne jest wykonanie czystych, powtarzalnych nacięć rzędu 100 μm, przez które może przepuszczać się światło. Pozwoliło to na obserwację próbek za pomocą mikroskopów świetlnych w trybie transmisyjnym.
Jedno z pierwszych urządzeń do przygotowania takich cięć zostało wynalezione w 1770 roku przez George'a Adamsa Jr. (1750-1795), a następnie rozwinięte przez Aleksandra Cummingsa . Urządzenie było obsługiwane ręcznie, a próbkę trzymano w cylindrze, a sekcje utworzono z góry próbki za pomocą ręcznej korby.
W 1835 roku Andrew Prichard opracował model oparty na stole, który pozwolił na izolację wibracji poprzez przymocowanie urządzenia do stołu, oddzielając operatora od noża.
Od czasu do czasu przypisuje się wynalezienie mikrotomu anatom Wilhelm His, senior (1865). W swoim Beschreibung eines Mikrotoms (niem. Opis mikrotomu ) Wilhelm pisał:
Aparat umożliwił precyzję w pracy, dzięki której mogę uzyskać przekroje, których nie da się wykonać ręcznie. Mianowicie umożliwiło to uzyskanie w trakcie badań nieprzerwanych przekrojów obiektów.
Inne źródła przypisują rozwój czeskiemu fizjologowi Janowi Evangelista Purkyně . Kilka źródeł opisuje model Purkyne'a jako pierwszy w praktycznym zastosowaniu.
Niejasności w pochodzeniu mikrotomu wynikają z faktu, że pierwsze mikrotomy były po prostu przyrządami tnącymi, a faza rozwojowa wczesnych urządzeń jest szeroko nieudokumentowana.
Pod koniec XIX wieku opracowanie bardzo cienkich i konsekwentnie cienkich próbek metodą mikrotomii wraz z selektywnym barwieniem ważnych składników komórkowych lub cząsteczek umożliwiło wizualizację szczegółów mikroskopu.
Obecnie większość mikrotomów to konstrukcja blokowa noża z wymiennym nożem, uchwytem na próbki i mechanizmem przesuwania. W większości urządzeń cięcie próbki rozpoczyna się od przesunięcia próbki po nożu, gdzie mechanizm posuwu automatycznie przesuwa się do przodu tak, że można wykonać kolejne cięcie na wybraną grubość. Grubość cięcia regulowana jest za pomocą mechanizmu regulacyjnego, co pozwala na precyzyjną kontrolę.
Aplikacje
Najczęstsze zastosowania mikrotomów to:
- Tradycyjna technika histologiczna : tkanki są utrwalane, odwadniane, oczyszczane i zatapiane w roztopionej parafinie , która po schłodzeniu tworzy stały blok. Następnie tkankę tnie się w mikrotomie o grubości od 2 do 50 μm. Stamtąd tkankę można umieścić na szkiełku mikroskopowym, wybarwić odpowiednim wodnym barwnikiem po usunięciu parafiny i zbadać pod mikroskopem świetlnym.
- Procedura cięcia zamrożonego : tkanki bogate w wodę są utwardzane przez zamrażanie i cięte w stanie zamrożonym za pomocą mrożącego mikrotomu lub mikrotomo- kriostatyki ; skrawki są barwione i badane pod mikroskopem świetlnym. Ta technika jest znacznie szybsza niż tradycyjna histologia (5 minut vs 16 godzin) i jest stosowana w połączeniu z procedurami medycznymi w celu uzyskania szybkiej diagnozy. Kriosekcje mogą być również stosowane w immunohistochemii, ponieważ zamrażanie tkanki szybciej zatrzymuje degradację tkanki niż użycie utrwalacza i nie zmienia ani nie maskuje tak bardzo jej składu chemicznego.
- Technika mikroskopii elektronowej : po osadzeniu tkanek w żywicy epoksydowej, mikrotom wyposażony w nóż diamentowy ze szkła lub kamieni szlachetnych jest używany do cięcia bardzo cienkich skrawków (zwykle 60 do 100 nanometrów). Skrawki barwione są wodnym roztworem odpowiedniej soli metalu ciężkiego i badane pod transmisyjnym mikroskopem elektronowym . Instrument ten jest często nazywany ultramikrotomem . Ultramikrotom jest również używany z nożem szklanym lub nożem diamentowym klasy przemysłowej do cięcia przekrojów pomiarowych przed cięciem cienkim. Te przekroje badawcze mają zazwyczaj grubość od 0,5 do 1 μm i są montowane na szkiełku podstawowym i barwione w celu zlokalizowania interesujących obszarów pod mikroskopem świetlnym przed wykonaniem cienkich przekrojów do TEM. Cienkie cięcie dla TEM jest często wykonywane za pomocą diamentowego noża o jakości klejnotów. Uzupełniając tradycyjne techniki TEM, ultramikrotomy są coraz częściej montowane wewnątrz komory SEM, dzięki czemu można zobrazować powierzchnię czoła bloku, a następnie usunąć za pomocą mikrotomu, aby odsłonić kolejną powierzchnię do obrazowania. Ta technika nosi nazwę seryjnej mikroskopii elektronowej skaningowej powierzchni bloków (SBFSEM).
- Technika mikrotomii botanicznej: twarde materiały, takie jak drewno, kość i skóra, wymagają mikrotomu sanek . Te mikrotomy mają cięższe ostrza i nie mogą ciąć tak cienko jak zwykły mikrotom.
- Spektroskopia (zwłaszcza spektroskopia FTIR lub spektroskopia w podczerwieni ) Technika: cienkie skrawki polimeru są potrzebne, aby wiązka podczerwieni mogła przeniknąć badaną próbkę. Normalnie tnie się próbki do grubości od 20 do 100 μm. Do bardziej szczegółowej analizy znacznie mniejszych obszarów w cienkim przekroju można użyć mikroskopii FTIR do kontroli próbek.
Ostatnim wynalazkiem jest mikrotom laserowy , który tnie próbkę docelową za pomocą lasera femtosekundowego zamiast noża mechanicznego. Ta metoda jest bezkontaktowa i nie wymaga technik przygotowania próbki. Mikrotom laserowy jest w stanie przeciąć prawie każdą tkankę w jej natywnym stanie. W zależności od przetwarzanego materiału możliwe są plastry o grubości od 10 do 100 μm.
Przedziały cięcia można podzielić głównie na:
- Cięcie seryjne: uzyskanie ciągłej wstęgi przekrojów z bloku parafinowego i wykorzystanie wszystkiego do slajdów.
- Sekcje schodkowe: zbierane na określonych głębokościach w bloku.
Rodzaje
Sanki
Mikrotom saneczkowy to urządzenie, w którym próbkę umieszcza się w nieruchomym uchwycie (wahadłowce), który następnie porusza się do tyłu i do przodu po nożu. Nowoczesne mikrotomy sań mają sanki umieszczone na łożysku liniowym, co pozwala mikrotomowi na łatwe cięcie wielu grubych odcinków. Dostosowując kąty między próbką a nożem do mikrotomu, można zmniejszyć nacisk wywierany na próbkę podczas cięcia. Typowe zastosowania tego projektu mikrotomu to przygotowywanie dużych próbek, takich jak te zatopione w parafinie do preparatów biologicznych. Typowa grubość cięcia, jaką można uzyskać na mikrotomie sanek, wynosi od 1 do 60 μm.
Obrotowy
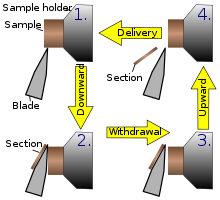
Ten instrument jest typową konstrukcją mikrotomu. To urządzenie działa ze stopniowym ruchem obrotowym, tak że rzeczywiste cięcie jest częścią ruchu obrotowego. W mikrotomie obrotowym nóż jest zazwyczaj zamocowany w pozycji poziomej.
Na rysunku po lewej wyjaśniono zasadę cięcia. Poprzez ruch uchwytu próbki, próbka jest odcinana od pozycji noża 1 do pozycji 2, w którym to miejscu świeży skrawek pozostaje na nożu. W najwyższym punkcie ruchu obrotowego uchwyt próbki jest przesuwany o tę samą grubość, co przekrój, który ma być wykonany, umożliwiając wykonanie następnego przekroju.
Koło zamachowe w wielu mikrotomach można obsługiwać ręcznie. Ma to tę zaletę, że można wykonać czyste cięcie, ponieważ stosunkowo duża masa koła zamachowego zapobiega zatrzymaniu próbki podczas cięcia próbki. Koło zamachowe w nowszych modelach jest często zintegrowane w obudowie mikrotomu. Typowa grubość cięcia dla mikrotomu obrotowego wynosi od 1 do 60 μm. W przypadku twardych materiałów, takich jak próbka osadzona w żywicy syntetycznej, ta konstrukcja mikrotomu umożliwia uzyskanie dobrych „półcienkich” przekrojów o grubości zaledwie 0,5 μm.
Kriomikrotom
Do cięcia zamrożonych próbek wiele mikrotomów obrotowych można przystosować do cięcia w komorze ciekłego azotu, w tak zwanej konfiguracji kriomikrotomu. Obniżona temperatura pozwala na zwiększenie twardości próbki, np. poprzez przejście zeszklenia, co pozwala na przygotowanie półcienkich próbek. Jednak temperatura próbki i temperatura noża muszą być kontrolowane, aby zoptymalizować wynikową grubość próbki.
Ultramikrotom
Ultramikrotom jest głównym narzędziem ultramikrotomii . Pozwala na przygotowanie bardzo cienkich przekrojów, przy czym urządzenie działa w taki sam sposób jak mikrotom obrotowy, ale z bardzo wąskimi tolerancjami konstrukcji mechanicznej. W wyniku starannej konstrukcji mechanicznej, liniowa rozszerzalność cieplna mocowania zapewnia bardzo dokładną kontrolę grubości.
Te niezwykle cienkie nacięcia są ważne w przypadku użycia w transmisyjnym mikroskopie elektronowym (TEM) i skaningowej mikroskopii elektronowej (SBFSEM), a czasami są również ważne w mikroskopii optyczno-świetlnej. Typowa grubość tych nacięć wynosi od 40 do 100 nm dla transmisyjnej mikroskopii elektronowej i często od 30 do 50 nm dla SBFSEM. Grubsze przekroje o grubości do 500 nm są również wykorzystywane do specjalistycznych zastosowań TEM lub do przekrojów mikroskopowych w celu wybrania obszaru dla końcowych cienkich przekrojów. W przypadku ultramikrotomów stosuje się noże diamentowe (najlepiej) i noże szklane. Aby zebrać skrawki, są one unoszone na powierzchni cieczy podczas cięcia i ostrożnie zbierane na kratkach odpowiednich do oglądania próbek TEM. Grubość przekroju można oszacować na podstawie cienkowarstwowych kolorów interferencyjnych światła odbitego, które są widoczne w wyniku bardzo małej grubości próbki.
Wibracje
Wibrujący mikrotom działa poprzez cięcie za pomocą wibrującego ostrza, dzięki czemu wynikowe cięcie może być wykonane przy mniejszym nacisku niż byłoby to wymagane w przypadku nieruchomego ostrza. Wibrujący mikrotom jest zwykle używany do trudnych próbek biologicznych. Grubość cięcia wynosi zwykle około 30–500 μm dla tkanki żywej i 10–500 μm dla tkanki utrwalonej.
Odmianą wibrującego mikrotomu jest mikrotom Compresstome. Compresstome używa strzykawki z próbkami lub „podobnej do szminki” rurki do trzymania tkanki. Próbka tkanki jest całkowicie zanurzona w agarozie ( polisacharyd ), a tkanka jest powoli i delikatnie wyciskana z probówki w celu przecięcia wibrującego ostrza. Urządzenie działa w następujący sposób: koniec probówki z próbką, z którego wyłania się tkanka, jest nieco węższy niż koniec obciążający, co umożliwia delikatne „uciskanie” tkanki podczas jej wychodzenia z probówki. Lekka kompresja zapobiega tworzeniu się ścinania, nierównego cięcia i powstawania artefaktów wibracyjnych. Należy pamiętać, że technologia kompresji nie uszkadza ani nie wpływa na przeciętą tkankę.
Istnieje kilka zalet mikrotomu Compresstome: 1) zatopienie w agarozie zapewnia stabilność całej próbki ze wszystkich stron, co zapobiega nierównomiernemu cięciu lub ścinaniu tkanki; 2) technologia kompresji delikatnie ściska tkankę w celu równomiernego cięcia, dzięki czemu ostrze nie naciska na tkankę; 3) szybsze cięcie niż większość wibrujących mikrotomów; oraz 4) dobrze tnie tkankę ze starszych lub bardziej dojrzałych zwierząt, aby zapewnić zdrowsze tkanki.
Piła
Mikrotom piły jest przeznaczony przede wszystkim do twardych materiałów, takich jak zęby czy kości. Mikrotom tego typu posiada zagłębioną piłę obrotową, która przecina próbkę. Minimalna grubość cięcia wynosi około 30 μm i może być wykonana dla stosunkowo dużych próbek.
Laser
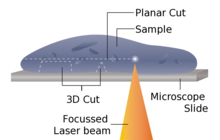
Laser mikrotom jest instrumentem do bezdotykowego krojenia. Wcześniejsze przygotowanie próbki poprzez zatapianie, zamrażanie lub utrwalanie chemiczne nie jest wymagane, co minimalizuje artefakty związane z metodami przygotowania. Alternatywnie ten projekt mikrotomu może być również stosowany do bardzo twardych materiałów, takich jak kości lub zęby, a także niektórych ceramiki. W zależności od właściwości materiału próbki, osiągalna grubość wynosi od 10 do 100 μm.
Urządzenie działa na zasadzie cięcia laserem na podczerwień. Ponieważ laser emituje promieniowanie w bliskiej podczerwieni, w tym reżimie długości fali laser może oddziaływać z materiałami biologicznymi. Poprzez ostre zogniskowanie sondy w próbce można uzyskać ognisko o bardzo dużej intensywności, do TW /cm 2 . Poprzez nieliniowe oddziaływanie penetracji optycznej w obszarze ogniskowym wprowadza się separację materiału w procesie znanym jako fotoprzerwanie. Ograniczając czas trwania impulsu laserowego do zakresu femtosekund, energia zużywana w obszarze docelowym jest precyzyjnie kontrolowana, co ogranicza strefę interakcji cięcia poniżej mikrometra. Poza tą strefą ultrakrótki czas aplikacji wiązki wprowadza minimalne lub nie powoduje żadnych uszkodzeń termicznych pozostałej części próbki.
Promieniowanie laserowe jest kierowane na szybko skanujący system optyczny oparty na lustrze, który umożliwia trójwymiarowe pozycjonowanie skrzyżowania wiązki, jednocześnie umożliwiając przechodzenie wiązki do pożądanego obszaru zainteresowania. Połączenie dużej mocy z dużą szybkością rastrową umożliwia skanerowi cięcie dużych obszarów próbki w krótkim czasie. W mikrotomie laserowym możliwa jest również mikrodysekcja laserowa obszarów wewnętrznych w tkankach, strukturach komórkowych i innych drobnych cechach.
Noże
Wybór profilu ostrza noża mikrotomowego zależy od materiału i przygotowania próbek, a także wymagań dotyczących próbki końcowej (np. grubości i jakości cięcia).
Rodzaje projektowania i cięcia
Ogólnie rzecz biorąc, noże charakteryzują się profilem ostrza noża, który należy do kategorii wklęsłych płaskich, w kształcie klina lub w kształcie dłuta.
Płaskie noże do mikrotomu wklęsłego są niezwykle ostre, ale są również bardzo delikatne i dlatego są używane tylko z bardzo miękkimi próbkami. Noże o profilu klinowym są nieco bardziej stabilne i znajdują zastosowanie w umiarkowanie twardych materiałach, takich jak cięcie próbek epoksydowych lub kriogenicznych. Wreszcie, profil dłuta z tępą krawędzią zwiększa stabilność noża, jednocześnie wymagając znacznie większej siły do wykonania cięcia.
W przypadku ultramikrotomów wymagane są noże szklane i diamentowe, szerokość cięcia ostrza jest zatem rzędu kilku milimetrów i dlatego jest znacznie mniejsza niż w przypadku klasycznych noży do mikrotomów. Noże szklane są zwykle wytwarzane przez łamanie prętów szklanych za pomocą specjalnych urządzeń do szczelinowania „wytwórcy noży”. Szklane noże mogą być używane do wstępnego przygotowania próbki, nawet tam, gdzie noże diamentowe mogą być używane do końcowego cięcia. Szklane noże zwykle mają małe rynny, wykonane z plastikowej taśmy, które są wypełnione wodą, aby umożliwić unoszenie się próbki do późniejszego pobrania. W takim istniejącym korycie można wbudować tarcze diamentowe, co pozwala na tę samą metodę zbierania.
Sekcje
Przed cięciem przez mikrotom, materiały biologiczne są zwykle umieszczane w sztywniejszym utrwalaczu, w procesie znanym jako osadzanie. Osiąga się to poprzez napływ ciekłej substancji wokół próbki, takiej jak parafina (wosk) lub żywica epoksydowa, którą umieszcza się w formie, a następnie utwardza, tworząc „blok”, który można łatwo ciąć.
Deklinacja to kąt kontaktu między pionem próbki a ostrzem noża. Jeśli ostrze noża jest ustawione pod kątem prostym (deklinacja=90), cięcie jest wykonywane bezpośrednio w trybie opartym na nacisku, a zatem siły są proporcjonalnie większe. Jeśli jednak nóż jest przechylony, względny ruch noża jest coraz bardziej równoległy do ruchu próbki, co pozwala na krojenie. To zachowanie jest bardzo ważne w przypadku dużych lub twardych próbek
Nachylenie noża to kąt między czołem noża a próbką. Aby uzyskać optymalny wynik, ten kąt musi być odpowiednio dobrany. Optymalny kąt zależy od geometrii noża, prędkości cięcia i wielu innych parametrów. Jeśli kąt jest ustawiony na zero, cięcie nożem może często stać się nierówne i należy użyć nowego położenia noża, aby to wygładzić.
Jeśli kąt jest zbyt duży, próbka może się zgniatać, a nóż może wywoływać okresowe zmiany grubości cięcia. Dalsze zwiększanie kąta do zbyt dużego może spowodować uszkodzenie samego ostrza noża.
Zobacz też
Bibliografia
- ^ B Hill, John (1770). Budowa Drewna, od jego wczesnego wzrostu; Wyjaśnione przez Mikroskop i sprawdzone w Eksperymentach, w wielu różnych rodzajach . Londyn: autor. str. 5 -11, tablica I.
- ^ Quekett, Jan (1848). Praktyczny traktat o użytkowaniu mikroskopu . Londyn: Hippolyte Bailliere. s. 306 , rozdział XII (Mikrotomy i noże do mikrotomów).
- ^ Anonimowy (1910). „Mikrotom z XVIII wieku” . Dziennik Królewskiego Towarzystwa Mikroskopowego . Oxford, Anglia: Królewskie Towarzystwo Mikroskopowe: 779-782.
-
^ Gilbert Morgan Smith: Rozwój mikrotechniki botanicznej. W: Transakcje Amerykańskiego Towarzystwa Mikroskopowego 34, Nr. 2. 1915, S. 71–129, ( PDF-Wersja artykułu) JSTOR 3221940 doi : 10.2307/3221940

- ^ „Wilhelm Jego” . Encyklopedia Britannica Online. Encyklopedia Britannica . Źródło 24 marca 2009 .
- ^ Loukas M Clarke P Tubbs RS Kapos T Trotz M (2008). „Jego rodzina i ich wkład w kardiologię”. Międzynarodowy Czasopismo Kardiologii . 123 (2): 75-78. doi : 10.1016/j.ijcard.2006.12.070 . ISSN 0167-5273 . PMID 17433467 .
- ^ „Histologia” . msn Encarta . Zarchiwizowane z oryginału w dniu 25 kwietnia 2009 . Źródło 18 marca 2009 .
- ^ Detlev Ganten: Handbuch der molekularen Medizin (Podręcznik medycyny molekularnej) , Springer, ISBN 3-540-64552-7 , ( Google-Books )
- ^ Werner Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (2005): Enzyklopädie Mediizingeschichte (Encyklopedia historii medycznej), Walter de Gruyter, ISBN 3-11-015714-4 , ( Google-Books )
- ^ Ernst Mayr (2002).Die Entwicklung der biologischen Gedankenwelt. (Ewolucja myśli biologicznej) . Skoczek. Numer ISBN 978-3-540-43213-5.
- ^ Werner Linß, Werner Linb, Jochen Fanghänel: Histologie: Zytologie, allgemeine Histologie, mikroskopische Anatomie. (Histologia: cytologia, histologia ogólna, anatomia mikroskopowa) Walter de Gruyter, 1998, ISBN 3-11-014032-2 ( Google-Books )
- ^ Bancroft, Jan; Stevens, Alan, wyd. (1982). Teoria i praktyka technik histologicznych (wyd. 2). Longman Group Limited.
- ^ B c d e f g Gudrun Lang (2006).Histotechnika. Praxislehrbuch für die Biomedizinische Analytik. (Histologia: praktyczny podręcznik biomedycyny analitycznej) . Springer, Wiedeń/Nowy Jork. Numer ISBN 978-3-211-33141-5.
- ^ a b c Klaus Henkel: Das Schneiden mit dem Mikrotom Zarchiwizowane 10 listopada 2009 w Wayback Machine . Mikrobiologische Vereinigung München e. V., 2006, dostęp 15.02.2009
- ^ Peachey Lee D. (1958). „Cienkie przekroje: badanie grubości przekrojów i zniekształceń fizycznych powstałych podczas mikrotomii” (PDF) . J Biophys Biochem Cytol . 4 (3): 233–242. doi : 10.1083/jcb.4.3.233 . PMC 2224471 . PMID 13549493 .
- ^ Krumdieck, Carlos L. (styczeń 2013). „Opracowanie mikrotomu żywej tkanki: refleksje mechanika-amatora” . Ksenobiotyka . 43 (1): 2-7. doi : 10.3109/00498254.2012.724727 . ISSN 0049-8254 . PMID 23009272 . S2CID 6108637 .
- ^ Abdelaal, Hadia M.; Kim, Hyeon O.; Wagstaff, Reece; Sawahata, Ryoko; Południe, Peter J.; Skinner, Pamela J. (1 stycznia 2015). „Porównanie przekrojów metodą Vibratome i Compresstome świeżych tkanek limfoidalnych i narządów płciowych naczelnych do barwienia in situ MHC-tetramerem i barwienia immunofluorescencyjnego” . Procedury biologiczne online . 17 (1): 2. doi : 10.1186/s12575-014-0012-4 . ISSN 1480-9222 . PMC 4318225 . PMID 25657614 .
- ^ "indeks" . www.precisionary.com . Pobrano 6 września 2016 .
- ^ „Ulepszone metody przygotowania ostrych wycinków mózgu od dorosłych i starzejących się zwierząt” .
-
^ Holger Lubatschowski 2007: Mikrotomia laserowa , WILEY-VCH Verlag GmbH, Biophotonics, S. 49-51 ( PDF zarchiwizowane 19 lipca 2011 w Wayback Machine ). doi : 10.1002/opph.201190252

Zewnętrzne linki
- . Encyclopaedia Britannica (wyd. 11). 1911.