Biogeneza mitochondrialna - Mitochondrial biogenesis
Biogeneza mitochondrialna to proces, w którym komórki zwiększają liczbę mitochondriów . Został po raz pierwszy opisany przez Johna Holloszy w latach 60. XX wieku, kiedy odkryto, że trening wytrzymałości fizycznej indukuje wyższy poziom zawartości mitochondriów, prowadząc do większego wychwytu glukozy przez mięśnie. Biogeneza mitochondrialna jest aktywowana przez wiele różnych sygnałów w czasie stresu komórkowego lub w odpowiedzi na bodźce środowiskowe, takie jak ćwiczenia aerobowe .
tło
Zdolność mitochondrium do samoreplikacji jest zakorzeniona w jego ewolucyjnej historii. Powszechnie uważa się, że mitochondria wywodzą się z komórek, które utworzyły relacje endosymbiotyczne z α-protobakteriami , mają własny genom do replikacji. Jednak ostatnie dowody sugerują, że mitochondria mogły ewoluować bez symbiozy. Mitochondrium jest kluczowym regulatorem aktywności metabolicznej komórki, a także ważnym organellą zarówno w produkcji, jak i degradacji wolnych rodników. Postuluje się, że wyższa liczba kopii mitochondrialnych (lub wyższa masa mitochondrialna) chroni komórkę.
Mitochondria powstają w wyniku transkrypcji i translacji genów zarówno w genomie jądrowym, jak iw genomie mitochondrialnym . Większość białek mitochondrialnych pochodzi z genomu jądrowego, podczas gdy genom mitochondrialny koduje części łańcucha transportu elektronów wraz z mitochondrialnym rRNA i tRNA . Biogeneza mitochondrialna zwiększa enzymy metaboliczne dla glikolizy, fosforylacji oksydacyjnej i ostatecznie większej zdolności metabolicznej mitochondriów. Jednak w zależności od dostępnych substratów energetycznych i stanu REDOX komórki, komórka może zwiększać lub zmniejszać liczbę i rozmiar mitochondriów. Co istotne, liczba i morfologia mitochondriów różnią się w zależności od typu komórki i zapotrzebowania specyficznego dla kontekstu, przy czym równowaga między fuzją/rozszczepieniem mitochondriów reguluje dystrybucję, morfologię i funkcję mitochondriów.
Import białka
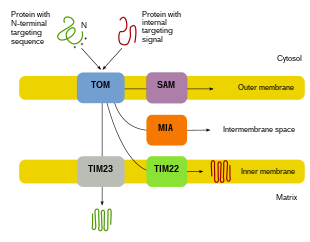
Ponieważ większość białek mitochondrialnych pochodzi z genomu jądrowego, białka muszą być odpowiednio ukierunkowane i transportowane do mitochondriów, aby mogły pełnić swoje funkcje. Najpierw mRNA ulega translacji w cytozolu komórki. Powstałe w ten sposób niesfałdowane białka prekursorowe będą w stanie dotrzeć do odpowiednich przedziałów mitochondrialnych. Białka prekursorowe będą transportowane do jednego z czterech obszarów mitochondriów, które obejmują błonę zewnętrzną, błonę wewnętrzną, przestrzeń międzybłonową i macierz. Wszystkie białka dostaną się do mitochondriów przez translokazę na zewnętrznej błonie mitochondrialnej (TOM). Niektóre białka będą miały N-końcowy sygnał kierujący, a białka te zostaną wykryte i przetransportowane do matrycy, gdzie zostaną następnie rozszczepione i zwinięte. Inne białka mogą mieć w swoich sekwencjach informacje o ukierunkowaniu i nie będą zawierać sygnału N-końcowego. W ciągu ostatnich dwóch dekad naukowcy odkryli ponad trzydzieści białek, które uczestniczą w imporcie białek mitochondrialnych. Gdy naukowcy dowiadują się więcej o tych białkach i sposobie, w jaki docierają do odpowiednich przedziałów mitochondrialnych, które je wykorzystują, staje się oczywiste, że istnieje wiele procesów, które współdziałają w komórce, aby umożliwić biogenezę mitochondriów.
Fuzja i rozszczepienie
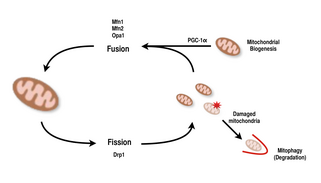
Mitochondria są bardzo wszechstronne i mogą zmieniać swój kształt poprzez zdarzenia rozszczepienia i fuzji. Ostatecznie rozszczepienie jest zdarzeniem rozpadu jednego bytu, podczas gdy fuzja to zdarzenie, w którym dwa lub więcej bytów łączy się w całość. Procesy rozszczepienia i fuzji przeciwstawiają się sobie i pozwalają sieci mitochondrialnej na nieustanną przebudowę. Jeśli bodziec indukuje zmianę w równowadze rozszczepienia i fuzji w komórce, może znacząco zmienić sieć mitochondrialną. Na przykład wzrost rozszczepienia mitochondriów spowodowałby powstanie wielu pofragmentowanych mitochondriów, które okazały się przydatne w eliminowaniu uszkodzonych mitochondriów i tworzeniu mniejszych mitochondriów w celu wydajnego transportu do obszarów wymagających energii. Dlatego osiągnięcie równowagi między tymi mechanizmami pozwala komórce na prawidłową organizację sieci mitochondrialnej podczas biogenezy i może odgrywać ważną rolę w adaptacji mięśni do stresu fizjologicznego.
U ssaków fuzja i rozszczepienie mitochondriów są kontrolowane przez GTPazy z rodziny dynamin. Procesem rozszczepiania mitochondriów kieruje Drp1 , członek rodziny cytozolowych dynamin. Białko to tworzy spiralę wokół mitochondriów i zwęża się, aby rozerwać zarówno zewnętrzną, jak i wewnętrzną błonę organelli. Z drugiej strony, procesem fuzji kierują różne zakotwiczone w błonie białka dynaminy na różnych poziomach mitochondriów. Fuzja na poziomie zewnętrznej błony mitochondrialnej odbywa się za pośrednictwem Mfn1 i Mfn2 (Mitofusins 1 i 2), a fuzja na poziomie wewnętrznej błony mitochondrialnej odbywa się za pośrednictwem Opa1 . W wielu badaniach naukowych zaobserwowano skorelowany wzrost pojemności oddechowej mitochondriów z ekspresją genów Mfn1, Mnf2 i Drp1 po ćwiczeniach wytrzymałościowych. Dlatego potwierdza się, że reorganizacja sieci mitochondrialnej w komórkach mięśniowych odgrywa ważną rolę w odpowiedzi na ćwiczenia.
Rozporządzenie
PGC-1α , członek rodziny koaktywatorów transkrypcyjnych receptorów aktywowanych przez proliferatory peroksysomów gamma (PGC) , jest głównym regulatorem biogenezy mitochondriów. Wiadomo, że koaktywuje jądrowy czynnik oddechowy 2 (NRF2/GABPA) i razem z NRF-2 koaktywuje jądrowy czynnik oddechowy 1 ( NRF1 ). Z kolei NRF aktywują mitochondrialny czynnik transkrypcyjny A (tfam) , który jest bezpośrednio odpowiedzialny za transkrypcję białek mitochondrialnych kodowanych w jądrze . Obejmuje to zarówno strukturalne białka mitochondrialne, jak i te zaangażowane w transkrypcję, translację i naprawę mtDNA . PGC-1β, białko strukturalnie podobne do PGC-1α , jest również zaangażowane w regulację biogenezy mitochondriów, ale różni się tym, że nie wzrasta w odpowiedzi na wysiłek. Chociaż nastąpił znaczny wzrost mitochondriów w tkankach, w których występuje nadekspresja PGC-1α, ponieważ kofaktor oddziałuje z tymi kluczowymi czynnikami transkrypcyjnymi, myszy z nokautem z uszkodzonym PGC-1α są nadal żywe i wykazują normalną obfitość mitochondriów. Tak więc PGC-1α nie jest wymagany do prawidłowego rozwoju mitochondriów u myszy, ale pod wpływem stresu fizjologicznego myszy te wykazują zmniejszoną tolerancję w porównaniu z myszami z normalnym poziomem PGC-1α. Podobnie u myszy knockout z zaburzonym PGC-1β, myszy wykazywały głównie normalne poziomy funkcji mitochondriów ze zmniejszoną zdolnością adaptacji do stresu fizjologicznego. Jednak eksperyment podwójnego nokautu PGC-1α/β stworzył myszy, które umierały głównie w ciągu 24 godzin z powodu defektów w mitochondrialnym dojrzewaniu tkanki sercowej. Odkrycia te sugerują, że chociaż zarówno PGC-1α, jak i PGC-1β nie określają wyłącznie zdolności komórki do biogenezy mitochondriów, razem są w stanie wzajemnie się uzupełniać w celu optymalnego dojrzewania mitochondriów i funkcjonowania w okresach stresu fizjologicznego.
Kinaza aktywowana przez AMP (AMPK) reguluje również biogenezę mitochondriów poprzez fosforylację i aktywację PGC-1α po wykryciu niedoboru energii w mięśniach. Wykazano, że u myszy ze zmniejszonym stosunkiem ATP/AMP, który wystąpiłby podczas ćwiczeń, ubytek energii koreluje z aktywacją AMPK. Następnie aktywacja AMPK kontynuowała aktywację PGC-1α i NRF u tych myszy i stymulowano biogenezę mitochondriów.
Starzenie się
Wykazano, że zdolność do biogenezy mitochondriów zmniejsza się wraz z wiekiem, a takie osłabienie funkcji mitochondriów wiąże się z cukrzycą i chorobami sercowo-naczyniowymi. Starzenie się i choroba mogą wywoływać zmiany w poziomach ekspresji białek zaangażowanych w mechanizmy rozszczepienia i fuzji mitochondriów, tworząc w ten sposób dysfunkcyjne mitochondria. Jedna z hipotez dotyczących szkodliwych skutków starzenia się wiąże się z utratą telomerów , końcowych segmentów chromosomów, które chronią informację genetyczną przed degradacją. Utrata telomerów jest również związana z osłabieniem funkcji mitochondriów. Niedobór odwrotnej transkryptazy telomerazy (TERT) , enzymu, który odgrywa rolę w zachowaniu telomerów, został skorelowany z aktywowanym p53, białkiem hamującym PGC-1α. Dlatego utrata telomerów i TERT, która pojawia się wraz ze starzeniem się, wiąże się z zaburzeniami biogenezy mitochondriów. Wykazano również, że ekspresja AMPK zmniejsza się wraz z wiekiem, co może również przyczyniać się do hamowania biogenezy mitochondriów.
Bibliografia
Dalsza lektura
- Smith JA, Ogiery LJ, Collier JB, Chavin KD, Schnellmann RG (luty 2015). „Tłumienie biogenezy mitochondriów przez kinazę białkową kinazy aktywowanej mitogenami zależną od receptora Toll-like 4 / kinazę regulowaną sygnałem zewnątrzkomórkowym w ostrym uszkodzeniu nerek wywołanym przez endotoksyny” . Czasopismo Farmakologii i Terapii Eksperymentalnej . 352 (2): 346–57. doi : 10.1124/jpet.114.221085 . PMC 4293437 . PMID 25503387 .
- Cameron RB, Beeson CC, Schnellmann RG (grudzień 2016). „Rozwój terapii indukujących biogenezę mitochondrialną w leczeniu ostrych i przewlekłych chorób zwyrodnieniowych” . Czasopismo Chemii Lekarskiej . 59 (23): 10411–10434. doi : 10.1021/acs.jmedchem.6b00669 . PMC 5564430 . PMID 27560192 .
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). „Biogeneza mitochondrialna jako cel farmakologiczny: nowe podejście do chorób ostrych i przewlekłych”. Roczny Przegląd Farmakologii i Toksykologii . 56 : 229–49. doi : 10.1146/annurev-pharmtox-010715-103155 . PMID 26566156 .