Glikoproteina mielinowa oligodendrocytów - Myelin oligodendrocyte glycoprotein
Mielinowej glikoproteiny oligodendrocytów ( MOG ) jest glikoproteiną uważa się za istotne w mielinizacji z nerwów w ośrodkowym układzie nerwowym (OUN). U ludzi to białko jest kodowane przez gen MOG . Przypuszcza się, że służy jako niezbędna „cząsteczka adhezyjna” zapewniająca integralność strukturalną osłonki mielinowej i wiadomo, że rozwija się późno na oligodendrocytach .
Funkcja molekularna
Podczas gdy podstawowa funkcja molekularna MOG nie jest jeszcze znana, jego prawdopodobna rola w osłonce mielinowej polega na „ukończeniu i/lub utrzymaniu” osłonki. Bardziej konkretnie, spekuluje się, że MOG jest „konieczny” jako „cząsteczka adhezyjna” na osłonce mielinowej OUN, aby zapewnić integralność strukturalną osłonki mielinowej”.
Wykazano, że region kodujący cDNA MOG u ludzi jest „wysoce homologiczny” do szczurów, myszy i bydła, a zatem jest wysoce konserwatywny. Sugeruje to „ważną biologiczną rolę tego białka”.
Fizjologia
Gen MOG, znaleziony na chromosomie 6 p21.3-p22, został po raz pierwszy zsekwencjonowany w 1995 roku. Jest to białko transbłonowe ulegające ekspresji na powierzchni komórek oligodendrocytów i na najbardziej zewnętrznej powierzchni osłonek mielinowych . „MOG jest ilościowo drugorzędnym białkiem transbłonowym typu I i znajduje się wyłącznie w OUN. „Pojedyncza domena Ig jest eksponowana na przestrzeń zewnątrzkomórkową” i w konsekwencji umożliwia łatwy dostęp do autoprzeciwciał, a zatem łatwo dostępny dla autoprzeciwciał. transkrypt materiałów ... jest 15,561 nukleotydów „i dla ludzi, posiada osiem egzonów, które są«oddzielone przez siedem intronów .»introny«zawierają liczne reptitive [ sic! ]»sekwencje, z których jest” DNA 14 sekwencji Alu w 3 intronów " i mają zakres od 242 do 6484 pz.
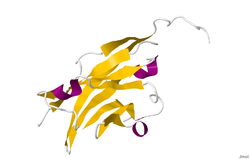
Struktura
Z powodu alternatywnego składania z ludzkiego mRNA genu MOG tworzącego co najmniej dziewięć izoform.
Strukturę krystaliczną glikoproteiny mieliny oligodendrocytów określono metodą dyfrakcji rentgenowskiej przy rozdzielczości 1,45 angstremów, stosując białko ze szczura norweskiego. Białko to ma długość 139 reszt i jest członkiem nadrodziny immunoglobulin. Drugorzędowa struktura dssp białka to 6% helikalna i 43% beta-arkusz: istnieją trzy krótkie helikalne segmenty i dziesięć nici beta. Nici beta znajdują się w dwóch antyrównoległych arkuszach beta, które tworzą fałd beta-kanapki przypominający immunoglobulinę. Kilka cech struktury białka sugeruje, że MOG odgrywa rolę „adhezyny w uzupełnianiu i/lub zagęszczaniu osłonki mielinowej”. Istnieje „znaczny pasek” ładunku elektroujemnego rozpoczynający się w pobliżu N-końca i biegnący około połowy długości cząsteczki. Wykazano również, że MOG ulega dimeryzacji w roztworze, a wskaźnik komplementarności kształtu jest wysoki na granicy faz dimeru, co sugeruje „biologicznie istotny dimer MOG”.
Synteza
Rozwojowo MOG powstaje „bardzo późno na oligodendrocytach i osłonce mielinowej”.
Rola w chorobie
Niezapalne choroby demielinizacyjne
Zainteresowanie MOG skupiło się na jego roli w chorobach demielinizacyjnych . Niektóre z nich nie mają charakteru zapalnego, np. adrenoleukodystrofia , zanikająca choroba istoty białej i opóźnienie umysłowe wywołane różyczką.
Choroby zapalne demielinizacyjne związane z anty-MOG
MOG otrzymał wiele uwagi laboratoryjnej w badaniach dotyczących stwardnienia rozsianego. Kilka badań wykazało rolę przeciwciał przeciwko MOG w patogenezie stwardnienia rozsianego, chociaż większość z nich została napisana przed odkryciem NMO-IgG i spektrum chorób NMO.
Status anty-MOG różni się w zależności od tego, czy jest mierzony testem ELISA, czy metodą mikromacierzy ( CBA ). Właściwym sposobem identyfikacji jest mikromacierz, reakcja surowicy pacjenta z żywymi komórkami i wykrywanie wiążącej IgG za pomocą przeciwciała drugorzędowego znakowanego fluorescencyjnie.
W modelach zwierzęcych
Modele zwierzęce MS, EAE wykazały, że „modele EAE swoiste dla MOG (różnych szczepów zwierzęcych) wykazują/odzwierciedlają ludzkie stwardnienie rozsiane”, ale zasadniczo wyjaśniają rolę związaną z zapaleniem nerwu wzrokowego Te modele z przeciwciałami anty-MOG zostały zbadane ekstensywnie i są uważane za jedyne przeciwciała ze zdolnością demielinizacji ale znowu, patologia EAE jest bliższa NMO i ADEM niż do zlewnej demielinizacji obserwowanej w stwardnieniu rozsianym.
Wykazano, że demielinizacja za pośrednictwem anty-MOG zachowuje się podobnie do NMO w modelach zwierzęcych, a obecnie jest uważana nawet za biomarker przeciwko diagnozie SM
W seronegatywnym zapaleniu nerwu wzrokowego
Stwierdzono, że autoimmunizacja anty-MOG jest zaangażowana w seronegatywne NMO, a także w zapalenie nerwu wzrokowego, a niektóre piorunujące formy przeciwciał ADEM MOG w NMOSD są zmienne w zależności od statusu seropozytywności
W innych warunkach
Obecność autoprzeciwciał anty-MOG powiązano z następującymi stanami:
- Niektóre przypadki seronegatywnego zapalenia nerwu wzrokowego akwaporyny-4: NMO pochodzące z zapalenia mózgu i rdzenia związanego z antyMOG ,
- Niektóre przypadki ostrego rozsianego zapalenia mózgu i rdzenia , szczególnie nawracające (MDEM) i przebiegi piorunujące
- Niektóre przypadki stwardnienia rozsianego
- izolowane zapalenie nerwu wzrokowego lub poprzeczne zapalenie rdzenia