Węzeł Ranviera - Node of Ranvier
| Węzeł Ranvier | |
|---|---|
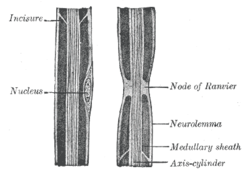 Rysunek aksonu nerwu obwodowego (oznaczony „cylindrem osi”), przedstawiający węzeł Ranviera wraz z innymi cechami
| |
 Węzły Ranvier
| |
| Detale | |
| System | System nerwowy |
| Lokalizacja | Mielinową aksonów z nerwu |
| Identyfikatory | |
| łacina | incisura mielini |
| Siatka | D011901 |
| NS | H2.00.06.2.03015 |
|
Anatomiczne terminy mikroanatomii | |
Przewężenie ranviera ( / ˌ R ɑː n V I eɪ / RAHN -vee- AY , / R ɑː n V I eɪ / -ay ), znany również jako szczeliny mieliny, osłonki występują wzdłuż mielinową aksonów w którym axolemma jest narażony na przestrzeń pozakomórkową. Węzły Ranviera są nieizolowane i silnie wzbogacone w kanały jonowe , co pozwala im uczestniczyć w wymianie jonów niezbędnych do regeneracji potencjału czynnościowego . Przewodzenie nerwowe w zmielinizowanych aksonach jest określane jako przewodzenie słone (z łac. saltare „ skoczyć lub przeskoczyć”) ze względu na sposób, w jaki potencjał czynnościowy wydaje się „przeskakiwać” z jednego węzła do drugiego wzdłuż aksonu. Powoduje to szybsze przewodzenie potencjału czynnościowego.
Przegląd
| Węzeł Ranvier |
|---|
Wiele aksonów kręgowców jest otoczonych osłonką mielinową, umożliwiającą szybką i wydajną propagację potencjałów czynnościowych. Kontakty między neuronami a komórkami glejowymi wykazują bardzo wysoki poziom organizacji przestrzennej i czasowej we włóknach mielinowych. Mielinizujące się komórki glejowe - oligodendrocyty w ośrodkowym układzie nerwowym (OUN) i komórki Schwanna w obwodowym układzie nerwowym (PNS) - są owinięte wokół aksonu, pozostawiając aksolemę względnie odkrytą w regularnie rozmieszczonych węzłach Ranviera.
Międzywęzłowe błony glejowe są połączone, tworząc zwartą mielinę , podczas gdy wypełnione cytoplazmą pętle paranodalne komórek mielinujących są spiralnie owinięte wokół aksonu po obu stronach węzłów. Ta organizacja wymaga ścisłej kontroli rozwoju i tworzenia różnych wyspecjalizowanych stref kontaktu między różnymi obszarami mielinującej błony komórkowej. Każdy węzeł Ranviera jest otoczony przez regiony paranodalne, w których helikoidalnie owinięte pętle glejowe są połączone z błoną aksonów za pomocą połączenia przypominającego przegrodę.
Segment między węzłami Ranviera jest określany jako międzywęzeł , a jego najbardziej zewnętrzna część, która styka się z paranodami, jest określana jako region okołoparanodalny. Węzły są otoczone mikrokosmkami wywodzącymi się z zewnętrznego aspektu błony komórkowej Schwanna w PNS lub wydłużeniami okołowęzłowymi astrocytów w OUN.
Struktura
Międzywęzły są segmentami mielinowymi , a przerwy między nimi są określane jako węzły. Rozmiar i odstęp międzywęzłów zmieniają się wraz ze średnicą włókna w zależności krzywoliniowej, która jest zoptymalizowana pod kątem maksymalnej prędkości przewodzenia. Węzły mają wielkość od 1 do 2 μm, podczas gdy międzywęźle mogą mieć długość do (a niekiedy nawet ponad) 1,5 milimetra, w zależności od średnicy aksonów i rodzaju włókna.
Struktura węzła i flankujących regionów paranodalnych różnią się od międzywęzłów pod zwartą osłonką mielinową , ale są bardzo podobne w OUN i PNS. Akson jest wystawiony na działanie środowiska zewnątrzkomórkowego w węźle i ma zwężoną średnicę. Zmniejszony rozmiar aksonów odzwierciedla większą gęstość upakowania neurofilamentów w tym regionie, które są mniej ufosforylowane i są transportowane wolniej. Pęcherzyki i inne organelle są również zwiększone w węzłach, co sugeruje, że istnieje wąskie gardło transportu aksonów w obu kierunkach, jak również lokalna sygnalizacja aksonalno-glejowa.
Kiedy w węźle wykonuje się przekrój podłużny przez mielinizującą komórkę Schwanna , reprezentowane są trzy wyróżniające się segmenty: stereotypowy międzywęzeł , obszar paranodalny i sam węzeł. W obszarze międzywęzłowym komórka Schwanna ma zewnętrzny kołnierz cytoplazmy, zwartą osłonkę mielinową i wewnętrzny kołnierz cytoplazmy oraz aksolemmę. W obszarach paranodalnych paranodalne pętle cytoplazmy stykają się z zgrubieniami aksolemy, tworząc połączenia przypominające przegrody. W samym węźle aksolema styka się z kilkoma mikrokosmkami Schwanna i zawiera gęstą powłokę cytoszkieletu.
Różnice w centralnym i obwodowym układzie nerwowym
Chociaż badania złamania zamrożenia wykazały, że aksolema węzłowa zarówno w OUN, jak i PNS jest wzbogacona w cząstki wewnątrzbłonowe (IMP) w porównaniu z międzywęźlem, istnieją pewne różnice strukturalne odzwierciedlające ich składniki komórkowe. W PNS wyspecjalizowane mikrokosmki wystają z zewnętrznego kołnierza komórek Schwanna i zbliżają się bardzo do aksolemy węzłowej dużych włókien. Rzuty komórek Schwanna są prostopadłe do węzła i rozchodzą się promieniście od centralnych aksonów. Jednak w OUN jeden lub więcej procesów astrocytowych zachodzi w bliskim sąsiedztwie węzłów. Badacze deklarują, że procesy te wywodzą się z wielofunkcyjnych astrocytów, a nie z populacji astrocytów oddanych kontaktowi z węzłem. Z drugiej strony w PNS blaszka podstawna otaczająca komórki Schwanna jest ciągła w poprzek węzła.
Kompozycja
Węzły wymienników Ranvier Na+/Ca2+ i wysoka gęstość kanałów Na+ bramkowanych napięciem, które generują potencjały czynnościowe. Kanał sodowy składa się z tworzącej pory podjednostki α i dwóch pomocniczych podjednostek β, które zakotwiczają kanał w składnikach pozakomórkowych i wewnątrzkomórkowych. Węzły Ranviera w ośrodkowym i obwodowym układzie nerwowym składają się głównie z podjednostek αNaV1.6 i β1. Pozakomórkowy region podjednostek β może łączyć się ze sobą i innymi białkami, takimi jak tenascyna R i cząsteczki adhezyjne, neurofascyna i kontaktyna. Kontaktyna jest również obecna w węzłach w OUN, a interakcja z tą cząsteczką zwiększa ekspresję powierzchniową kanałów Na+.
Stwierdzono, że ankyryna jest związana ze spektryną βIV, izoformą spektryny wzbogaconą w węzłach początkowych segmentów Ranviera i aksonów. Węzły PNS są otoczone mikrokosmkami komórkowymi Schwanna , które zawierają ERM i EBP50, które mogą zapewniać połączenie z mikrofilamentami aktynowymi. Kilka białek macierzy zewnątrzkomórkowej jest wzbogaconych w węzłach Ranviera, w tym tenascyna-R , Bral-1 i proteoglikan NG2, a także fosfakan i wersikan V2. W węzłach OUN białka aksonalne obejmują również kontaktynę; jednak mikrokosmki komórek Schwanna są zastąpione przez wydłużenia okołowęzłowe astrocytów .
Organizacja molekularna
Molekularna organizacja węzłów odpowiada ich wyspecjalizowanej funkcji w propagacji impulsów. Poziom kanałów sodowych w węźle w porównaniu z międzywęzłem sugeruje, że liczba IMP odpowiada kanałom sodowym. Kanały potasowe są zasadniczo nieobecne w aksolemie węzłowej, podczas gdy są silnie skoncentrowane w aksolemie przywęzłowej i błonach komórkowych Schwanna w węźle. Dokładna funkcja kanałów potasowych nie została do końca poznana, ale wiadomo, że mogą one przyczyniać się do szybkiej repolaryzacji potencjałów czynnościowych lub odgrywać istotną rolę w buforowaniu jonów potasu w węzłach. Ta wysoce asymetryczna dystrybucja bramkowanych napięciem kanałów sodowych i potasowych jest w uderzającym kontraście z ich rozproszonym rozkładem we włóknach niezmielinizowanych.
Sieć nitkowate pod spodem z błoną węzłów zawiera białek cytoszkieletu zwane spektryny i ankirynowymi . Wysoka gęstość ankiryny w węzłach może mieć znaczenie funkcjonalne, ponieważ kilka białek, które są obecne w węzłach, łączy zdolność wiązania się z ankiryną z niezwykle wysokim powinowactwem. Wszystkie te białka, w tym ankyryna , są wzbogacone w początkowy segment aksonów, co sugeruje związek funkcjonalny. Obecnie związek tych składników molekularnych z grupowaniem kanałów sodowych w węzłach wciąż nie jest znany. Chociaż doniesiono, że niektóre cząsteczki adhezji komórkowej są obecne w węzłach w sposób niespójny; jednak wiadomo, że wiele innych cząsteczek jest gęsto zaludnionych w błonach glejowych regionów paranodalnych, gdzie przyczyniają się do jego organizacji i integralności strukturalnej.
Rozwój
Mielinizacja włókien nerwowych
Złożone zmiany, którym przechodzi komórka Schwanna podczas procesu mielinizacji włókien nerwów obwodowych, były obserwowane i badane przez wielu. Początkowe otoczenie aksonu następuje bez przerwy na całym obszarze komórki Schwanna . Proces ten jest sekwencjonowany przez sfałdowanie powierzchni komórki Schwanna tak, że tworzy się podwójna membrana przeciwległych powierzchni sfałdowanej powierzchni komórki Schwanna . Ta membrana rozciąga się i spiralnie owija się w kółko w miarę dalszego fałdowania powierzchni komórek Schwanna . W rezultacie łatwo jest stwierdzić zwiększenie grubości rozszerzenia osłonki mielinowej w jej przekroju poprzecznym. Oczywiste jest również, że każdy z kolejnych zwojów spirali zwiększa swój rozmiar na długości aksonu wraz ze wzrostem liczby zwojów. Jednak nie jest jasne, czy wzrost długości osłonki mielinowej można wytłumaczyć wyłącznie wzrostem długości aksonu pokrytego przez każdy kolejny obrót spirali, jak wyjaśniono wcześniej. Na styku dwóch komórek Schwanna wzdłuż aksonu kierunki blaszkowatego zwisu zakończeń mieliny mają przeciwny sens. To skrzyżowanie, sąsiadujące z komórkami Schwanna, stanowi region wyznaczony jako węzeł Ranvier.
Wczesne stadia
Naukowcy udowadniają, że w rozwijającym się OUN Nav1.2 jest początkowo wyrażany we wszystkich tworzących się węzłach Ranvier. Po dojrzewaniu węzłowy Nav1.3 jest regulowany w dół i zastępowany przez Nav1.6. Naz1.2 jest również wyrażany podczas tworzenia węzła PNS, co sugeruje, że przełączanie podtypów kanałów Nav jest zjawiskiem ogólnym w OUN i PNS. W tym samym badaniu wykazano, że Nav1.6 i Nav1.2 kolokalizują się w wielu węzłach Ranvier podczas wczesnej mielinizacji. Doprowadziło to również do sugestii, że wczesne klastry kanałów Nav1.2 i Nav1.6 mają stać się później węzłami Ranviera. Doniesiono również, że neurofascyna jest jednym z pierwszych białek, które gromadzą się w nowo tworzących się węzłach Ranviera. Stwierdzono również, że zapewniają miejsce nukleacji do przyłączenia ankyryny G, kanałów Nav i innych białek. Niedawna identyfikacja gliomedyny, białka mikrokosmków komórek Schwanna, jako prawdopodobnego partnera wiążącego neurofascyny aksonów, dostarcza istotnych dowodów na znaczenie tego białka w rekrutacji kanałów Nav do węzłów Ranviera. Ponadto Lambert i in. oraz Eshed i in. wskazuje również, że neurofascyna gromadzi się przed kanałami Nav i prawdopodobnie odgrywa kluczową rolę w najwcześniejszych zdarzeniach związanych z węzłem formacji Ranviera. W ten sposób może istnieć wiele mechanizmów i działać synergistycznie, aby ułatwić grupowanie kanałów Nav w węzłach Ranvier.
Formacja węzłowa
Pierwszym zdarzeniem wydaje się być akumulacja cząsteczek adhezyjnych komórek, takich jak NF186 lub NrCAM. Wewnątrzkomórkowe regiony tych cząsteczek adhezji komórkowej oddziałują z ankyryną G, która służy jako kotwica dla kanałów sodowych. W tym samym czasie, okołoaksonalne rozszerzenie komórki glejowej owija się wokół aksonu, dając początek regionom paranodalnym. Ten ruch wzdłuż aksonu znacząco przyczynia się do ogólnego tworzenia węzłów Ranviera, umożliwiając półwęzłom utworzonym na krawędziach sąsiednich komórek glejowych połączenie się w kompletne węzły. W paranodach tworzą się połączenia podobne do septa z wzbogaceniem NF155 w glejowe pętle paranodalne. Bezpośrednio po wczesnym zróżnicowaniu regionów węzłowych i przywęzłowych, kanały potasowe, Caspr2 i TAG1 gromadzą się w obszarach przywęzłowych. Ta akumulacja zbiega się bezpośrednio z tworzeniem zwartej mieliny . W dojrzałych regionach węzłowych interakcje z białkami wewnątrzkomórkowymi wydają się kluczowe dla stabilności wszystkich regionów węzłowych. W OUN oligodendrocyty nie posiadają mikrokosmków, ale wydają się zdolne do inicjowania grupowania niektórych białek aksonalnych poprzez wydzielane czynniki. Połączone efekty tych czynników z późniejszymi ruchami generowanymi przez owinięcie rozszerzenia okołoaksonalnego oligodendrocytów mogą wyjaśniać organizację węzłów OUN Ranviera.
Funkcjonować
Potencjał czynnościowy
Potencjału działania jest kolec zarówno dodatniej i ujemnej jonowej wyładowania, które przemieszcza się wzdłuż membrany komórki. Tworzenie i przewodzenie potencjałów czynnościowych stanowi podstawowy środek komunikacji w układzie nerwowym. Potencjały czynnościowe reprezentują szybkie odwrócenie napięcia w błonie plazmatycznej aksonów. W tych szybkich odwróceniach pośredniczą kanały jonowe bramkowane napięciem znajdujące się w błonie komórkowej . Potencjał czynnościowy przemieszcza się z jednego miejsca w komórce do drugiego, ale przepływ jonów przez błonę zachodzi tylko w węzłach Ranviera. W rezultacie sygnał potencjału czynnościowego przeskakuje wzdłuż aksonu, od węzła do węzła, zamiast rozchodzić się gładko, jak to ma miejsce w aksonach pozbawionych osłonki mielinowej. Grupowanie bramkowanych napięciem kanałów jonowych sodu i potasu w węzłach umożliwia takie zachowanie.
Przewodnictwo solne
Ponieważ akson może być niemielinizowany lub zmielinizowany, potencjał czynnościowy ma dwie metody przemieszczania się w dół aksonu. Metody te są określane jako przewodnictwo ciągłe dla aksonów niezmielinizowanych i przewodnictwo solacyjne dla aksonów zmielinizowanych. Przewodnictwo solne definiuje się jako potencjał czynnościowy poruszający się w dyskretnych skokach w dół po zmielinizowanym aksonie.
Proces ten jest przedstawiony jako ładunek pasywnie rozprzestrzeniający się do następnego węzła Ranviera, aby zdepolaryzować go do progu, który następnie uruchomi potencjał czynnościowy w tym regionie, który następnie biernie rozprzestrzeni się do następnego węzła i tak dalej.
Przewodzenie słone ma jedną przewagę nad przewodnictwem, które występuje wzdłuż aksonu bez osłonek mielinowych. Oznacza to, że zwiększona prędkość zapewniana przez ten tryb przewodzenia zapewnia szybszą interakcję między neuronami. Z drugiej strony, w zależności od średniej szybkości odpalania neuronu, obliczenia pokazują, że energetyczny koszt utrzymania potencjału spoczynkowego oligodendrocytów może przewyższyć oszczędności energii potencjałów czynnościowych. Zatem mielinizacja aksonów niekoniecznie oszczędza energię.
Regulacja formacji
Regulacja paranodowa poprzez akumulację mitochondriów
Mitochondria i inne organelle błoniaste są normalnie wzbogacone w region PNP aksonów zmielinizowanych obwodowo, zwłaszcza aksonów dużego kalibru. Faktyczna fizjologiczna rola tej akumulacji i czynniki ją regulujące nie są zrozumiałe; wiadomo jednak, że mitochondria są zwykle obecne w obszarach komórki, które wykazują duże zapotrzebowanie na energię. W tych samych regionach rozumie się również, że zawierają stożki wzrostu, zakończenia synaptyczne oraz miejsca inicjacji i regeneracji potencjału czynnościowego, takie jak węzły Ranvier. W zakończeniach synaptycznych mitochondria wytwarzają ATP potrzebne do mobilizacji pęcherzyków do neurotransmisji. W węzłach Ranviera mitochondria pełnią ważną rolę w przewodzeniu impulsów, wytwarzając ATP, który jest niezbędny do utrzymania aktywności wymagających energii pomp jonowych. Przemawiając za tym faktem, około pięć razy więcej mitochondriów jest obecnych w aksoplazmie PNP dużych aksonów obwodowych niż w odpowiednich obszarach międzywęzłowych tych włókien.
Regulacja węzłowa
Przez αII-Spectrin
Przewodzenie soli w zmielinizowanych aksonach wymaga organizacji węzłów Ranviera, podczas gdy kanały sodowe bramkowane napięciem są gęsto zaludnione. Badania pokazują, że αII-Spectrin, składnik cytoszkieletu, jest wzbogacony w węzłach i paranodach we wczesnych stadiach, a wraz z dojrzewaniem węzłów ekspresja tej cząsteczki zanika. Udowodniono również, że αII-Spectrin w cytoszkielecie aksonalnym jest absolutnie niezbędna do stabilizacji klasterów kanałów sodowych i uporządkowania dojrzałego węzła Ranviera.
Możliwa regulacja poprzez cząsteczkę rozpoznającą OMgp
Wykazano wcześniej, że OMgp (glikoproteina mielinowa oligodendrocytów) gromadzi się w węzłach Ranviera i może regulować architekturę paranodalną, długość węzła i kiełkowanie aksonów w węzłach. Jednak badanie uzupełniające wykazało, że przeciwciało używane wcześniej do identyfikacji OMgp w węzłach reaguje krzyżowo z innym komponentem wzbogaconym w węzeł, wersican V2, i że OMgp nie jest wymagane dla integralności węzłów i paranod, co jest sprzeczne z wcześniej zgłoszoną lokalizacją i proponowanymi funkcjami OMgp w węzłach.
Znaczenie kliniczne
Białka w tych pobudliwych domenach neuronu po uszkodzeniu mogą powodować zaburzenia poznawcze i różne dolegliwości neuropatyczne.
Historia
Osłonki mielinowej nerwów długich zostało odkryte i nazwane przez niemieckiego patologiczny anatoma Rudolf Virchow w 1854 roku francuski anatom i patolog Louis-Antoine Ranvier później odkryto węzły lub luk w osłonki mielinowej, która teraz nosi jego imię. Urodzony w Lyonie Ranvier był jednym z najwybitniejszych histologów końca XIX wieku. Ranvier porzucił badania patologiczne w 1867 roku i został asystentem fizjologa Claude'a Bernarda . Był przewodniczącym General Anatomy w Collège de France w 1875 roku.
Jego wyrafinowane techniki histologiczne oraz praca nad uszkodzonymi i normalnymi włóknami nerwowymi zyskały światową sławę. Jego obserwacje dotyczące węzłów włókienniczych oraz degeneracji i regeneracji ciętych włókien miały ogromny wpływ na paryską neurologię w Salpêtrière . Wkrótce potem odkrył luki w osłonkach włókien nerwowych, które później nazwano Węzłami Ranviera. Odkrycie to doprowadziło później Ranviera do starannego badania histologicznego osłonek mielinowych i komórek Schwanna.
Dodatkowe obrazy
Zobacz też
Bibliografia
Zewnętrzne linki
- Baza danych skoncentrowana na komórkach — węzeł Ranvier
- Zdjęcie anatomiczne: nerw/pns/nerve2/nerve5 - Comparative Organology at University of California, Davis – „PNS, nerw (LM, Medium)”




