Spektroskopia magnetycznego rezonansu jądrowego - Nuclear magnetic resonance spectroscopy
Spektroskopia magnetycznego rezonansu jądrowego , najczęściej znana jako spektroskopia NMR lub spektroskopia rezonansu magnetycznego ( MRS ), to technika spektroskopowa służąca do obserwacji lokalnych pól magnetycznych wokół jąder atomowych . Próbkę umieszcza się w polu magnetycznym, a sygnał NMR wytwarzany jest poprzez wzbudzenie próbki jądra falami radiowymi do magnetycznego rezonansu jądrowego, który jest wykrywany przez wrażliwe odbiorniki radiowe. Wewnątrzcząsteczkowe pole magnetyczne wokół atomu w cząsteczce zmienia częstotliwość rezonansową, dając w ten sposób dostęp do szczegółów struktury elektronowej cząsteczki i jej poszczególnych grup funkcyjnych. Ponieważ pola te są unikalne lub wysoce charakterystyczne dla poszczególnych związków, we współczesnej praktyce chemii organicznej spektroskopia NMR jest ostateczną metodą identyfikacji jednocząsteczkowych związków organicznych .
Zasada NMR zwykle obejmuje trzy kolejne etapy:
- Wyrównanie (polaryzacja) magnetycznych spinów jądrowych w przyłożonym, stałym polu magnetycznym B 0 .
- Zakłócenie tego wyrównania spinów jądrowych przez słabe oscylujące pole magnetyczne , zwykle nazywane impulsem o częstotliwości radiowej (RF).
- Detekcja i analiza fal elektromagnetycznych emitowanych przez jądra próbki w wyniku tego zaburzenia.
Podobnie biochemicy używają NMR do identyfikacji białek i innych złożonych cząsteczek. Oprócz identyfikacji, spektroskopia NMR dostarcza szczegółowych informacji o strukturze, dynamice, stanie reakcji i środowisku chemicznym cząsteczek. Najpopularniejszymi typami NMR są spektroskopia protonowa i węglowa-13 NMR , ale można ją zastosować do każdego rodzaju próbki, która zawiera jądra posiadające spin .
Widma NMR są unikalne, dobrze rozdzielone, dające się analizować i często wysoce przewidywalne dla małych cząsteczek . Różne grupy funkcyjne są oczywiście rozróżnialne, a identyczne grupy funkcyjne z różnymi sąsiednimi podstawnikami nadal dają rozróżnialne sygnały. NMR w dużej mierze zastąpił tradycyjne testy chemii mokrej , takie jak odczynniki barwne lub typowa chromatografia do identyfikacji. Wadą jest to, że wymagana jest stosunkowo duża ilość, 2-50 mg, oczyszczonej substancji, chociaż można ją odzyskać poprzez obróbkę. Najlepiej, aby próbka była rozpuszczona w rozpuszczalniku, ponieważ analiza NMR ciał stałych wymaga dedykowanej maszyny przędzalniczej pod magicznym kątem i może nie dawać równie dobrze rozdzielczych widm. Skala czasowa NMR jest stosunkowo długa, przez co nie nadaje się do obserwacji szybkich zjawisk, wytwarzając jedynie uśrednione widmo. Chociaż w widmie NMR pojawiają się duże ilości zanieczyszczeń, istnieją lepsze metody wykrywania zanieczyszczeń, ponieważ NMR jest z natury niezbyt czuły – chociaż przy wyższych częstotliwościach czułość jest wyższa.
Spektroskopia korelacyjna jest rozwinięciem zwykłego NMR. W dwuwymiarowym NMR emisja koncentruje się wokół jednej częstotliwości i obserwuje się skorelowane rezonanse. Pozwala to na identyfikację sąsiednich podstawników obserwowanej grupy funkcyjnej, umożliwiając jednoznaczną identyfikację rezonansów. Istnieją również bardziej złożone metody 3D i 4D oraz różnorodne metody przeznaczone do tłumienia lub wzmacniania określonych rodzajów rezonansów. W spektroskopii jądrowej z efektem Overhausera (NOE) obserwuje się relaksację rezonansów. Ponieważ NOE zależy od bliskości jąder, ilościowe określenie NOE dla każdego jądra pozwala na skonstruowanie trójwymiarowego modelu cząsteczki.

Spektrometry NMR są stosunkowo drogie; uczelnie zazwyczaj je mają, ale rzadziej w prywatnych firmach. W latach 2000-2015 spektrometr NMR kosztował około 500 000 - 5 mln USD . Nowoczesne spektrometry NMR mają bardzo silny, duży i drogi magnes nadprzewodzący chłodzony ciekłym helem , ponieważ rozdzielczość zależy bezpośrednio od natężenia pola magnetycznego. Dostępne są również tańsze maszyny z magnesami trwałymi i niższą rozdzielczością, które nadal zapewniają wystarczającą wydajność w niektórych zastosowaniach, takich jak monitorowanie reakcji i szybkie sprawdzanie próbek. Istnieją nawet laboratoryjne spektrometry magnetycznego rezonansu jądrowego . NMR można zaobserwować w polach magnetycznych mniejszych niż militesla. NMR o niskiej rozdzielczości wytwarza szersze piki, które mogą łatwo nakładać się na siebie, powodując problemy w rozwiązywaniu złożonych struktur. Zastosowanie pól magnetycznych o wyższej sile zapewnia wyraźną rozdzielczość pików i jest standardem w przemyśle.
Historia
Za odkrycie NMR należy się Isidor Isaac Rabi , który otrzymał Nagrodę Nobla w dziedzinie fizyki w 1944 roku. Grupa Purcella na Uniwersytecie Harvarda i grupa Blocha na Uniwersytecie Stanforda niezależnie opracowały spektroskopię NMR pod koniec lat 40. i na początku lat 50. XX wieku. Edward Mills Purcell i Felix Bloch otrzymali nagrodę Nobla w dziedzinie fizyki z 1952 r. za swoje odkrycia.
Podstawowe techniki NMR

Częstotliwość rezonansowa
Po umieszczeniu w polu magnetycznym jądra aktywne NMR (takie jak 1 H lub 13 C) pochłaniają promieniowanie elektromagnetyczne o częstotliwości charakterystycznej dla izotopu . Częstotliwość rezonansowa, energia pochłanianego promieniowania oraz natężenie sygnału są proporcjonalne do natężenia pola magnetycznego. Na przykład w polu magnetycznym 21 Tesli jądra wodoru (powszechnie nazywane protonami) rezonują przy 900 MHz. Powszechnie określa się magnes 21 T jako magnes 900 MHz, ponieważ wodór jest najczęściej wykrywanym jądrem, jednak różne jądra będą rezonować z różnymi częstotliwościami przy tym natężeniu pola, proporcjonalnie do ich jądrowych momentów magnetycznych .
Obsługa próbek
Spektrometr NMR zazwyczaj składa się z wirującego uchwytu próbki wewnątrz bardzo silnego magnesu, emitera częstotliwości radiowych i odbiornika z sondą (zespołu anteny), który wchodzi do wnętrza magnesu, aby otoczyć próbkę, opcjonalnie cewek gradientowych do pomiarów dyfuzji oraz elektronikę do sterowania systemem. Obracanie próbki jest zwykle niezbędne do uśrednienia ruchu dyfuzyjnego, jednak niektóre eksperymenty wymagają nieruchomej próbki, gdy ruch roztworu jest ważną zmienną. Na przykład pomiary stałych dyfuzji ( spektroskopia uporządkowana przez dyfuzję lub DOSY) są wykonywane przy użyciu stacjonarnej próbki z odwirowaniem, a komory przepływowe mogą być używane do analizy przepływów procesowych w trybie online.
Rozpuszczalniki deuterowane
Ogromna większość cząsteczek w roztworze to cząsteczki rozpuszczalnika, a większość zwykłych rozpuszczalników to węglowodory, a więc zawiera protony aktywne w NMR. Aby uniknąć wykrywania tylko sygnałów z atomów wodoru rozpuszczalnika, stosuje się rozpuszczalniki deuterowane, w których ponad 99% protonów jest zastąpionych deuterem (wodór-2). Najpowszechniej stosowanym rozpuszczalnikiem jest deuterowany deuterochloroformie (CDCI 3 ), chociaż inne rozpuszczalniki mogą być używane z różnych powodów, takich jak rozpuszczalność w próbce, pojawia się potrzeba sterowania wiązania wodorowe lub topnienia lub temperatura wrzenia. Przesunięcia chemiczne cząsteczki zmienią się nieznacznie między rozpuszczalnikami, a zastosowany rozpuszczalnik będzie prawie zawsze zgłaszany z przesunięciami chemicznymi. Widma NMR są często kalibrowane względem znanego resztkowego piku protonowego rozpuszczalnika zamiast dodanego tetrametylosilanu.
Podkładka i blokada
Aby wykryć bardzo małe przesunięcia częstotliwości spowodowane magnetycznym rezonansem jądrowym, przyłożone pole magnetyczne musi być stałe w całej objętości próbki. Spektrometry NMR o wysokiej rozdzielczości wykorzystują podkładki do dostosowania jednorodności pola magnetycznego do części na miliard ( ppb ) w objętości kilku centymetrów sześciennych. Aby wykryć i skompensować niejednorodność i dryf pola magnetycznego, spektrometr utrzymuje „blokadę” częstotliwości deuteru rozpuszczalnika z oddzielną jednostką blokującą, która jest zasadniczo dodatkowym nadajnikiem i procesorem RF dostrojonym do jądra blokującego (deuter) a nie jądra badanej próbki. W nowoczesnych spektrometrach NMR podkładka jest regulowana automatycznie, choć w niektórych przypadkach operator musi ręcznie zoptymalizować parametry podkładek, aby uzyskać najlepszą możliwą rozdzielczość
Akwizycja widm
Po wzbudzeniu próbki impulsem o częstotliwości radiowej (60-1000 MHz) uzyskuje się odpowiedź magnetycznego rezonansu jądrowego - swobodny zanik indukcyjny (FID). Jest to bardzo słaby sygnał i wymaga czułych odbiorników radiowych do odbioru. Fourier transform prowadzi się w celu wyodrębnienia widmo w dziedzinie częstotliwości z surowego dziedzinie czasu FID. Widmo z pojedynczego FID ma niski stosunek sygnału do szumu , ale łatwo się poprawia wraz z uśrednieniem powtarzanych akwizycji. Dobry 1 H NMR można uzyskać z 16 powtórzeniami, co zajmuje tylko kilka minut. Jednak dla pierwiastków cięższych od wodoru czas relaksacji jest dość długi, np. około 8 sekund dla 13 C. Zatem akwizycja ilościowych widm pierwiastków ciężkich może być czasochłonna, trwająca od kilkudziesięciu minut do godzin.
Po impulsie jądra są wzbudzane średnio pod pewnym kątem w stosunku do pola magnetycznego spektrometru. Zasięg wzbudzenia można kontrolować za pomocą szerokości impulsu, zwykle ca. 3-8 µs dla optymalnego impulsu 90°. Szerokość impulsu można określić, wykreślając intensywność (ze znakiem) w funkcji szerokości impulsu. Podąża za krzywą sinusoidalną i odpowiednio zmienia znak przy szerokościach impulsów odpowiadających impulsom 180° i 360°.
Czasy zaniku wzbudzenia, zwykle mierzone w sekundach, zależą od efektywności relaksacji, która jest szybsza dla jąder lżejszych i ciał stałych, wolniejsza dla jąder cięższych i roztworów, a w gazach może być bardzo długa. Jeśli drugi impuls wzbudzenia zostanie wysłany przedwcześnie przed zakończeniem relaksacji, średni wektor namagnesowania nie zanika do stanu podstawowego, co wpływa na siłę sygnału w nieprzewidywalny sposób. W praktyce obszary pików nie są wtedy proporcjonalne do stechiometrii; tylko obecność, ale nie ilość grup funkcyjnych jest możliwa do odróżnienia. Eksperyment odzyskiwania inwersji można przeprowadzić w celu określenia czasu relaksacji, a tym samym wymaganego opóźnienia między impulsami. Wysyłany jest impuls 180°, regulowane opóźnienie i impuls 90°. Gdy impuls 90° dokładnie anuluje sygnał, opóźnienie odpowiada czasowi potrzebnemu na relaksację 90°. Odzyskiwanie inwersji jest opłacalne w przypadku ilościowych 13 C, 2D i innych czasochłonnych eksperymentów.
Przesunięcie chemiczne
Wirujący ładunek generuje pole magnetyczne, które powoduje moment magnetyczny proporcjonalny do spinu. W obecności zewnętrznego pola magnetycznego istnieją dwa stany spinu (dla jądra o spinie 1/2): jeden spin w górę, drugi spin w dół, gdzie jeden zrównuje się z polem magnetycznym, a drugi jest mu przeciwny. Różnica energii (ΔE) między dwoma stanami spinu wzrasta wraz ze wzrostem natężenia pola, ale różnica ta jest zwykle bardzo mała, co prowadzi do zapotrzebowania na silne magnesy NMR (1-20 T dla nowoczesnych instrumentów NMR). Napromieniowanie próbki energią odpowiadającą dokładnemu rozdzieleniu stanu spinowego określonego zestawu jąder spowoduje wzbudzenie zestawu jąder w stanie o niższej energii do stanu o wyższej energii.
W przypadku jąder o spinie 1/2 różnica energii między dwoma stanami spinu przy danej sile pola magnetycznego jest proporcjonalna do ich momentu magnetycznego. Jednak nawet jeśli wszystkie protony mają takie same momenty magnetyczne, nie dają sygnałów rezonansowych o tych samych wartościach częstotliwości. Ta różnica wynika z różnych środowisk elektronicznych jądra będącego przedmiotem zainteresowania. Po przyłożeniu zewnętrznego pola magnetycznego elektrony te poruszają się w odpowiedzi na pole i generują lokalne pola magnetyczne, które przeciwstawiają się znacznie silniejszemu przyłożonemu polu. To lokalne pole w ten sposób „osłania” proton przed przyłożonym polem magnetycznym, które w związku z tym musi zostać zwiększone, aby uzyskać rezonans (pochłanianie energii w.cz.). Takie przyrosty są bardzo małe, zwykle w częściach na milion (ppm). Na przykład pik protonu z aldehydu jest przesunięty o ok. 10 ppm w porównaniu z pikem węglowodorowym, ponieważ jako grupa elektronoakceptorowa karbonyl odsłania proton przez zmniejszenie lokalnej gęstości elektronowej. Różnica między 2,3487 T a 2,3488 T wynosi zatem około 42 ppm. Jednak skala częstotliwości jest powszechnie używana do oznaczania sygnałów NMR, mimo że spektrometr może działać poprzez przemiatanie pola magnetycznego, a zatem 42 ppm to 4200 Hz dla częstotliwości odniesienia 100 MHz (rf).
Jednak biorąc pod uwagę, że lokalizacja różnych sygnałów NMR zależy od natężenia zewnętrznego pola magnetycznego i częstotliwości odniesienia, sygnały są zwykle podawane w odniesieniu do sygnału odniesienia, zwykle TMS ( tetrametylosilan ). Dodatkowo, ponieważ rozkład sygnałów NMR jest zależny od pola, częstotliwości te są dzielone przez częstotliwość spektrometru. Ponieważ jednak dzielimy Hz przez MHz, wynikowa liczba byłaby zbyt mała i dlatego mnożymy ją przez milion. Ta operacja daje zatem numer lokalizatora zwany „przesunięciem chemicznym” z jednostkami części na milion. Ogólnie rzecz biorąc, przesunięcia chemiczne dla protonów są wysoce przewidywalne, ponieważ przesunięcia są głównie determinowane przez prostsze efekty ekranowania (gęstość elektronów), ale przesunięcia chemiczne dla wielu cięższych jąder są silniej uzależnione od innych czynników, w tym stanów wzbudzonych (wkład „paramagnetyczny” w ekranowanie napinacz).
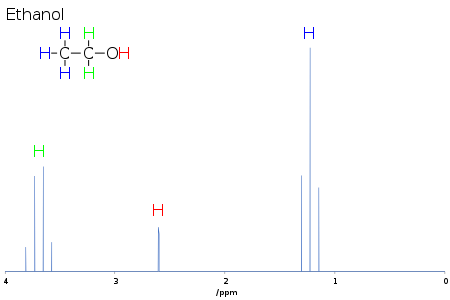
Przesunięcie chemiczne dostarcza informacji o strukturze cząsteczki. Konwersja surowych danych na te informacje nazywana jest przypisywaniem widma. Na przykład, do 1 widmie 'H-NMR w etanolu (CH 3 CH 2 OH), można by oczekiwać, sygnały w każdym z trzech określonych przesunięć chemicznych: jeden dla C H 3 grupy, jeden dla C H 2 grupy, a jeden z O H grupy. Typowa CH 3 grupa ma przesunięcie około 1 ppm, CH 2 dołączony do OH ma przesunięcie o około 4 ppm, grupę OH ma nigdzie przejście od 2-6 ppm w zależności od stosowanego rozpuszczalnika i ilości wiązań wodorowych . Podczas gdy atom O odciąga gęstość elektronową od dołączonego H poprzez ich wzajemne wiązanie sigma, pary samotnych elektronów na O kąpią H w ich efekcie ekranowania.
W paramagnetycznej spektroskopii NMR pomiary przeprowadzane są na próbkach paramagnetycznych. Paramagnetyzm powoduje bardzo różnorodne przesunięcia chemiczne. W spektroskopii 1 H NMR zakres przesunięcia chemicznego może sięgać nawet tysięcy ppm.
Z powodu ruchu molekularnego w temperaturze pokojowej, trzy protony metylowe osiągają średnią wartość podczas eksperymentu NMR (co zwykle wymaga kilku ms ). Te protony ulegają degeneracji i tworzą pik przy tym samym przesunięciu chemicznym.
Kształt i powierzchnia pików są również wskaźnikami budowy chemicznej. W powyższym przykładzie, widma protonowego etanol-CH 3 pik ma trzy razy obszar piku OH. Podobnie CH 2 szczytowy być dwukrotnie większa powierzchnia piku OH ale tylko 2/3 obszar CH 3 piku.
Oprogramowanie umożliwia analizę natężenia sygnału pików, które w warunkach optymalnej relaksacji korelują z liczbą protonów tego typu. Analiza natężenia sygnału odbywa się poprzez całkowanie — matematyczny proces obliczania powierzchni pod krzywą. Analityk musi zintegrować szczyt i nie mierzyć jego wysokości, ponieważ piki również mają szerokość — a zatem jego rozmiar zależy od jego powierzchni, a nie od wysokości. Należy jednak wspomnieć, że liczba protonów lub innych obserwowanych jąder jest proporcjonalna tylko do intensywności lub całki sygnału NMR w najprostszych jednowymiarowych eksperymentach NMR. W bardziej skomplikowanych eksperymentach, na przykład eksperymentach zwykle stosowanych do uzyskania widm węgla-13 NMR, całka sygnałów zależy od szybkości relaksacji jądra oraz jego skalarnych i dipolarnych stałych sprzężenia. Bardzo często czynniki te są słabo poznane - dlatego całka sygnału NMR jest bardzo trudna do interpretacji w bardziej skomplikowanych eksperymentach NMR.
Złącze J
| Wielość | Współczynnik intensywności |
|---|---|
| Podkoszulek (y) | 1 |
| Dublet (d) | 1:1 |
| Trójka (t) | 1:2:1 |
| Kwartet (q) | 1:3:3:1 |
| Kwintet | 1:4:6:4:1 |
| Sekstet | 1:5:10:10:5:1 |
| Septet | 1:6:15:20:15:6:1 |
Niektóre z najbardziej przydatnych informacji do określenia struktury w jednowymiarowym widmie NMR pochodzą ze sprzężenia J lub sprzężenia skalarnego (szczególny przypadek sprzężenia spinowo-spinowego ) między aktywnymi jądrami NMR. To sprzężenie wynika z interakcji różnych stanów spinu poprzez wiązania chemiczne cząsteczki i powoduje rozszczepienie sygnałów NMR. W przypadku protonu lokalne pole magnetyczne jest nieco inne w zależności od tego, czy sąsiednie jądro jest skierowane w stronę pola magnetycznego spektrometru, czy w przeciwną stronę, co powoduje powstanie dwóch sygnałów na proton zamiast jednego. Te wzorce podziału mogą być złożone lub proste, a także mogą być łatwo zinterpretowane lub zwodnicze. To sprzężenie zapewnia szczegółowy wgląd w połączenia atomów w cząsteczce.
Sprzężenie z n równoważnymi jądrami (spin ½) dzieli sygnał na multiplet n +1 ze stosunkami intensywności następującymi po trójkącie Pascala, jak opisano po prawej stronie. Sprzęganie z dodatkowymi spinami doprowadzi do dalszego rozszczepienia każdego składnika multipletu, np. sprzężenie z dwoma jądrami o różnych spinach ½ o znacząco różnych stałych sprzężenia doprowadzi do dubletu dubletów (skrót: dd). Zauważ, że sprzężenie między jądrami, które są chemicznie równoważne (to znaczy mają takie samo przesunięcie chemiczne) nie ma wpływu na widma NMR, a sprzężenia między jądrami, które są odległe (zwykle więcej niż 3 wiązania dla protonów w elastycznych cząsteczkach) są zwykle zbyt małe spowodować obserwowalne rozszczepienia. Sprzężenia dalekiego zasięgu na więcej niż trzech wiązaniach można często zaobserwować w związkach cyklicznych i aromatycznych , co prowadzi do bardziej złożonych wzorców rozszczepienia.
Na przykład, w widmie protonowego w etanolu opisano powyżej, CH 3 grupa jest podzielona na trioli o stosunku intensywności od 1: 2: 1 przez dwa sąsiadujące CH 2 protony. Podobnie, CH 2 jest podzielony na kwartet o stosunku intensywności od 1: 3: 3: 1 przez trzy sąsiednie CH 3 protony. W zasadzie, dwa CH 2 protony byłby również podział ponownie do dubletu z wytworzeniem dublet kwartetów przez proton hydroksylu, lecz wymianie międzycząsteczkowej kwasowego protonu hydroksylową często powoduje straty sprzęgania informacji.
Sprzęganie z dowolnymi jądrami o spinie 1/2, takim jak fosfor-31 lub fluor-19, działa w ten sposób (chociaż wielkości stałych sprzężenia mogą być bardzo różne). Ale wzory podziału różnią się od tych opisanych powyżej dla jąder o spinie większym niż ½, ponieważ spinowa liczba kwantowa ma więcej niż dwie możliwe wartości. Na przykład sprzężenie z deuterem (jądro o spinie 1) dzieli sygnał na tryplet 1:1:1, ponieważ spin 1 ma trzy stany spinu. Podobnie jądro o spinie 3/2, takie jak 35 Cl, dzieli sygnał na kwartet 1:1:1:1 i tak dalej.
Sprzężenie połączone z przesunięciem chemicznym (i integracją protonów) mówi nam nie tylko o środowisku chemicznym jąder, ale także o liczbie sąsiednich jąder aktywnych w NMR w cząsteczce. W bardziej złożonych widmach z wieloma pikami przy podobnych przesunięciach chemicznych lub w widmach jąder innych niż wodór, sprzęganie jest często jedynym sposobem na rozróżnienie różnych jąder.

Sprzęgło drugiego rzędu (lub silne)
Powyższy opis zakłada, że stała sprzężenia jest mała w porównaniu z różnicą częstotliwości NMR pomiędzy nierównoważnymi spinami. Jeśli separacja przesunięcia maleje (lub wzrasta siła sprzężenia), wzorce intensywności multipletów są najpierw zniekształcane, a następnie stają się bardziej złożone i trudniejsze do analizy (zwłaszcza jeśli zaangażowane są więcej niż dwa spiny). Intensyfikację niektórych pików w multiplecie osiąga się kosztem pozostałych, które czasami prawie znikają w szumie tła, chociaż zintegrowany obszar pod pikami pozostaje stały. Jednak w większości wysokopolowych NMR zniekształcenia są zwykle niewielkie, a charakterystyczne zniekształcenia ( pokrycie ) mogą w rzeczywistości pomóc w identyfikacji powiązanych pików.
Niektóre z tych wzorców można przeanalizować metodą opublikowaną przez Johna Pople , choć ma ona ograniczony zakres.
Efekty drugiego rzędu zmniejszają się wraz ze wzrostem różnicy częstotliwości między multipletami, tak że widma NMR o wysokim polu (tj. o wysokiej częstotliwości) wykazują mniej zniekształceń niż widma o niższej częstotliwości. Wczesne widma przy 60 MHz były bardziej podatne na zniekształcenia niż widma z późniejszych maszyn zwykle pracujących przy częstotliwościach 200 MHz lub wyższych.
Ponadto, jak na rysunku po prawej, złącze J może być użyte do identyfikacji podstawienia orto-meta-para pierścienia. Sprzężenie orto jest najsilniejsze przy 15 Hz, Meta następuje ze średnią 2 Hz, a ostatecznie sprzężenie para jest zwykle nieistotne dla badań.
Nierówność magnetyczna
Bardziej subtelne efekty mogą wystąpić, jeśli spiny równoważne chemicznie (tj. jądra powiązane symetrią, a więc mające tę samą częstotliwość NMR) mają różne zależności sprzężenia z spinami zewnętrznymi. Spiny, które są chemicznie równoważne, ale nie są nie do odróżnienia (na podstawie ich relacji sprzężenia), są określane jako magnetycznie nierównoważne. Na przykład, miejsca 4H 1,2-dichlorobenzenu dzielą się na dwie chemicznie równoważne pary przez symetrię, ale pojedynczy członek jednej z par ma różne sprzężenia z spinami tworzącymi drugą parę. Nierównoważność magnetyczna może prowadzić do bardzo złożonych widm, które można analizować jedynie za pomocą modelowania obliczeniowego. Takie efekty są bardziej powszechne w widmach NMR układów aromatycznych i innych nieelastycznych, podczas gdy uśrednianie konformacyjne wokół wiązań C−C w elastycznych cząsteczkach ma tendencję do wyrównywania sprzężeń między protonami na sąsiednich węglach, zmniejszając problemy z nierównoważnością magnetyczną.
Spektroskopia korelacyjna
Spektroskopia korelacyjna jest jednym z kilku rodzajów dwuwymiarowej spektroskopii magnetycznego rezonansu jądrowego (NMR) lub 2D-NMR . Ten rodzaj doświadczenia NMR najlepiej znany pod skrótem , COSY . Inne typy dwuwymiarowego NMR obejmują spektroskopię J, spektroskopię wymienną (EXSY), spektroskopię jądrową Overhausera (NOESY), spektroskopię całkowitej korelacji (TOCSY) i eksperymenty z korelacją heterojądrową , takie jak HSQC , HMQC i HMBC . W spektroskopii korelacyjnej emisja koncentruje się na piku pojedynczego jądra; jeśli jego pole magnetyczne jest skorelowane z innym jądrem poprzez wiązanie przelotowe (COSY, HSQC itp.) lub sprzęganie w przestrzeni (NOE), odpowiedź można również wykryć na częstotliwości skorelowanego jądra. Widma dwuwymiarowe NMR dostarczają więcej informacji o cząsteczce niż jednowymiarowe widma NMR i są szczególnie przydatne w określaniu struktury cząsteczki , szczególnie w przypadku cząsteczek, które są zbyt skomplikowane, aby pracować z użyciem jednowymiarowego NMR. Pierwszy dwuwymiarowy eksperyment, COSY, zaproponował Jean Jeener, profesor na Université Libre de Bruxelles, w 1971 roku. Eksperyment ten został później wdrożony przez Waltera P. Aue, Enrico Bartholdiego i Richarda R. Ernsta , którzy opublikowali swoje prace w 1976.
Magnetyczny rezonans jądrowy w stanie stałym
Różnorodne warunki fizyczne nie pozwalają na badanie cząsteczek w roztworze, a jednocześnie nie innymi technikami spektroskopowymi na poziomie atomowym. W ośrodkach fazy stałej, takich jak kryształy, proszki mikrokrystaliczne, żele, roztwory anizotropowe itp., w zachowaniu układów spinu jądrowego dominuje zwłaszcza sprzężenie dipolarne i anizotropia przesunięcia chemicznego. W konwencjonalnej spektroskopii NMR w stanie roztworu te dodatkowe interakcje prowadziłyby do znacznego poszerzenia linii widmowych. Różnorodne techniki umożliwia stworzenie warunków wysokiej rozdzielczości, która może, przez co najmniej 13 C, widmo być porównywalne z widm NMR roztwór państw.
Dwie ważne koncepcje dotyczące wysokorozdzielczej spektroskopii NMR w stanie stałym to ograniczenie możliwej orientacji molekularnej poprzez orientację próbki oraz redukcja anizotropowych magnetycznych oddziaływań jądrowych poprzez wirowanie próbki. W tym drugim podejściu, szybkie wirowanie wokół magicznego kąta jest bardzo znaczącą metodą, gdy układ zawiera jądra o spinach 1/2. Prędkości wirowania ok. Stosowane są 20 kHz, co wymaga specjalnego sprzętu. W spektroskopii NMR stosuje się obecnie szereg technik pośrednich, z próbkami o częściowym wyrównaniu lub ograniczonej ruchliwości.
Zastosowania, w których występują efekty NMR w stanie stałym, są często związane z badaniami strukturalnymi białek błonowych, włókienek białkowych lub wszelkiego rodzaju polimerów oraz analizą chemiczną w chemii nieorganicznej, ale obejmują również zastosowania „egzotyczne”, takie jak liście roślin i ogniwa paliwowe. Na przykład Rahmani i in. badali wpływ ciśnienia i temperatury na samoorganizację struktur dwukomórkowych za pomocą spektroskopii deuterowej NMR.
Spektroskopia biomolekularna NMR
Białka
Wiele innowacji w spektroskopii NMR dotyczy spektroskopii białek NMR , ważnej techniki w biologii strukturalnej . Wspólnym celem tych badań jest uzyskanie trójwymiarowych struktur białka o wysokiej rozdzielczości, podobnych do tych, które można uzyskać za pomocą krystalografii rentgenowskiej . W przeciwieństwie do krystalografii rentgenowskiej, spektroskopia NMR jest zwykle ograniczona do białek mniejszych niż 35 kDa , chociaż rozwiązano większe struktury. Spektroskopia NMR jest często jedynym sposobem na uzyskanie informacji o wysokiej rozdzielczości na temat częściowo lub całkowicie niestrukturalnych białek . Jest to obecnie powszechne narzędzie do określania zależności aktywności konformacji, gdzie struktura przed i po interakcji, na przykład z kandydatem na lek, jest porównywana ze znaną jej aktywnością biochemiczną. Białka są o rząd wielkości większe niż małe cząsteczki organiczne omówione wcześniej w tym artykule, ale podstawowe techniki NMR i niektóre teorie NMR również mają zastosowanie. Ze względu na znacznie większą liczbę atomów obecnych w cząsteczce białka w porównaniu z małym związkiem organicznym, podstawowe widma 1D są przepełnione nakładającymi się sygnałami do tego stopnia, że bezpośrednia analiza spektralna staje się nie do utrzymania. W związku z tym opracowano wielowymiarowe (2, 3 lub 4D) eksperymenty, aby poradzić sobie z tym problemem. Aby ułatwić te eksperymenty, pożądane jest izotopowe znakowanie białka 13 C i 15 N, ponieważ dominujący naturalnie występujący izotop 12 C nie jest aktywny w NMR, a jądrowy moment kwadrupolowy dominującego naturalnie występującego izotopu 14 N uniemożliwia informacje o wysokiej rozdzielczości otrzymywany z tego izotopu azotu. Najważniejsza metoda stosowana do określania struktury białek wykorzystuje eksperymenty NOE do pomiaru odległości między atomami w cząsteczce. Następnie uzyskane odległości są wykorzystywane do generowania struktury 3D cząsteczki poprzez rozwiązanie problemu geometrii odległości . NMR można również wykorzystać do uzyskania informacji o dynamice i elastyczności konformacyjnej różnych regionów białka.
Kwasy nukleinowe
NMR kwasów nukleinowych to wykorzystanie spektroskopii NMR do uzyskania informacji o strukturze i dynamice kwasów polinukleinowych , takich jak DNA czy RNA . Od 2003 r. prawie połowa wszystkich znanych struktur RNA została określona za pomocą spektroskopii NMR.
Spektroskopia NMR kwasów nukleinowych i białek jest podobna, ale istnieją różnice. Kwasy nukleinowe mają mniejszy procent atomów wodoru, które są atomami zwykle obserwowanymi w spektroskopii NMR, a ponieważ podwójne helisy kwasu nukleinowego są sztywne i z grubsza liniowe, nie składają się na siebie, dając korelacje „dalekozasięgowe”. Rodzaje NMR zwykle wykonywane z kwasów nukleinowych są 1 H lub protonowy NMR , 13 NMR , 15 N-NMR , i 31 P-NMR . Prawie zawsze stosuje się dwuwymiarowe metody NMR , takie jak spektroskopia korelacyjna (COSY) i spektroskopia całkowitego transferu koherencji (TOCSY) do wykrywania sprzężeń jądrowych typu through-bond oraz spektroskopia jądrowa z efektem Overhausera (NOESY) do wykrywania sprzężeń między jądrami, które są bliskie wzajemnie w przestrzeni.
Parametry zaczerpnięte z widma, głównie piki krzyżowe NOESY i stałe sprzężenia , mogą być wykorzystane do określenia lokalnych cech strukturalnych, takich jak kąty wiązań glikozydowych, kąty dwuścienne (z wykorzystaniem równania Karplusa ) i konformacje pofałdowania cukru. W przypadku struktury na dużą skalę te lokalne parametry muszą być uzupełnione innymi założeniami lub modelami strukturalnymi, ponieważ błędy sumują się podczas przechodzenia przez podwójną helisę i w przeciwieństwie do białek, podwójna helisa nie ma zwartego wnętrza i nie składa się z powrotem. samo. NMR jest również przydatny do badania niestandardowych geometrii, takich jak wygięte helisy , parowanie zasad innych niż Watson-Crick i układanie współosiowe . Jest to szczególnie przydatne w badaniu struktury naturalnych oligonukleotydów RNA, które mają tendencję do przyjmowania złożonych konformacji, takich jak pętle łodygi i pseudowęzły . NMR jest również użyteczny do sondowania wiązania cząsteczek kwasu nukleinowego z innymi cząsteczkami, takimi jak białka lub leki, poprzez obserwację, które rezonanse są przesunięte po związaniu innej cząsteczki.
Węglowodany
Spektroskopia NMR węglowodanów odpowiada na pytania dotyczące struktury i konformacji węglowodanów . Analiza węglowodanów za pomocą 1H NMR jest trudna ze względu na ograniczoną zmienność grup funkcyjnych, co prowadzi do rezonansów 1H skoncentrowanych w wąskich pasmach widma NMR. Innymi słowy, występuje słaba dyspersja widmowa. Anomeryczne rezonanse protonowe są oddzielone od innych ze względu na fakt, że węgle anomeryczne zawierają dwa atomy tlenu. W przypadku mniejszych węglowodanów dyspersja rezonansów anomerycznych protonów ułatwia wykorzystanie jednowymiarowych eksperymentów TOCSY do badania całych układów spinowych poszczególnych reszt węglowodanowych.
Odkrycie narkotyków
Znajomość minimów energetycznych i rotacyjnych barier energetycznych małych cząsteczek w roztworze można znaleźć za pomocą NMR, np. patrząc odpowiednio na preferencje konformacyjne wolnych ligandów i dynamikę konformacyjną. Można to wykorzystać do kierowania hipotezami dotyczącymi projektowania leków, ponieważ wartości eksperymentalne i obliczone są porównywalne. Na przykład AstraZeneca wykorzystuje NMR do badań i rozwoju onkologii.
Zobacz też
- Geometria odległości
- Pole Ziemi NMR
- Spektroskopia rezonansu magnetycznego in vivo
- Funkcjonalna spektroskopia rezonansu magnetycznego mózgu
- Niskopolowy NMR
- Obrazowanie metodą rezonansu magnetycznego
- Krystalografia NMR
- Baza danych widm NMR
- Probówka NMR - zawiera sekcję dotyczącą przygotowania próbki
- Spektroskopia NMR stereoizomerów
- Spektroskopia magnetycznego rezonansu jądrowego białek
- Jądrowy rezonans kwadrupolowy
- Impulsowy magnes pola
- Spektroskopia indukcji jądrowej ze wzmocnieniem protonowym
- Relaks (NMR)
- Spektroskopia potrójnego rezonansu magnetycznego rezonansu jądrowego
- Pole zerowe NMR
Powiązane metody spektroskopii jądrowej :
Bibliografia
Dalsza lektura
- John D. Roberts (1959). Magnetyczny rezonans jądrowy: zastosowania w chemii organicznej . McGraw-Hill Book Company. Numer ISBN 9781258811662.
- JAPople ; WGSchneidera ; HJ Bernstein (1959). Magnetyczny rezonans jądrowy o wysokiej rozdzielczości . McGraw-Hill Book Company.
- A. Abragam (1961). Zasady magnetyzmu jądrowego . Prasa Clarendona. Numer ISBN 9780198201546.
- Charles P. Slichter (1963). Zasady rezonansu magnetycznego: na przykładach z fizyki ciała stałego . Harper i Row. Numer ISBN 9783540084761.
- Jana Emsleya ; Jamesa Feeneya; Lesliego Howarda Sutcliffe'a (1965). Spektroskopia magnetycznego rezonansu jądrowego o wysokiej rozdzielczości . Pergamon. Numer ISBN 9781483184081.
Linki zewnętrzne
- Jamesa Keelera. „Zrozumienie spektroskopii NMR” (przedruk na Uniwersytecie Cambridge ) . Uniwersytet Kalifornijski, Irvine . Źródło 2007-05-11 .
- Podstawy NMR — nietechniczny przegląd teorii, sprzętu i technik NMR autorstwa dr Josepha Hornaka, profesora chemii w RIT
- Biblioteki GAMMA i PyGAMMA — GAMMA to otwarta biblioteka C++ napisana do symulacji eksperymentów spektroskopii magnetycznego rezonansu jądrowego. PyGAMMA to nakładka Pythona na GAMMA.
- relax Oprogramowanie do analizy dynamiki NMR
- Vespa - VeSPA (Versatile Simulation, Pulses and Analysis) to darmowy pakiet oprogramowania składający się z trzech aplikacji Pythona. Te narzędzia oparte na graficznym interfejsie użytkownika służą do symulacji widmowej rezonansu magnetycznego (MR), projektowania impulsów RF oraz przetwarzania widmowego i analizy danych MR.



