Prolina - Proline
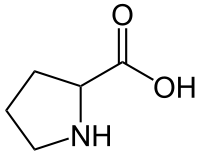
szkieletowa formuła proliny
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Nazwa IUPAC
Prolina
|
|||
|
Systematyczna nazwa IUPAC
Kwas pirolidyno-2-karboksylowy |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 80812 | |||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Karta informacyjna ECHA |
100.009.264 |
||
| Numer WE | |||
| 26927 | |||
| KEGG | |||
| Siatka | Prolina | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS | |||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
| Nieruchomości | |||
| C 5 H 9 N O 2 | |||
| Masa cząsteczkowa | 115,132 g·mol -1 | ||
| Wygląd zewnętrzny | Przezroczyste kryształy | ||
| Temperatura topnienia | 205 do 228 ° C (401 do 442 ° F; 478 do 501 K) (rozkłada się) | ||
| Rozpuszczalność | 1,5g/100g etanolu 19 st.C | ||
| log P | -0,06 | ||
| Kwasowość (p K a ) | 1,99 (karboksyl), 10,96 (amino) | ||
| Zagrożenia | |||
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych | ||
| Zwroty S (nieaktualne) | S22 , S24/25 | ||
| Strona z danymi uzupełniającymi | |||
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|||
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe-ciecz-gaz |
||
| UV , IR , NMR , MS | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Prolina (symbol Pro lub P ) to kwas organiczny zaliczany do aminokwasów proteinogennych (stosowany w biosyntezie białek ), chociaż nie zawiera grupy aminowej -NH
2ale jest raczej aminą drugorzędową . Azot amin drugorzędowych występuje w protonowanej formie NH 2 + w warunkach biologicznych, podczas gdy grupa karboksylowa jest w deprotonowanej formie −COO − . „Łańcuch boczny” z węgla α łączy się z azotem tworząc pętlę pirolidynową , klasyfikując go jako aminokwas alifatyczny . Nie jest niezbędny u ludzi, co oznacza, że organizm może go syntetyzować z nieistotnego aminokwasu L - glutaminian . Jest kodowany przez wszystkie kodony zaczynające się od CC (CCU, CCC, CCA i CCG).
Prolina jest jedynym drugorzędowym aminokwasem białkowym, który jest drugorzędową aminą, ponieważ atom azotu jest przyłączony zarówno do węgla α, jak i do łańcucha trzech węgli, które razem tworzą pięcioczłonowy pierścień.
Historia i etymologia
Prolinę po raz pierwszy wyizolował w 1900 roku Richard Willstätter, który uzyskał aminokwas podczas badania N-metyloproliny i zsyntetyzował prolinę w reakcji soli sodowej malonianu dietylu z 1,3-dibromopropanem . W następnym roku Emil Fischer wyizolował prolinę z kazeiny i produkty rozkładu estru γ-ftalimido-propylomalonowego oraz opublikował syntezę proliny z estru ftalimidopropylomalonowego.
Nazwa prolina pochodzi od pirolidyny , jednego z jej składników.
Biosynteza
Prolina jest biosyntetycznie pozyskiwana z aminokwasu L - glutaminian . Aldehyd glutaminianowy-5-semialdehydowy jest najpierw tworzony przez kinazę 5-glutaminianową (zależną od ATP) i dehydrogenazę 5-semialdehydową (która wymaga NADH lub NADPH). Może on następnie albo spontanicznie cyklizować się z wytworzeniem kwasu 1-pirolino-5-karboksylowego , który jest redukowany do proliny przez reduktazę pirolino-5-karboksylanową (przy użyciu NADH lub NADPH) lub przekształcany w ornitynę przez aminotransferazę ornityny , a następnie cyklizację przez cyklodeaminazę ornityny do tworzenia proliny.

Aktywność biologiczna
L -prolino stwierdzono, że działają jako słaby agonisty z receptorem glicyny i zarówno NMDA i nie-NMDA ( AMPA / kainianu ) jonotropowych receptorów glutaminianu . Zaproponowano, że jest to potencjalna endogenna ekscytotoksyna . W roślinach akumulacja proliny jest powszechną odpowiedzią fizjologiczną na różne stresy, ale jest również częścią programu rozwojowego w tkankach generatywnych (np. pyłku ).
Właściwości w strukturze białka
Charakterystyczna cykliczna struktura łańcucha bocznego proliny nadaje prolinie wyjątkową sztywność konformacyjną w porównaniu z innymi aminokwasami. Wpływa również na szybkość tworzenia wiązań peptydowych między proliną a innymi aminokwasami. Gdy prolina jest związana jako amid w wiązaniu peptydowym, jej azot nie jest związany z żadnym wodorem, co oznacza, że nie może działać jako donor wiązania wodorowego , ale może być akceptorem wiązania wodorowego.
Tworzenie wiązań peptydowych z nadchodzącym Pro-tRNA Pro jest znacznie wolniejsze niż w przypadku innych tRNA, co jest ogólną cechą N-alkiloaminokwasów. Tworzenie wiązania peptydowego jest również powolne między przychodzącym tRNA a łańcuchem kończącym się na prolinie; z tworzeniem wiązań prolina-prolina najwolniej ze wszystkich.
Wyjątkowa sztywność konformacyjna proliny wpływa na drugorzędową strukturę białek w pobliżu reszty proliny i może odpowiadać za wyższą częstość występowania proliny w białkach organizmów termofilnych . Strukturę drugorzędową białka można opisać za pomocą dwuściennych kątów φ, ψ i ω szkieletu białka. Cykliczna struktura łańcucha bocznego proliny blokuje kąt φ na około -65°.
Prolina działa jako destruktor struktury w środku regularnych elementów struktury drugorzędowej, takich jak alfa helisy i beta-kartki ; jednak prolina jest powszechnie znajdowana jako pierwsza reszta alfa helisy, a także w pasmach brzegowych arkuszy beta . Prolina jest również powszechnie spotykana w zwojach (inny rodzaj struktury drugorzędowej) i pomaga w tworzeniu zwojów beta. Może to wyjaśniać ciekawy fakt, że prolina jest zwykle wystawiona na działanie rozpuszczalnika, mimo że ma całkowicie alifatyczny łańcuch boczny.
Wiele proliny i / lub hydroxyprolines w rzędzie można utworzyć spiralę poliprolinopodobnej , dominującej strukturze drugorzędowej w kolagenie . Hydroksylację proliny przez hydroksylazy prolilowej (lub innych dodatków podstawnikami odciągającymi elektrony, takimi jak atom fluoru ) zwiększa stabilność konformacyjną kolagenu znacznie. Dlatego hydroksylacja proliny jest krytycznym procesem biochemicznym dla utrzymania tkanki łącznej wyższych organizmów. Ciężkie choroby, takie jak szkorbut, mogą wynikać z defektów tej hydroksylacji, np. mutacji w enzymie hydroksylazy prolilowej lub braku niezbędnego kofaktora askorbinianu (witaminy C) .
Izomeryzacja cis-trans
Wiązania peptydowe z proliną i innymi N -podstawionymi aminokwasami (takimi jak sarkozyna ) są w stanie zasiedlać zarówno izomery cis, jak i trans . Większość wiązań peptydowych w przeważającej mierze przyjmuje izomer trans (zwykle 99,9% w nienaprężonych warunkach), głównie dlatego, że wodór amidowy ( izomer trans ) zapewnia mniejsze odpychanie steryczne do poprzedniego atomu C α niż następny atom C α ( izomer cis ). W przeciwieństwie do tego, izomery cis i trans wiązania peptydowego X-Pro (gdzie X oznacza dowolny aminokwas) doświadczają zderzeń sterycznych z sąsiadującą substytucją i mają znacznie mniejszą różnicę energii. W związku z tym udział wiązań peptydowych X-Pro w izomerze cis w warunkach nienaprężonych jest znacznie podwyższony, z frakcjami cis zwykle w zakresie 3-10%. Jednak wartości te zależą od poprzedniego aminokwasu, przy czym Gly i reszty aromatyczne dają zwiększone frakcje izomeru cis . Frakcje cis do 40% zostały zidentyfikowane dla wiązań peptydowych Aromatic-Pro.
Z kinetycznego punktu widzenia izomeryzacja cis - trans proliny jest bardzo powolnym procesem, który może hamować postęp fałdowania białka poprzez wychwytywanie jednej lub więcej reszt proliny kluczowych dla fałdowania w nienatywnym izomerze, zwłaszcza gdy natywne białko wymaga izomeru cis . Dzieje się tak, ponieważ reszty proliny są syntetyzowane wyłącznie w rybosomach w postaci izomeru trans . Wszystkie organizmy posiadają enzymy izomerazy prolilowej , które katalizują tę izomeryzację, a niektóre bakterie mają wyspecjalizowane izomerazy prolilowe związane z rybosomem. Jednak nie wszystkie proliny są niezbędne do fałdowania, a fałdowanie białek może przebiegać z normalną szybkością, pomimo posiadania nienatywnych konformerów wielu wiązań peptydowych X-Pro.
Zastosowania
Prolina i jej pochodne są często stosowane jako katalizatory asymetryczne w reakcjach organokatalizy proliny . Redukcję CBS i proliny katalizatorem kondensacji aldolowej są reprezentatywnych przykładów.
W browarnictwie białka bogate w prolinę łączą się z polifenolami, tworząc zmętnienie (mętność).
L- Proline jest środkiem osmoprotekcyjnym i dlatego znajduje zastosowanie w wielu zastosowaniach farmaceutycznych i biotechnologicznych.
Podłoże wzrostowe stosowane w hodowli tkanek roślinnych można uzupełnić proliny. Może to zwiększyć wzrost, być może dlatego, że pomaga roślinie tolerować stres związany z kulturą tkankową. Rolę proliny w odpowiedzi roślin na stres można znaleźć w § Aktywność biologiczna .
Specjalności
Prolina jest jednym z dwóch aminokwasów, które nie występują razem z typowym wykresem Ramachandrana , razem z glicyną . Ze względu na tworzenie pierścienia połączonego z węglem beta, kąty ψ i φ wokół wiązania peptydowego mają mniej dopuszczalnych stopni rotacji. W rezultacie często znajduje się w „zwojach” białek, ponieważ jego wolna entropia (ΔS) nie jest tak duża jak w przypadku innych aminokwasów, a zatem w postaci zwiniętej w porównaniu z postacią niezwiniętą, zmiana entropii jest mniejsza. Ponadto prolina jest rzadko spotykana w strukturach α i β, ponieważ zmniejszałaby stabilność takich struktur, ponieważ jej łańcuch boczny α-N może tworzyć tylko jedno wiązanie azotowe.
Dodatkowo prolina jest jedynym aminokwasem, który nie tworzy czerwono-fioletowego koloru po spryskaniu ninhydryną do zastosowań w chromatografii . Proline natomiast daje kolor pomarańczowo-żółty.
Synteza
Racemiczna prolina może być syntetyzowana z malonianu dietylu i akrylonitrylu :
Ewolucja
Kilka niezależnych badań ewolucyjnych wykorzystujących różne typy danych sugeruje, że prolina należy do grupy aminokwasów, które stanowiły wczesny kod genetyczny. Na przykład regiony o niskiej złożoności (w białkach), które mogą przypominać protopeptydy wczesnego kodu genetycznego, są wysoce wzbogacone w prolinę.
Zobacz też
Bibliografia
Dalsza lektura
- Balbach, J.; Schmid, FX (2000), „Izomeryzacja proliny i jej kataliza w składaniu białek”, w Pain, RH (red.), Mechanizmy składania białek (2nd ed.), Oxford University Press, str. 212-49, ISBN 978-0-19-963788-1.
- Dokładny naukowy przegląd zaburzeń metabolizmu proliny i hydroksyproliny można znaleźć w rozdziale 81 OMMBID Charles Scriver , Beaudet, AL, Valle, D., Sly, WS, Vogelstein, B., Childs, B., Kinzler, KW ( Dostęp 2007). Metaboliczne i molekularne podstawy chorób dziedzicznych w Internecie . Nowy Jork: McGraw-Hill. - Streszczenia 255 rozdziałów, pełny tekst na wielu uczelniach. Istnieje również blog OMMBID .