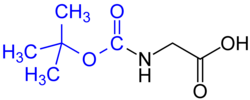
Grupa chroniąca - Protecting group

Grupę zabezpieczającą lub grupa zabezpieczająca jest wprowadzana do cząsteczki przez chemiczną modyfikację grupy funkcyjnej do uzyskania chemoselektywność w kolejnej reakcji chemicznej. Odgrywa ważną rolę w wieloetapowej syntezie organicznej .
W wielu preparatach delikatnych związków organicznych niektóre określone części ich cząsteczek nie mogą przetrwać wymaganych odczynników lub środowisk chemicznych. Następnie te części lub grupy muszą być chronione . Na przykład wodorek litowo-glinowy jest wysoce reaktywnym, ale użytecznym odczynnikiem zdolnym do redukcji estrów do alkoholi . Zawsze będzie reagował z grupami karbonylowymi i nie można tego w żaden sposób zniechęcić. Gdy wymagana jest redukcja estru w obecności karbonylu, należy zapobiec atakowi wodorku na karbonyl. Na przykład karbonyl jest przekształcany w acetal , który nie reaguje z wodorkami. Acetal nazywa się wtedy agrupa zabezpieczająca dla karbonylu. Po zakończeniu etapu obejmującego wodorek, acetal jest usuwany (przez reakcję z wodnym kwasem), zwracając pierwotny karbonyl. Ten etap nazywa się odbezpieczeniem .
Grupy ochronne są częściej stosowane w pracach laboratoryjnych na małą skalę i początkowym rozwoju niż w przemysłowych procesach produkcyjnych, ponieważ ich stosowanie powoduje dodatkowe etapy i koszty materiałowe do procesu. Jednak dostępność taniego chiralnego bloku budulcowego może przezwyciężyć te dodatkowe koszty (np. kwas szikimowy dla oseltamiwiru ).
Wspólne grupy ochronne
Grupy zabezpieczające alkohol
Ochrona alkoholi :
- Acetyl (Ac) – usuwany przez kwas lub zasadę (patrz grupa acetoksy ).
- Benzoil (Bz) – usuwany przez kwas lub zasadę, bardziej stabilny niż grupa Ac.
- Benzyl (Bn) – usuwany przez hydrogenolizę . Grupa Bn jest szeroko stosowana w chemii cukru i nukleozydów.
- Eter β-metoksyetoksymetylowy (MEM) – usuwany kwasem.
- Dimetoksytrityl, [bis-(4-metoksyfenylo)fenylometylo] (DMT) – usuwany słabym kwasem. Grupa DMT jest szeroko stosowana do ochrony grupy 5'-hydroksylowej w nukleozydach, szczególnie w syntezie oligonukleotydów .
- Eter metoksymetylowy (MOM) – usuwany kwasem.
- Metoksytrityl [(4-metoksyfenylo)difenylometylo] (MMT) – usuwany przez kwas i hydrogenolizę.
- Eter p- metoksybenzylowy (PMB) – usuwany przez kwas, hydrogenolizę lub utlenianie – zwykle za pomocą DDQ .
- Eter p- metoksyfenylowy (PMP) – usuwany przez utlenianie.
- Eter metylotiometylowy – usuwany kwasem.
- Pivaloil (Piv) – usuwany przez kwasy, zasady lub środki redukujące. Jest znacznie bardziej stabilny niż inne grupy zabezpieczające acyl.
- Tetrahydropiranyl (THP) – usuwany przez kwas.
- Tetrahydrofuran (THF) – usuwany przez kwas.
- Trityl (trifenylometyl, Tr) – usuwany przez kwas i hydrogenolizę.
- eter sililowy (najbardziej popularne to trimetylosilil (TMS), tert -butylodimetylosilil (TBDMS lub TBS),tri- izo -propylsilyloxymethyl (TOM), i triizopropylosililowa (TIPS) eter) - Usunięto kwasów lub fluorku jonowego. (na przykład NaF, TBAF ( tetra- n -butyloamoniowego fluoru , HF-Py, lub HF-NEt 3 )). Grupy TBDMS i TOM są wykorzystywane do ochrony funkcji 2'-hydroksy w nukleozydach, szczególnie w syntezie oligonukleotydów .
- Etery metylowe – rozszczepienie odbywa się za pomocą TMSI w dichlorometanie lub acetonitrylu lub chloroformie. Alternatywną metodą rozszczepiania eterów metylowych jest BBr 3 w DCM
- Etery etoksyetylowe (EE) – Rozszczepienie bardziej trywialne niż proste etery, np. 1N kwas solny
Grupy zabezpieczające aminy
Ochrona amin :
- Grupa karbobenzyloksy (Cbz) – usunięta przez hydrogenolizę
- p -metoksybenzyl karbonylową (Moz lub MeOZ) grupy - usunięty przez wodorolizę , bardziej labilne niż Cbz
- tert -butyloksykarbonyl (BOC), grupę (powszechne w syntezie peptydów w fazie stałej ) - Usunięto stężonego silnego kwasu (takiego jak HCI lub CF 3 COOH) lub przez ogrzewanie do> 80 ° C.
- grupa 9-fluorenylometyloksykarbonylowa ( Fmoc ) (powszechna w syntezie peptydów w fazie stałej ) – usunięta przez zasadę, taką jak piperydyna
- Acetylo (Ac)Grupa ta jest powszechna w syntezie oligonukleotydów do ochrony N4 w cytozynie i N6 w adeninowych zasadach nukleinowych i jest usuwana przez traktowanie zasadą, najczęściej wodnym lub gazowym amoniakiem lub metyloaminą . Ac jest zbyt stabilny, aby można go było łatwo usunąć z alifatycznych amidów.
- Benzoil (Bz)Grupa ta jest powszechna w syntezie oligonukleotydów dla ochrony N4 w cytozynie i N6 w adeninowych zasadach nukleinowych i jest usuwana przez traktowanie zasadą, najczęściej wodnym lub gazowym amoniakiem lub metyloaminą. Bz jest zbyt stabilny, aby można go było łatwo usunąć z alifatycznych amidów.
- Grupa benzylowa (Bn) – usunięta przez hydrogenolizę
- Grupa karbaminianowa – usunięta przez kwas i łagodne ogrzewanie.
- p- metoksybenzyl (PMB) – usuwany przez hydrogenolizę , bardziej labilny niż benzyl
- 3,4-Dimetoksybenzyl (DMPM) – usuwany przez hydrogenolizę , bardziej labilny niż p- metoksybenzyl
- Grupa p- metoksyfenylowa (PMP) – usunięta przez azotan amonu ceru(IV) (CAN)
- Grupa tosylowa (Ts) – usunięta przez stężony kwas (HBr, H 2 SO 4 ) i silne środki redukujące ( sód w ciekłym amoniaku lub naftalenek sodu )
- Grupa Troc (chloromrówczan trichloroetylu) – usuwana przez insercję Zn w obecności kwasu octowego
- Inne grupy sulfonamidów (Nosyl i Nps) - Usunięte przez jodek samaru , tiofenol lub inne miękkie nukleofile tiolowe lub wodorek tributylocyny
Grupy zabezpieczające karbonyl
Ochrona grup karbonylowych :
- Acetale i Ketale – usuwane przez kwas. Normalnie rozszczepianie acyklicznych acetali jest łatwiejsze niż cyklicznych acetali.
- Acylale – usuwane przez kwasy Lewisa .
- Ditiany – usuwane przez sole metali lub środki utleniające.
Grupy zabezpieczające kwas karboksylowy
Ochrona kwasów karboksylowych :
- Estry metylowe – usuwane przez kwas lub zasadę.
- Estry benzylowe – usuwane przez hydrogenolizę.
- tert -Butylo estry - Usunięto pomocą kwasu, zasady i kilka reduktorów.
- Estry 2,6-dipodstawionych fenoli (np. 2,6-dimetylofenol , 2,6-diizopropylofenol , 2,6-di- tert- butylofenol ) – usuwane w temperaturze pokojowej przez katalizowaną DBU metanolizę w warunkach wysokiego ciśnienia.
- Estry sililowe – usuwane przez odczynniki kwasowe, zasadowe i metaloorganiczne .
- Ortoestry – usuwane łagodnym wodnym kwasem z wytworzeniem estru, który jest usuwany zgodnie z właściwościami estru.
- Oksazolina – usuwana silnym gorącym kwasem (pH < 1, T > 100 °C) lub zasadą (pH > 12, T > 100 °C), ale nie np. LiAlH 4 , odczynnikami litoorganicznymi lub odczynnikami Grignarda (organomagnezowymi)
Grupy zabezpieczające fosforany
- 2-cyjanoetyl– usuwany łagodną bazą. Grupa jest szeroko stosowana w syntezie oligonukleotydów .
- Metyl (ja)– usuwane przez silne nukleofile ec . tiofenol/HERBATA.
Terminalne grupy zabezpieczające alkin
- Propargilowe alkoholi w reakcji Favorskii ,
- Grupy sililowe, zwłaszcza w ochronie samego acetylenu .
Inne
Ochrona ortogonalna

Ochrona ortogonalna jest strategią umożliwiającą specyficzne odbezpieczenie jednej grupy ochronnej w wielokrotnie chronionej strukturze bez wpływu na inne. Na przykład, aminokwas tyrozyna może być zabezpieczony jako ester benzylowy na grupie karboksylowej, fluorenylometylenoksykarbaminian na grupie aminowej i eter tert -butylowy na grupie fenolowej. Ester benzylowy można usunąć przez hydrogenolizę, grupę fluorenylometylenoksy (Fmoc) za pomocą zasad (takich jak piperydyna), a fenolowy eter tert -butylowy rozszczepia się kwasami (np. kwasem trifluorooctowym).
Typowy przykład tego zastosowania, synteza Fmoc-peptyd, w której peptydy są hodowane w roztworze i na fazie stałej, jest bardzo ważna. Grupy zabezpieczające w syntezie w fazie stałej w odniesieniu do warunków reakcji, takich jak czas reakcji, temperatura i odczynniki, można standaryzować tak, aby były przeprowadzane maszynowo, przy czym można uzyskać wydajności znacznie powyżej 99%. W przeciwnym razie rozdzielenie powstałej mieszaniny produktów reakcji jest praktycznie niemożliwe.
Technika ta została wprowadzona w dziedzinie syntezy peptydów przez Robert Bruce Merrifield w roku 1977. Jako dowód koncepcji ortogonalnej odblokowaniu wykazano w fotochemicznej transestryfikacji przez trimetylosililodiazometanu wykorzystującego efekt izotopowy :
Dzięki temu efektowi wydajność kwantowa odbezpieczenia prawostronnej grupy estrowej jest zmniejszona i pozostaje ona nienaruszona. Istotnie, umieszczając atomy deuteru obok lewostronnej grupy estrowej lub zmieniając długość fali na 254 nm otrzymuje się inny monoaren.
Krytyka
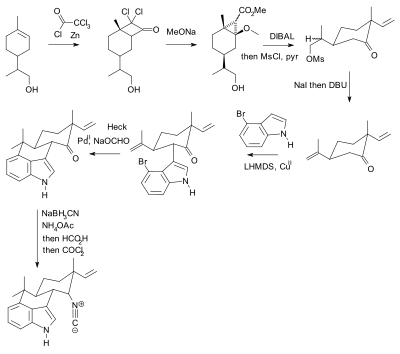
Używanie grup ochronnych jest wszechobecne, ale nie bez krytyki. W praktyce ich zastosowanie dodaje dwa etapy (sekwencja zabezpieczania-odbezpieczania) do syntezy, z których jeden lub oba mogą drastycznie obniżyć wydajność chemiczną . Co najważniejsze, dodatkowa złożoność utrudnia wykorzystanie syntetycznej syntezy totalnej w odkrywaniu leków . Natomiast synteza biomimetyczna nie wykorzystuje grup ochronnych. Jako alternatywę, Baran przedstawił nową syntezę związku hapalindolu U bez grup ochronnych. Wcześniej opublikowana synteza według Barana zawierała 20 etapów z wieloma manipulacjami grup ochronnych (dwa potwierdzone):
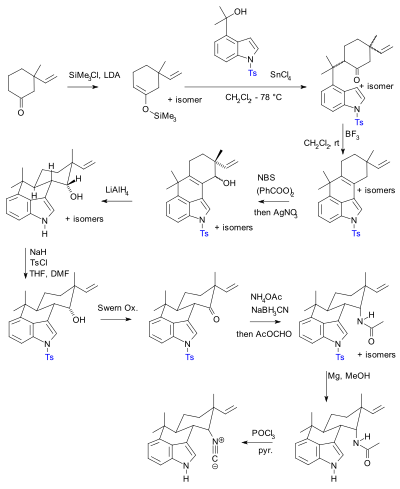
Hideaki Muratake z 1990 Synteza stosująca tosylu grupy ochronne (przedstawione na niebiesko).
|
Zastosowania przemysłowe
Chociaż stosowanie grup zabezpieczających nie jest preferowane w syntezach przemysłowych, są one nadal stosowane w kontekstach przemysłowych, np.:
- Synteza oseltamiwiru (Tamiflu, leku przeciwwirusowego) firmy Roche
- Sukraloza (substancja słodząca)
Bibliografia
Zewnętrzne linki
- Wprowadzenie grupy zabezpieczającej i mechanizmu deprotekcji
- Notatki ze studiów licencjackich na ten temat od prof. Rizzo.
- Kolejny zestaw notatek do studium w formie samouczka, wraz ze wskazówkami i komentarzami, od prof. Grossman i Camers.
- Recenzja prof. Kocieńskiego.
- Witryna użytkownika zaczerpnięta z klasycznego tekstu Greene'a i Wutsa dotyczącego stabilności kilku kluczowych grup, z obszernych tabel tego odnośnika.
- Ochrona grupy przed organic-reaction.com