Dehydrogenaza pirogronianowa - Pyruvate dehydrogenase
| dehydrogenaza pirogronianowa (przenoszenie acetylu) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura krystalograficzna dehydrogenazy pirogronianowej (PDH). PH jest dimerem sześciodomenowym z regionami α (niebieskim), α' (żółtym), β (czerwonym) i β' (morskim) oznaczonymi różnymi kolorami. Pirofosforan tiaminy (TPP) jest przedstawiony w postaci szarej kulki i sztyftu, dwa jony magnezu w kolorze fioletowym podlegają ligacji metalu z TPP, a dwa jony potasu w kolorze pomarańczowym.
| |||||||||
| Identyfikatory | |||||||||
| Nr WE | 1.2.4.1 | ||||||||
| Nr CAS | 9014-20-4 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRIAM | profil | ||||||||
| Struktury WPB | RCSB PDB PDBe Suma PDB | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Dehydrogenaza pirogronianowa jest enzymem, który katalizuje reakcję pirogronianu i lipoamidu z wytworzeniem acetylowanego dihydrolipoamidu i dwutlenku węgla . Konwersja wymaga koenzymu pirofosforanu tiaminy .
Dehydrogenaza pirogronianowa jest zwykle spotykana jako składnik, określany jako E1, kompleksu dehydrogenazy pirogronianowej (PDC). PDC składa się z innych enzymów, określanych jako E2 i E3. Wspólnie E1-E3 transformacji pirogronianu , NAD + koenzym A do acetylo-CoA , CO 2 i NADH. Konwersja jest kluczowa, ponieważ acetylo-CoA może być następnie wykorzystany w cyklu kwasu cytrynowego do przeprowadzenia oddychania komórkowego . Aby odróżnić ten enzym od PDC, jest on systematycznie nazywany dehydrogenazą pirogronianową (przenoszenie acetylu) .
Mechanizm
Pirofosforan tiaminy (TPP) przekształca się w ylid przez deprotonację. Ylidy atakują grupę ketonową pirogronianu. Powstały addukt dekarboksyluje . Powstały 1,3-dipol redukcyjnie acetyluje lipoamid-E2.
Jeśli chodzi o szczegóły, dane biochemiczne i strukturalne dla E1 ujawniły mechanizm aktywacji koenzymu TPP poprzez utworzenie konserwatywnego wiązania wodorowego z resztą glutaminianową (Glu59 w ludzkim E1) oraz narzucenie konformacji V, która wprowadza atom N4' aminopirymidyny do wewnątrzcząsteczkowego wiązania wodorowego z atomem tiazolium C2. Ta unikalna kombinacja kontaktów i konformacji TPP prowadzi ostatecznie do powstania reaktywnego karboanionu C2. Po dekarboksylacji pirogronianu kofaktora TPP, część acetylowa staje się pochodną hydroksyetylową kowalencyjnie przyłączoną do TPP.
Struktura
E1 to multimeryczne białko. Ssacze E1, w tym ludzkie E1, są tetrameryczne, złożone z dwóch podjednostek α- i dwóch β-. Niektóre bakteryjne E1, w tym E1 z Escherichia coli , składają się z dwóch podobnych podjednostek, z których każda jest tak duża, jak suma mas cząsteczkowych podjednostek α- i β-.
.
Aktywna strona
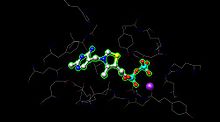
E1 ma dwa miejsca katalityczne, z których każde dostarcza pirofosforan tiaminy ( TPP ) i jon magnezu jako kofaktory. Podjednostka α wiąże jon magnezu i fragment pirofosforanu, podczas gdy podjednostka β wiąże fragment pirymidynowy TPP , tworząc razem miejsce katalityczne na granicy podjednostek.
Miejsce aktywne dla dehydrogenazy pirogronianowej (obraz stworzony z PDB : 1NI4 ) utrzymuje TPP poprzez ligację metalu z jonem magnezu (purpurowa kula) i poprzez wiązanie wodorowe z aminokwasami. Podczas gdy w miejscu aktywnym można znaleźć ponad 20 aminokwasów, aminokwasy Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 i His 263 faktycznie uczestniczą w wiązaniu wodorowym, aby utrzymać TPP i pirogronian (nie pokazane) w miejscu aktywnym. Aminokwasy są pokazane jako druty, a TPP jest w formie kulki i sztyftu. Miejsce aktywne pomaga również w przeniesieniu acylu z TPP do lipoamidu oczekującego na E2.
Rozporządzenie
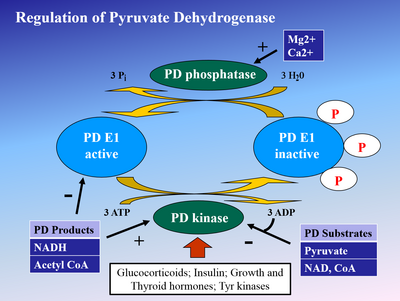
Fosforylacja E1 przez kinazę dehydrogenazy pirogronianowej (PDK) inaktywuje E1, a następnie cały kompleks. PDK jest hamowana przez kwas dichlorooctowy i pirogronian , co skutkuje większą ilością aktywnego, niefosforylowanego PDH. Fosforylację odwraca fosfataza dehydrogenazy pirogronianowej , która jest stymulowana przez insulinę , PEP i AMP , ale kompetycyjnie hamowana przez ATP , NADH i Acetyl- CoA .
Patologia
Dehydrogenaza pirogronianowa jest celem autoantygenu znanego jako przeciwciała antymitochondrialne (AMA), co powoduje postępujące niszczenie małych dróg żółciowych wątroby, co prowadzi do pierwotnej marskości żółciowej wątroby . Wydaje się, że przeciwciała te rozpoznają utlenione białko powstałe w wyniku zapalnych odpowiedzi immunologicznych. Niektóre z tych reakcji zapalnych mogą być związane z wrażliwością na gluten, ponieważ ponad 50% pacjentów z ostrą niewydolnością wątroby w jednym badaniu wykazywało niemitochondrialne autoprzeciwciała przeciwko transglutaminazie tkankowej . Inne autoantygeny mitochondrialne obejmują dehydrogenazę oksoglutaranową i kompleks dehydrogenazy alfa- ketokwasów o rozgałęzionym łańcuchu , które są antygenami rozpoznawanymi przez przeciwciała przeciwmitochondrialne .
Niedobór dehydrogenazy pirogronianowej (PDH) jest wrodzoną zwyrodnieniową chorobą metaboliczną wynikającą z mutacji kompleksu dehydrogenazy pirogronianowej (PDC) zlokalizowanego na chromosomie X. Chociaż defekty zostały zidentyfikowane we wszystkich 3 enzymach kompleksu, podjednostka E1-α jest głównie winowajcą. Nieprawidłowe funkcjonowanie cyklu kwasu cytrynowego spowodowane niedoborem PDH pozbawia organizm energii i prowadzi do nieprawidłowego nagromadzenia mleczanu. Niedobór PDH jest częstą przyczyną kwasicy mleczanowej u noworodków i często objawia się ciężkim letargiem, złym odżywianiem, przyspieszonym oddechem i przypadkami zgonów.
Przykłady
Białka ludzkie posiadające aktywność dehydrogenazy pirogronianowej obejmują:
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Powiązane enzymy
U bakterii istnieje forma dehydrogenazy pirogronianowej (zwana również oksydazą pirogronianową, EC 1.2.2.2), która łączy utlenianie pirogronianu do octanu i dwutlenku węgla z redukcją ferrocytochromu. W E. coli enzym ten jest kodowany przez gen ospy B, a białko zawiera kofaktor flawiny. Enzym ten zwiększa wydajność wzrostu E. coli w warunkach tlenowych.
Zobacz też
Bibliografia
- Ochoa S (1954). „Mechanizmy enzymatyczne w cyklu kwasu cytrynowego”. Postępy w enzymologii i pokrewnych dziedzinach biologii molekularnej . Postępy w enzymologii i pokrewnych przedmiotach biochemii . Postępy w enzymologii - i pokrewnych dziedzinach biologii molekularnej. 15 . s. 183–270. doi : 10.1002/9780470122600.ch5 . Numer ISBN 9780470122600. PMID 13158180 .
- Scriba P, Holzer H (1961). „Gewinnung von alphaHydroxyathyl-2-thiaminpyrrophosphat mit Pyruvatoxydase aus Schweineherzmuskel”. Biochem. Z . 334 : 473-486.
- Perhama RN (2000). „Swinging arms and swinging domains in wielofunkcyjnych enzymów: maszyny katalityczne do reakcji wieloetapowych”. Roczny Przegląd Biochemii . 69 (1): 961–1004. doi : 10.1146/annurev.biochem.69.1.961 . PMID 10966480 .
Zewnętrzne linki
- Pirogronian + Dehydrogenaza-E1 w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- http://www.brookscole.com/chemistry_d/templates/student_resources/shared_resources/animations/pdc/pdc.html
- PDBe-KB zawiera przegląd wszystkich informacji o strukturze dostępnych w PDB dla ludzkiej dehydrogenazy pirogronianowej (lipoamid) alfa 1.
- PDBe-KB zawiera przegląd wszystkich informacji o strukturze dostępnych w PDB dla ludzkiej dehydrogenazy pirogronianowej (lipoamid) beta.