Choroba krwotoczna królików - Rabbit hemorrhagic disease
| Wirus krwotocznej choroby królików | |
|---|---|
|
|
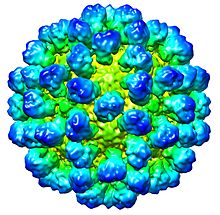
| Rekonstrukcja CryoEM kapsydu wirusa . Wpis EMDB EMD-1933 | |
|
Klasyfikacja wirusów |
|
| (bez rankingu): | Wirus |
| Królestwo : | Rybowiria |
| Królestwo: | Orthornavirae |
| Gromada: | Pisuviricota |
| Klasa: | Pisoniviricetes |
| Zamówienie: | Pikornawirusy |
| Rodzina: | Caliciviridae |
| Rodzaj: | Lagowirus |
| Gatunek: |
Wirus krwotocznej choroby królików
|
| Izoluje | |
|
|
| Synonimy | |
|
|
Choroba krwotoczna królików ( RHD ), znana również jako wirusowa choroba krwotoczna (VHD), jest wysoce zakaźną i śmiertelną postacią wirusowego zapalenia wątroby, która atakuje króliki europejskie . Niektóre szczepy wirusowe atakują również zające i króliki bawełniane. Wskaźniki śmiertelności na ogół wahają się od 70 do 100 procent. Chorobę wywołują szczepy wirusa krwotocznej choroby królików ( RHDV ), lagowirusa z rodziny Caliciviridae .
Wirus krwotocznej choroby królików
Wirus krwotocznej choroby królików (RHDV) jest wirusem z rodzaju Lagovirus i rodziny Caliciviridae . Jest to wirus bezotoczkowy o średnicy około 35–40 nm, symetrii dwudziestościennej i liniowym genomie RNA o dodatnim znaczeniu o wielkości 6,4–8,5 kb. RHDV powoduje u królików uogólnione zakażenie, które charakteryzuje się martwicą wątroby, rozsianym wykrzepianiem wewnątrznaczyniowym i szybką śmiercią. Podział na serotypy został określony przez brak krzyżowej neutralizacji przy użyciu swoistych antysurowic. Lagowirusy królików obejmują również pokrewne kaliciwirusy, takie jak wirus zespołu zająca brunatnego .
Wydaje się, że RHDV wyewoluował z istniejącego wcześniej niezjadliwego kaliciwirusa królików (RCV). Niepatogenne kaliciwirusy królików spokrewnione z RHDV, ale różniące się od nich, krążyły, najwyraźniej nieszkodliwe, w Europie, Australii i Nowej Zelandii przed pojawieniem się RHDV. W trakcie swojej ewolucji RHDV podzielił się na sześć odrębnych genotypów, z których wszystkie są wysoce patogenne.
Trzy szczepy wirusa krwotocznej choroby królików o znaczeniu medycznym to RHDV, RHDVa i RHDV2. RHDV (określany również jako RHDV, RHDV1 lub jako klasyczny RHD) dotyka tylko dorosłe króliki europejskie ( Oryctolagus cuniculus ). Wirus ten został po raz pierwszy zgłoszony w Chinach w 1984 r., skąd rozprzestrzenił się na znaczną część Azji, Europy, Australii i innych krajów. Kilka izolowanych ognisk RHDV miało miejsce w Stanach Zjednoczonych i Meksyku, ale pozostały one zlokalizowane i zostały zwalczone.
W 2010 roku we Francji zidentyfikowano nowego lagowirusa o odrębnym profilu antygenowym. Nowy wirus, nazwany wirusem krwotocznej choroby królików 2 (w skrócie RHDV2 lub RHDVb), również powodował RHD, ale wykazywał charakterystyczne cechy genetyczne, antygenowe i patogenne. Co ważne, RHDV2 zabił króliki wcześniej zaszczepione szczepionkami RHDV i zaatakował młode króliki europejskie, a także zające ( Lepus spp.). Wszystkie te cechy silnie sugerują, że wirus nie pochodził z RHDVa, ale z jakiegoś innego nieznanego źródła. Od tego czasu RHDV2 rozprzestrzenił się na większość Europy, a także do Australii, Kanady i Stanów Zjednoczonych.
Epidemiologia i transmisja
Oba wirusy powodujące RHD są niezwykle zaraźliwe. Przenoszenie następuje przez bezpośredni kontakt z zakażonymi zwierzętami, tuszami, płynami ustrojowymi (mocz, kał, wydzieliny oddechowe) i włosami. Króliki, które przeżyły, mogą być zaraźliwe przez okres do 2 miesięcy. Zakażone formy, takie jak odzież, żywność, klatki, pościel, karmniki i woda również rozprzestrzeniają wirusa. Muchy, pchły i komary mogą przenosić wirusa między królikami. Drapieżniki i padlinożercy mogą również rozprzestrzeniać wirusa, wydalając go z kałem. Kaliciwirusy są bardzo odporne w środowisku i mogą przetrwać zamrażanie przez dłuższy czas. Wirus może utrzymywać się w zakażonym mięsie miesiącami i przez dłuższy czas w rozkładających się tuszach. Import mięsa króliczego może być głównym czynnikiem rozprzestrzeniania się wirusa na nowe regiony geograficzne.
Epidemie RHD są zwykle sezonowe w populacjach dzikich królików, gdzie większość dorosłych przeżyła infekcję i jest odporna. Gdy młode kocięta dorastają i przestają karmić, nie otrzymują już przeciwciał dostarczonych z mlekiem matki i stają się podatne na infekcje. W związku z tym epizoocja RHD występuje częściej w okresie lęgowym królików.
Ogólnie rzecz biorąc, wśród lagowirusów występuje wysoka specyficzność gospodarza. Klasyczne RHDVa dotyczy tylko królików europejskich, gatunku rodzimego dla Europy i od którego pochodzi królik domowy. Nowy wariant RHDV2 atakuje również króliki europejskie, ale powoduje również śmiertelne RHD u różnych gatunków Lepus , w tym zajęcy sardyńskich ( L. capensis mediterraneus ), zające włoskie ( L. corsicanus ) i zające górskie ( L. timidus ). Doniesienia o RHD u gatunków Sylvilagus pochodzą z obecnej epidemii w Stanach Zjednoczonych.
RHD wywołane przez RHDV i RHDVa wykazuje wysoką zachorowalność (do 100%) i śmiertelność (40-100%) u dorosłych królików europejskich. Młode króliki w wieku 6–8 tygodni są mniej podatne na zakażenie, a kocięta młodsze niż 4 tygodnie nie chorują. Niedawno ujawniony RHDV2 powoduje śmierć i chorobę u królików w wieku 15 dni. Wskaźniki śmiertelności z RHDV2 są bardziej zmienne i wynoszą 5-70%. Początkowo mniej zjadliwy, patogenność RHDV2 wzrastała i jest obecnie podobna do tej występującej w przypadku RHDV i RHDVa. Zgony z powodu RHDV2 potwierdzono u królików wcześniej zaszczepionych przeciwko RHDVa.
Patofizjologia
Oba szczepy wirusa RHDV replikują się w wątrobie, powodując martwicę wątroby i niewydolność wątroby, co z kolei może prowadzić do rozsianego wykrzepiania wewnątrznaczyniowego , encefalopatii wątrobowej i nerczycy . W wyniku zużycia czynników krzepnięcia i płytek krwi może wystąpić krwawienie.
Objawy kliniczne
Choroba krwotoczna królików powoduje zapalenie wątroby. Okres inkubacji RHDVa wynosi 1–2 dni, a RHDV2 3–5 dni. Króliki zakażone RHDV2 częściej wykazują podostre lub przewlekłe objawy niż te zakażone RHDVa. W królikarni typowa jest epidemia o wysokiej śmiertelności u królików dorosłych i niedojrzałych. Jeśli epidemia jest spowodowana przez RHDV2, śmierć następuje również u młodych królików.
RHD może różnić się częstością występowania objawów klinicznych. W przypadkach nadostrych króliki zwykle są martwe bez objawów poprzedzających. Króliki można zaobserwować podczas wypasu normalnie bezpośrednio przed śmiercią.
W ostrych przypadkach króliki są nieaktywne i niechętnie poruszają się. Mogą rozwinąć gorączkę do 42 ° C (107,6 ° F) i mieć zwiększoną częstość akcji serca i oddechów. Krwawa wydzielina z nosa, ust lub sromu jest częsta, podobnie jak krew w kale lub moczu. Leżenie na boku, śpiączka i drgawki mogą być obserwowane przed śmiercią. Króliki z postacią ostrą umierają zazwyczaj w ciągu 12 do 36 godzin od początku gorączki.
Podostry do przewlekłego RHD ma bardziej przewlekły przebieg kliniczny i częściej występuje w przypadku infekcji RHDV2. Objawy kliniczne to letarg, anoreksja, utrata masy ciała i żółtaczka . Pokarmowego dylatacyjne, zaburzenia rytmu serca , szmery sercowe mogą również wystąpić, i neurologiczne zaburzenia. Śmierć, jeśli wystąpi, zwykle następuje po 1-2 tygodniach od wystąpienia objawów i jest spowodowana niewydolnością wątroby.
Nie wszystkie króliki narażone na RHDVa lub RHDV2 stają się jawnie chore. Niewielki odsetek zarażonych królików usuwa wirusa bez pojawienia się objawów choroby. Występują również bezobjawowi nosiciele , którzy mogą nadal wydzielać wirusa przez wiele miesięcy, zarażając w ten sposób inne zwierzęta. Króliki, które przeżyły, rozwijają silną odporność na specyficzny wariant wirusa, którym zostały zakażone.
Diagnoza
Wstępną diagnozę RHD można często postawić na podstawie obrazu klinicznego, wzorca zakażenia w populacji i zmian pośmiertnych . Ostateczna diagnoza wymaga wykrycia wirusa. Ponieważ większości kaliciwirusów nie można hodować w kulturach komórkowych, często stosuje się molekularne i serologiczne metody wykrywania wirusów.
Pełna morfologia krwi królików z RHD często wykazuje niski poziom białych krwinek i płytek krwi, a panele chemiczne wykazują podwyższony poziom enzymów wątrobowych. Mogą również występować oznaki niewydolności wątroby, w tym zwiększone stężenie kwasów żółciowych i bilirubiny oraz obniżone stężenie glukozy i cholesterolu. Typowe są wydłużone czasy protrombiny i częściowej tromboplastyny po aktywacji. Analiza moczu może wykazać bilirubinurię, białkomocz i wysoki GGT moczu.
Klasyczną zmianą post mortem obserwowaną u królików z RHD jest rozległa martwica wątroby i żółtaczka. Można również zaobserwować krwotoki wieloogniskowe, powiększenie śledziony, odoskrzelowe zapalenie płuc, krwotok lub obrzęk płuc oraz martwicę mięśnia sercowego.
Do identyfikacji wirusów RHD można użyć różnych testów molekularnych. Testy reakcji łańcuchowej polimerazy z odwrotną transkrypcją są powszechnie stosowaną i dokładną metodą testowania wirusów. Inne stosowane testy obejmują test immunoenzymatyczny , mikroskopię elektronową , immunobarwienie , Western blot i hybrydyzację in situ . Tkanką z wyboru do badań molekularnych jest świeża lub mrożona wątroba, ponieważ zwykle zawiera największą liczbę wirusów, ale jeśli nie jest to dostępne, można również użyć śledziony i surowicy. Konieczna jest identyfikacja szczepu RHDV, aby można było odpowiednio dostosować protokoły szczepień.
Zapobieganie i kontrola
Szczepionki
Szereg dostępnych szczepionek przeciwko RHD jest sprzedawanych w krajach, w których choroba ma charakter endemiczny. Wszystkie zapewniają 12-miesięczną ochronę przed wirusami RHD. Ponieważ wirusy RHD nie mogą normalnie rosnąć in vitro , wpływa to na sposób wytwarzania tych szczepionek. Inaktywowane szczepionki na RHD, w tym Eravac, Felavac i Cylap, są „pozyskiwane z wątroby”, co oznacza, że laboratoryjne króliki są celowo zakażone RHD, a ich wątroby i śledziony są pobierane do produkcji szczepionek. Każdy zastosowany królik skutkuje wytworzeniem tysięcy dawek szczepionki. Doprowadziło to do kontrowersji wśród miłośników królików, którzy kwestionują etykę niektórych królików, które muszą umrzeć, aby chronić inne, ale nie jest to problem, w którym króliki są hodowane głównie na mięso. Inną metodą reprodukcji wirusa jest technika rekombinacji, w której fragmenty antygenowe wirusów RHD są wprowadzane do wirusów, które można hodować w hodowli. Jest to metoda wykorzystywana do tworzenia Nobivac Myxo-RHD PLUS.
Szczepionki przeciwko tylko klasycznemu szczepowi RHDVa to: Szczepionka Cylap RCD, wyprodukowana przez Zoetis, chroni króliki przed dwoma różnymi szczepami RHDVa (v351 i K5), które są używane do zwalczania dzikich królików w Australii. CUNIPRAVAC RHD®, produkowany przez HIPRA, chroni przed szczepami RHDVa występującymi w Europie. Nobivac Myxo-RHD, wyprodukowany przez MSD Animal Health, to żywa szczepionka z wektorem myksomatozy, która zapewnia roczny okres odporności zarówno na RHDVa, jak i myksomatozę .
Szczepionki przeciwko tylko nowszemu szczepowi RHDV2 to: Szczepionka Eravac, wyprodukowana przez HIPRA, chroni króliki przed RHDV2 przez rok.
Szczepionki, które chronią zarówno przed szczepami RHDVa, jak i RHDV2 obejmują: Filavac VHD K C+V, wyprodukowany przez Filavie, chroni zarówno przed klasycznym RHDVa, jak i RHDV-2. Jest dostępny w fiolkach jednodawkowych i wielodawkowych. Wkrótce wprowadzona na rynek szczepionka firmy MSD Animal Health, Nobivac Myxo-RHD PLUS, jest żywą rekombinowaną szczepionką wektorową aktywną zarówno przeciwko RHDVa, jak i RHDV2, a także myksomatozie.
Kraje, w których RHD nie jest uważany za endemiczny, mogą nałożyć ograniczenia na import szczepionek RHDV. Import tych szczepionek do Stanów Zjednoczonych może odbywać się wyłącznie za zgodą Departamentu Rolnictwa Stanów Zjednoczonych i odpowiedniego stanowego lekarza weterynarii.
Dezynfekcja
Kaliciwirusy są stabilne w środowisku i trudne do inaktywacji. Produkty powszechnie używane do dezynfekcji gospodarstw domowych, takie jak chusteczki do dezynfekcji Clorox® i Lysol®, nie działają przeciwko tym wirusom. Jedną ze skutecznych opcji jest przetarcie powierzchni 10% roztworem wybielacza , co pozwala na 10 minut kontaktu przed spłukaniem. Inne środki dezynfekujące, które okazały się skuteczne, to 10% wodorotlenek sodu , 2% One-Stroke Environ®, Virkon® S, Clorox® Healthcare Bleach Germicidal Wipes, Trifectant®, Rescue® i środki czyszczące zawierające nadtlenek wodoru. Resztki powierzchni należy zawsze usunąć mechanicznie przed dezynfekcją. Lista środków dezynfekujących, które są skuteczne przeciwko calicivirusowi (w tym przypadku norowirusowi) znajduje się na stronie internetowej Agencji Ochrony Środowiska. Badania wykazały, że wiele środków dezynfekcyjnych opartych na czwartorzędowych związkach amonu nie dezaktywuje kaliciwirusów.
Kwarantanna i inne środki
Ze względu na wysoce zakaźny charakter choroby, w przypadku wybuchu epidemii konieczna jest ścisła kwarantanna. Depopulacja, dezynfekcja, szczepienia, nadzór i kwarantanna to jedyny sposób na prawidłowe i skuteczne zwalczenie choroby. Martwe króliki należy natychmiast usunąć i wyrzucić w bezpieczny sposób. Króliki, które przeżyły, powinny zostać poddane kwarantannie lub humanitarnej eutanazji. Króliki testowe mogą być wykorzystywane do monitorowania wirusa na fermach szczepionych.
Podział geograficzny
RHD to przede wszystkim choroba dotykająca króliki europejskie, które pochodzą z Półwyspu Iberyjskiego i występują na wolności w znacznej części Europy Zachodniej. Udomowione rasy hodowane są na całym świecie na mięso i futra i stają się coraz bardziej popularnymi zwierzętami domowymi. Króliki europejskie zostały wprowadzone do Australii, Nowej Zelandii, Chile, Argentyny i na różnych wyspach i stały się zdziczałe, a czasem inwazyjne .
RHD po raz pierwszy zgłoszono w 1984 r. w Chińskiej Republice Ludowej. Od tego czasu RHD rozprzestrzenił się w ponad 40 krajach w Afryce, obu Amerykach, Azji, Europie i Oceanii i jest endemiczny w większości części świata.
Azja
Pierwsza zgłoszona epidemia RHD wywołana przez RHDVa miała miejsce w 1984 r. w prowincji Jiangsu w Chinach . Do ogniska doszło w grupie królików angorskich sprowadzonych z Niemiec . Przyczyną choroby był mały, bezotoczkowy wirus RNA. Opracowano inaktywowaną szczepionkę, która okazała się skuteczna w zapobieganiu chorobom. W niecały rok choroba rozprzestrzeniła się na obszarze 50 000 km 2 w Chinach i zabiła 140 milionów królików domowych.
Korea Południowa była kolejnym krajem, który zgłosił epidemie RHD po imporcie futra królika z Chin. Od tego czasu RHD rozprzestrzenił się i stał się endemiczny w wielu krajach Azji, w tym w Indiach i na Bliskim Wschodzie.
Europa
Z Chin RHDVa rozprzestrzenił się na zachód do Europy. Pierwszy raport o RHD w Europie pochodzi z Włoch w 1986 roku. Stamtąd rozprzestrzenił się na większą część Europy. Pierwszy przypadek odnotowany w Hiszpanii miał miejsce w 1988 r., a następnie we Francji, Belgii i Skandynawii w 1990 r. Hiszpania doświadczyła dużego wymierania dzikich królików, co z kolei spowodowało spadek populacji drapieżników, które normalnie zjadały króliki, w tym rysia iberyjskiego i hiszpańskiego. orzeł cesarski .
RHD wywołany przez RHDVa został po raz pierwszy zgłoszony w Wielkiej Brytanii w 1992 roku. Ta początkowa epidemia została opanowana pod koniec lat 90. za pomocą kombinacji szczepień, ścisłego bezpieczeństwa biologicznego i dobrej hodowli. Nowszy szczep wirusa RHDV2 został po raz pierwszy wykryty w Anglii i Walii w 2014 roku, a wkrótce rozprzestrzenił się na Szkocję i Irlandię.
W 2010 roku we Francji pojawił się nowy wariant wirusa o nazwie wirus krwotocznej choroby królików 2 (RHDV2). Od tego czasu RHDV2 rozprzestrzenił się z Francji do reszty Europy, Wielkiej Brytanii, Australii i Nowej Zelandii. Epidemie zaczęły pojawiać się w Stanach Zjednoczonych i Kanadzie na wyspie Vancouver w 2019 roku.
RHD wykryto po raz pierwszy w Finlandii w 2016 roku. Epidemia wystąpiła u zdziczałych królików europejskich, a testy genetyczne zidentyfikowały szczep wirusa jako RHDV2. Potwierdzono przypadki przeniesienia wirusa na udomowione króliki domowe i zalecono szczepienie królików.
Oceania
W 1991 r. szczep wirusa RHDVa, czeski CAPM 351RHDV, został przywieziony do Australii w warunkach ścisłej kwarantanny w celu zbadania bezpieczeństwa i użyteczności wirusa, gdyby był stosowany jako środek kontroli biologicznej przeciwko problemowi szkodników królików w Australii i Nowej Zelandii . Testowanie wirusa została przeprowadzona na Wardang wyspie w Spencer Zatoki wybrzeży w Yorke Peninsula , Australii Południowej . W 1995 r. wirus uciekł z kwarantanny iw ciągu 8 tygodni od uwolnienia zabił 10 milionów królików. W marcu 2017 roku, po prawie dziesięciu latach badań, pomyślnie wypuszczono nowy koreański szczep znany jako RHDV K5. Ten szczep został wybrany po części dlatego, że działa lepiej w chłodnych, wilgotnych regionach, gdzie poprzedni Calicivirus był mniej skuteczny.
W lipcu 1997 r., po rozpatrzeniu ponad 800 wniosków publicznych, Ministerstwo Zdrowia Nowej Zelandii postanowiło nie zezwalać na import RHDVa do Nowej Zelandii w celu kontrolowania populacji królików. Jednak pod koniec sierpnia potwierdzono, że RHDVa został celowo i nielegalnie wprowadzony do obszaru Cromwell na Wyspie Południowej . Urzędnicy Nowej Zelandii podjęli nieudaną próbę kontrolowania rozprzestrzeniania się choroby. Był jednak celowo rozprzestrzeniany, a kilku rolników (zwłaszcza w rejonie Mackenzie Basin ) przyznało się do przetwarzania królików, które padły z powodu choroby, w mikserach kuchennych w celu dalszego rozprzestrzeniania. Gdyby choroba została wprowadzona w lepszym czasie, kontrola populacji byłaby skuteczniejsza, ale została uwolniona po rozpoczęciu hodowli na sezon, a króliki poniżej 2 tygodnia życia w momencie wprowadzenia były odporne na chorobę. Te młode króliki były zatem w stanie przeżyć i ponownie rozmnażać liczbę królików. Po dziesięciu latach populacje królików (zwłaszcza w Kotlinie Mackenzie) zaczynają ponownie osiągać proporcje zbliżone do stanu sprzed zarazy, chociaż nie powróciły jeszcze do poziomów sprzed RHD. Oporność na RHD u królików nowozelandzkich doprowadziła do powszechnego stosowania związku 1080 (fluorooctan sodu) . Rząd i departament ochrony muszą zwiększyć wykorzystanie 1080 w celu ochrony rezerwatów przed królikami i zachowania zdobyczy osiągniętych w ostatnich latach dzięki zastosowaniu RHD.
Ameryka Północna i Południowa
Pojedyncze ogniska RHDVa u królików domowych wystąpiły w Stanach Zjednoczonych, z których pierwsza miała miejsce w stanie Iowa w 2000 r. W 2001 r. ogniska wystąpiły w Utah, Illinois i Nowym Jorku. Nowsze ogniska RHDVa miały miejsce w 2005 r. w Indianie i 2018 r. w Pensylwanii. Każda z tych epidemii została opanowana i była wynikiem oddzielnego, ale nieokreślonego wprowadzenia RHDVa. RHDVa nie wpływa na rodzime bawełniane ogonki i króliki w Stanach Zjednoczonych, więc wirus nie stał się endemiczny.
Pierwsze zgłoszenie wirusa RHDV2 w Ameryce Północnej miało miejsce na farmie w Quebecu w 2016 roku. W 2018 roku większa epidemia wystąpiła u zdziczałych królików europejskich na wyspie Delta i Vancouver w Kolumbii Brytyjskiej. Choroba została potwierdzona w tym samym roku u królika domowego w Ohio. W lipcu 2019 r. pierwszy przypadek RHDV2 w Waszyngtonie został potwierdzony u królika domowego z Orcas Island . RHDV2 odnotowano u królików domowych w Waszyngtonie i Nowym Jorku.
W 2020 roku ogniska choroby u królików domowych, a także królików i zajęcy Cottontail zostały zgłoszone w Arizonie, Nowym Meksyku, Kolorado, Teksasie, Nevadzie, Kalifornii i Utah. Podlegające dzikich zwierząt obejmują góry Cottontail królików ( Sylvilagus nutalli ), pustynie Cottontail królików ( S. audubonii ), antylop jackrabbits ( L. alleni ) i czarnych rozkładem jackrabbits ( L. californicus ). Wirus krążący w południowo-zachodnich Stanach Zjednoczonych różni się od wirusa RHDV2 wyizolowanego z Nowego Jorku, Waszyngtonu w stanie Ohio i Kolumbii Brytyjskiej w Kanadzie. Źródła tych epidemii są nieznane.
W Meksyku wybuchła epidemia RHDVa u królików domowych w latach 1989-1991, prawdopodobnie po przywozie mięsa króliczego z Chińskiej Republiki Ludowej. Surowe środki kwarantanny i depopulacji umożliwiły zwalczenie wirusa, a kraj został oficjalnie uznany za wolny od RHD w 1993 roku. Druga epidemia RHD u królików domowych rozpoczęła się w stanie Chihuahua w kwietniu 2020 roku i od tego czasu rozprzestrzeniła się na Sonora, Baja California, Baja California Sur, Coahuila i Durango.
Od 1993 r. RHDVa jest gatunkiem endemicznym na Kubie. W latach 1993, 1997, 2000-2001 i 2004-2005 zgłoszono cztery epizootie z udziałem udomowionych królików. W konsekwencji za każdym razem tysiące królików padło lub zostało ubitych. Uważa się, że wirus kwitnie również w Boliwii .
Zobacz też
Bibliografia
- Nowa epidemia w Kanadzie doniosła na wyspie Vancouver „Problemy BC ostrzegają właścicieli królików domowych, gdy wirus rozprzestrzenia się na Lower Mainland | CBC News” .