Komórki Schwanna - Schwann cell
| komórki Schwanna | |
|---|---|
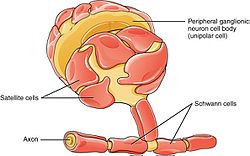 PNS ma komórki satelitarne i komórki Schwanna.
| |
| Identyfikatory | |
| Siatka | D012583 |
| FMA | 62121 |
| Anatomiczne terminy neuroanatomii | |
Komórki Schwanna lub neurolemmocytes (nazwana niemiecki fizjolog Theodor Schwann ) są głównym glejowych w obwodowym układzie nerwowym (PNS). Komórki glejowe wspierają neurony i PNS, obejmują również komórki satelitarne , węchowe komórki osłonowe , glej jelitowy i glej, które znajdują się w zakończeniach nerwów czuciowych, takich jak ciałko Paciniego . Dwa typy komórek Schwanna to mielinizujące i niemielinizujące. Mielinizujące się komórki Schwanna owijają się wokół aksonów neuronów ruchowych i czuciowych, tworząc osłonkę mielinową . Promotor komórkowy Schwanna jest obecny w doleregion genu ludzkiej dystrofiny, który daje skrócony transkrypt, który jest ponownie syntetyzowany w sposób specyficzny dla tkanki.
Podczas rozwoju PNS mechanizmy regulacyjne mielinizacji są kontrolowane przez wyprzedzającą interakcję określonych genów, wpływając na kaskady transkrypcyjne i kształtując morfologię mielinowanych włókien nerwowych.
Komórki Schwanna biorą udział w wielu ważnych aspektów obwodowych nerwów Biology, przewodzenie impulsów nerwowych wzdłuż aksonów , rozwój nerwów i regeneracji , troficznego wsparcia dla neuronów , produkcji nerwu zewnątrzkomórkowej macierzy modulacji nerwowo aktywności synaptycznej i prezentacji antygenów do T -limfocyty .
Choroba Charcota-Mariego-Tootha , zespół Guillain-Barré (ostra zapalna poliradikulopatia demielinizacyjna), schwannomatosis , przewlekła zapalna polineuropatia demielinizacyjna i trąd to wszystkie neuropatie obejmujące komórki Schwanna.
Struktura
| Komórki Schwanna owinięte wokół aksonu |
|---|
Komórki Schwanna to różnorodne komórki glejowe, które utrzymują przy życiu włókna nerwów obwodowych (zarówno zmielinizowane, jak i niezmielinizowane). W mielinowanych aksonach komórki Schwanna tworzą osłonkę mielinową . Pochewka nie jest ciągła. Poszczególne mielinujące komórki Schwanna pokrywają około 1 mm aksonu – co odpowiada około 1000 komórkom Schwanna na długości 1 m aksonu. Odstępy między sąsiednimi komórkami Schwanna nazywane są węzłami Ranviera .
Gangliozyd 9-O-acetylo GD3 jest acetylowanym glikolipidem, który znajduje się w błonach komórkowych wielu typów komórek kręgowców. Podczas regeneracji nerwów obwodowych 9-O-acetyl GD3 jest wyrażany przez komórki Schwanna.
Funkcjonować
Układ nerwowy kręgowców polega na osłonce mielinowej do izolacji i jako metoda zmniejszania pojemności błony w aksonie. Potencjalne działanie przechodzi z węzła do węzła, w procesie zwanym skoczny przewodzenia , co zwiększa przewodzenie prędkość aż do 10 razy, bez potrzeby zwiększania średnicy aksonów. W tym sensie, komórki Schwanna są analogi PNS męska z ośrodkowego układu nerwowego „s oligodentrocyty . Jednak w przeciwieństwie do oligodendrocytów, każda mielinizująca komórka Schwanna zapewnia izolację tylko dla jednego aksonu (patrz zdjęcie). Ten układ pozwala na słone przewodzenie potencjałów czynnościowych z rozmnażaniem się w węzłach Ranviera. W ten sposób mielinizacja znacznie zwiększa szybkość przewodzenia i oszczędza energię.
Niemielinizujące komórki Schwanna biorą udział w utrzymaniu aksonów i mają kluczowe znaczenie dla przeżycia neuronów. Niektóre grupują się wokół mniejszych aksonów ( tutaj zewnętrzny obraz ) i tworzą wiązki Remak .
Mielinizujące się komórki Schwanna zaczynają tworzyć osłonkę mielinową u ssaków podczas rozwoju płodowego i pracują spiralnie wokół aksonu, czasami nawet ze 100 obrotami. Dobrze rozwinięta komórka Schwanna ma kształt zwiniętej kartki papieru, z warstwami mieliny pomiędzy każdą cewką. Wewnętrzne warstwy owinięcia, które są głównie materiałem błonowym , tworzą osłonkę mielinową, podczas gdy najbardziej zewnętrzna warstwa cytoplazmy jądrzastej tworzy neurilemmę . Tylko niewielka objętość resztkowej cytoplazmy umożliwia komunikację między warstwą wewnętrzną i zewnętrzną. Jest to postrzegane histologicznie jako nacięcie Schmidta-Lantermanna .
Regeneracja
Komórki Schwanna są znane ze swojej roli we wspomaganiu regeneracji nerwów . Nerwy w PNS składają się z wielu aksonów zmielinizowanych przez komórki Schwanna. W przypadku uszkodzenia nerwu komórki Schwanna pomagają w trawieniu jego aksonów ( fagocytoza ). Po tym procesie komórki Schwanna mogą kierować regeneracją, tworząc rodzaj tunelu, który prowadzi do neuronów docelowych. Ten tunel jest znany jako pas Büngnera , tor prowadzący dla regenerujących się aksonów, który zachowuje się jak rurka śródnerwowa. Kikut uszkodzonego aksonu jest w stanie wykiełkować, a te pędy, które wyrastają przez „tunel” komórek Schwanna, robią to z prędkością około 1 mm/dzień w dobrych warunkach. Tempo regeneracji maleje z czasem. Skuteczne aksony mogą zatem ponownie łączyć się z mięśniami lub narządami, które wcześniej kontrolowały za pomocą komórek Schwanna, ale specyficzność nie jest zachowana i błędy są częste, zwłaszcza gdy w grę wchodzą duże odległości. Ze względu na ich zdolność do wpływania na regenerację aksonów, komórki Schwanna powiązano również z preferencyjną reinerwacją motoryczną . Jeśli uniemożliwi się komórkom Schwanna łączenie się z aksonami, aksony umierają. Regenerujące się aksony nie dotrą do żadnego celu, chyba że są tam komórki Schwanna, które je wspierają i prowadzą . Wykazano, że wyprzedzają szyszki wzrostu .
Komórki Schwanna są niezbędne do utrzymania zdrowych aksonów. Wytwarzają różne czynniki, w tym neurotrofiny , a także przenoszą niezbędne molekuły do aksonów.
Genetyka
Tworzenie komórek Schwanna
Sox10
SOX10 jest czynnikiem transkrypcyjnym aktywnym podczas rozwoju embrionalnego, a liczne dowody wskazują, że jest on niezbędny do tworzenia linii glejowych z komórek grzebienia tułowia. Kiedy SOX10 jest dezaktywowany u myszy, glej satelitarny i prekursory komórek Schwanna nie rozwijają się, chociaż neurony są normalnie generowane bez problemu. W przypadku braku SOX10, komórki grzebienia nerwowego przeżywają i mogą swobodnie generować neurony, ale specyfikacja glejowa jest zablokowana. SOX10 może wpływać na wczesne prekursory glejowe w odpowiedzi na neuregulinę 1 (patrz poniżej).
Neuregulina 1
Neuregulina 1 (NRG1) działa na wiele sposobów, zarówno promując tworzenie, jak i zapewniając przeżycie niedojrzałych komórek Schwanna. Podczas rozwoju embrionalnego NRG1 hamuje tworzenie neuronów z komórek grzebienia nerwowego, zamiast tego przyczynia się do kierowania komórek grzebienia nerwowego na ścieżkę gliogenezy. Sygnalizacja NRG1 nie jest jednak wymagana do odróżnienia gleju od grzebienia nerwowego.
NRG1 odgrywa ważną rolę w rozwoju pochodnych grzebienia nerwowego. Komórki grzebienia nerwowego muszą migrować poza miejsce zwojów korzeni grzbietowych w celu znalezienia brzusznych obszarów zwoju współczulnego. Jest to również niezbędny czynnik przeżycia pochodzący z aksonów i mitogen dla prekursorów komórek Schwanna. Znajduje się w zwoju korzenia grzbietowego i neuronach ruchowych w momencie, gdy prekursory komórek Schwanna zaczynają zasiedlać nerwy rdzeniowe, a tym samym wpływają na przeżycie komórek Schwanna. W nerwach embrionalnych izoforma transbłonowa III jest prawdopodobnie głównym wariantem NRG1 odpowiedzialnym za sygnały przeżycia. U myszy pozbawionych izoformy transbłonowej III prekursory komórek Schwanna są ostatecznie eliminowane z nerwów rdzeniowych.
Tworzenie osłonki mielinowej
P0
Białko mieliny zero (P0) jest cząsteczką adhezji komórkowej należącą do nadrodziny immunoglobulin i jest głównym składnikiem mieliny obwodowej, stanowiąc ponad 50% całkowitego białka w otoczce. Wykazano, że P0 jest niezbędne do tworzenia zwartej mieliny, ponieważ myszy z zerowym mutacją P0 (P0-) wykazywały poważnie nieprawidłową mielinizację obwodową. Chociaż mielinizacja aksonów dużego kalibru została zapoczątkowana u myszy P0-, powstałe warstwy mieliny były bardzo cienkie i słabo zagęszczone. Nieoczekiwanie myszy P0- wykazywały również degenerację obu aksonów i otaczających ich osłonek mielinowych, co sugeruje, że P0 odgrywa rolę w utrzymaniu integralności strukturalnej zarówno tworzenia mieliny, jak i aksonu, z którym jest powiązana. U myszy P0- rozwinęły się deficyty behawioralne około 2 tygodnia życia, kiedy myszy zaczęły wykazywać oznaki lekkiego drżenia. Poważna niekoordynacja pojawiała się również w miarę rozwoju zwierząt, podczas gdy drżenie stawało się silniejsze, a niektóre starsze myszy rozwijały zachowania konwulsyjne. Pomimo szeregu zaburzonych zachowań motorycznych, u tych zwierząt nie zaobserwowano paraliżu. P0 jest również ważnym genem ulegającym ekspresji wcześnie w linii komórkowej Schwanna, ulegającym ekspresji w prekursorach komórek Schwanna po różnicowaniu się z migrującymi komórkami grzebienia nerwowego w rozwijającym się zarodku.
Krox-20
Kilka ważnych czynników transkrypcyjnych jest również wyrażanych i zaangażowanych na różnych etapach rozwoju, zmieniając cechy komórek Schwanna ze stanu niedojrzałego na dojrzały. Jednym z niezbędnych czynników transkrypcyjnych wyrażanych podczas procesu mielinizacji jest Krox-20. Jest to ogólny czynnik transkrypcyjny palca cynkowego i jest wyrażany w rombomerach 3 i 5.
Krox-20 jest uważany za jeden z głównych regulatorów mielinizacji PNS i jest ważny w kierowaniu transkrypcją określonych białek strukturalnych w mielinie. Wykazano, że kontroluje zestaw genów odpowiedzialnych za ingerencję w tę cechę w aksonie, zmieniając go ze stanu promielinizacji na mielinizację. W ten sposób, u myszy z podwójnym nokautem Krox-20 odnotowano, że wpływa to na segmentację tyłomózgowia oraz mielinizację aksonów związanych z komórkami Schwanna. Rzeczywiście, u tych myszy komórki Schwanna nie są w stanie prawidłowo przeprowadzić mielinizacji, ponieważ owijają swoje procesy cytoplazmatyczne tylko o półtora obrotu wokół aksonu i pomimo faktu, że nadal eksprymują wczesny marker mieliny, produkty późnego genu mieliny są nieobecne . Ponadto ostatnie badania wykazały również znaczenie tego czynnika transkrypcyjnego w utrzymaniu fenotypu mielinizacji (i wymaga koekspresji Sox 10), ponieważ jego inaktywacja prowadzi do odróżnicowania komórek Schwanna.
Znaczenie kliniczne
Choroba Charcota-Mariego-Tootha (CMT), zespół Guillain-Barré (GBS, ostra zapalna poliradikulopatia demielinizacyjna), schwannomatosis i przewlekła zapalna polineuropatia demielinizacyjna (CIDP), trąd i wirus Zika to wszystkie neuropatie obejmujące komórki Schwanna.
Przeszczep
Szereg badań eksperymentalnych od 2001 roku wszczepiło komórki Schwanna w celu wywołania remielinizacji u pacjentów dotkniętych stwardnieniem rozsianym. W ciągu ostatnich dwóch dekad wiele badań wykazało pozytywne wyniki i potencjał przeszczepu komórek Schwanna jako terapii urazu rdzenia kręgowego, zarówno we wspomaganiu odrastania, jak i mielinizacji uszkodzonych aksonów OUN. Wykazano, że przeszczepy komórek Schwanna w połączeniu z innymi terapiami, takimi jak chondroitynaza ABC, są również skuteczne w odzyskiwaniu funkcji po urazie rdzenia kręgowego.
Zobacz też
- Elektrofizjologia
- Model Hodgkina-Huxleya
- Mesakson
- Neuroprzekaźnictwo
- Komórka węchowa
- Schwannoma
- Lista typów komórek ludzkich pochodzących z listków zarodkowych
Bibliografia
Zewnętrzne linki
- Schemat na clc.uc.edu
- Obraz histologiczny: 21301loa – Histology Learning System na Uniwersytecie w Bostonie — „Ultrastruktura komórki: mielinizowany akson i komórka Schwanna”
- Baza danych skoncentrowana na komórkach — komórka Schwanna


