Standardowa masa atomowa - Standard atomic weight
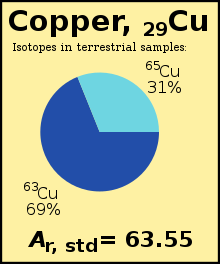
Średnia masa atomowa ( R standardowy (E)) z pierwiastka jest średnia ważona o stosunku izotopów mas wszystkich izotopów tego pierwiastka ważone przez obfitość każdego izotopu jest na Ziemi . Na przykład izotop 63 Cu ( A r = 62,929) stanowi 69% miedzi na Ziemi, reszta to 65 Cu ( A r = 64,927), więc
Ponieważ względne masy izotopowe są wielkościami bezwymiarowymi , ta średnia ważona jest również bezwymiarowa. Można ją przekształcić na miarę masy (o wymiarze M ) poprzez pomnożenie jej przez dalton , znany również jako stała masy atomowej.
Spośród różnych wariantów pojęciem masy atomowej ( r , znany również jako względną masę atomową ) wykorzystywane przez naukowców, średnia masa atomowa ( R standardowe ) jest najbardziej rozpowszechnioną i praktyczne. Standardowa masa atomowa każdego pierwiastka chemicznego jest określana i publikowana przez Komisję ds. Obfitości I Masy Atomowej (CIAAW) Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC) w oparciu o naturalne, stabilne, ziemskie źródła pierwiastka. Definicja określa użycie próbek z wielu reprezentatywnych źródeł z Ziemi, tak aby wartość mogła być szeroko stosowana jako „masa atomowa” substancji, jakie występują w rzeczywistości – na przykład w farmaceutykach i badaniach naukowych. Niestandardowe masy atomowe pierwiastka są specyficzne dla źródeł i próbek, takie jak masa atomowa węgla w konkretnej kości z określonego stanowiska archeologicznego. Standardowa masa atomowa uśrednia takie wartości do zakresu mas atomowych, których chemik mógłby oczekiwać na podstawie wielu losowych próbek z Ziemi. Ten zakres jest uzasadnieniem dla notacji przedziałów podanej dla niektórych standardowych wartości mas atomowych.
Ze 118 znanych pierwiastków chemicznych 80 ma stabilne izotopy, a 84 ma wartość opartą na środowisku ziemskim. Zazwyczaj taką wartością jest np. hel: A r, standard (He) = 4.002 602 (2) . „(2)” wskazuje niepewność w ostatniej pokazanej cyfrze, do odczytania4,002 602 ± 0,000 002 . IUPAC publikuje również wartości skrócone , zaokrąglone do pięciu cyfr znaczących. Helu, r, skrócone (He) = 4.0026 .
W przypadku trzynastu elementów próbki różnią się od tej wartości, ponieważ ich źródła próbek mają inną historię zaniku. Na przykład tal (Tl) w skałach osadowych ma inny skład izotopowy niż w skałach magmowych i gazach wulkanicznych. W przypadku tych elementów, a średnia masa atomowa zauważyć jako przedział: A r, średnia (Tl) = [204.38, 204.39] . Z takim odstępem, w mniej wymagających sytuacjach, IUPAC publikuje również wartość konwencjonalną . Na tal R konwencjonalne (Tl) = 204,38 .
Definicja

Średnia masa atomowa jest specjalną wartością względną masę atomową. Definiuje się ją jako „zalecane wartości” względnych mas atomowych źródeł w lokalnym środowisku skorupy ziemskiej i atmosfery, określone przez Komisję IUPAC ds. Mas atomowych i Obfitości Izotopów (CIAAW). Ogólnie rzecz biorąc, wartości z różnych źródeł podlegają naturalnej zmienności ze względu na inną radioaktywną historię źródeł. Zatem standardowe masy atomowe są oczekiwanym zakresem mas atomowych z szeregu próbek lub źródeł. Ograniczając źródła wyłącznie do pochodzenia ziemskiego, wartości określone przez CIAAW mają mniejszą wariancję i są bardziej precyzyjną wartością dla względnych mas atomowych (mas atomowych) faktycznie znalezionych i stosowanych w materiałach światowych.
Te wartości CIAAW publikowane są wykorzystywane zgodnie z prawem, a czasem wymaga obliczeń masowych. Wartości mają niepewność (zanotowaną w nawiasach) lub są przedziałem oczekiwanym (patrz przykład na ilustracji bezpośrednio powyżej). Ta niepewność odzwierciedla naturalną zmienność w rozkładzie izotopowym dla pierwiastka, a nie niepewność pomiaru (która jest znacznie mniejsza w przypadku przyrządów wysokiej jakości).
Chociaż próbuje się pokryć zakres zmienności na Ziemi standardowymi masami atomowymi, znane są przypadki próbek minerałów, które zawierają pierwiastki o masach atomowych, które są odstające od standardowego zakresu masy atomowej.
W przypadku pierwiastków syntetycznych powstający izotop zależy od sposobu syntezy, więc pojęcie naturalnej obfitości izotopów nie ma znaczenia. Dlatego dla pierwiastków syntetycznych całkowita liczba nukleonów najbardziej stabilnego izotopu (tj. izotopu o najdłuższym okresie półtrwania) jest podana w nawiasach, zamiast standardowej masy atomowej.
Kiedy termin „masa atomowa” jest używany w chemii, zwykle sugeruje się bardziej konkretną standardową masę atomową. Są to standardowe masy atomowe, które są używane w tablicach okresowych i wielu standardowych odniesieniach w zwykłej chemii lądowej.
Lit stanowi wyjątkowy przypadek, w którym naturalne obfitości izotopów zostały w niektórych przypadkach zakłócone przez ludzkie czynności rozdzielania izotopów do tego stopnia, że wpływają na niepewność jego standardowej masy atomowej, nawet w próbkach uzyskanych ze źródeł naturalnych, takich jak rzeki.
Definicja naziemna
Przykładem, dlaczego „konwencjonalne źródła naziemne” muszą być wyszczególnione przy podawaniu standardowych wartości masy atomowej, jest pierwiastek argon. Pomiędzy lokalizacjami w Układzie Słonecznym masa atomowa argonu zmienia się nawet o 10%, ze względu na ekstremalną zmienność składu izotopowego. Gdzie głównym źródłem argonu jest rozpad40
K w skałach,40
Dominującym izotopem będzie Ar . Takie lokalizacje obejmują planety Merkury i Mars oraz księżyc Tytan. Na Ziemi stosunki trzech izotopów 36 Ar : 38 Ar : 40 Ar wynoszą w przybliżeniu 5 : 1 : 1600, co daje argonowi ziemskiemu standardową masę atomową 39,948(1).
Jednak tak nie jest w reszcie wszechświata. Argon produkowany bezpośrednio przez gwiezdną nukleosyntezę jest zdominowany przez nuklid procesu alfa36
Ar . Odpowiednio argon słoneczny zawiera 84,6%36
Ar (według pomiarów wiatru słonecznego ), a stosunek trzech izotopów 36 Ar : 38 Ar : 40 Ar w atmosferach planet zewnętrznych wynosi 8400 : 1600 :1. Masa atomowa argonu w Słońcu i większości wszechświat miałby więc tylko około 36,3.
Przyczyny niepewności na Ziemi
Wiadomo, że opublikowana wartość masy atomowej jest niepewna. Ta niepewność (i związana z nią precyzja) wynika z jej definicji, której źródłem jest „ziemskie i stabilne”. Systematyczne przyczyny niepewności to:
- Granice pomiaru. Jak zawsze pomiar fizyczny nigdy nie jest skończony. Zawsze można znaleźć i przeczytać więcej szczegółów. Dotyczy to każdego pojedynczego , czystego znalezionego izotopu. Na przykład dzisiaj masę głównego naturalnego izotopu fluoru ( fluor-19 ) można zmierzyć z dokładnością do jedenastu miejsc po przecinku:18,998 403 163 (6) . Ale może stać się dostępny jeszcze bardziej precyzyjny system pomiarowy, generujący więcej ułamków dziesiętnych.
- Niedoskonałe mieszaniny izotopów. W pobranych i zmierzonych próbkach mieszanka (względna liczebność) tych izotopów może się różnić. Na przykład miedź. Podczas gdy na ogół jej dwa izotopy stanowią 69,15% i 30,85% wszystkich znalezionych miedzi, naturalna próbka mierzona może mieć niepełne „zamieszanie”, a więc procenty są różne. Precyzja jest oczywiście poprawiana poprzez pomiar większej liczby próbek, ale pozostaje ta przyczyna niepewności. (Przykład: próbki ołowiu różnią się tak bardzo, że nie można tego określić dokładniej niż cztery cyfry:207.2 )
- Źródła ziemskie o innej historii. Źródło jest obszar większy badane, na przykład „morskie wody” lub „skała wulkaniczna” (w przeciwieństwie do próbki „”: pojedyncza sterty materiału badana). Wydaje się, że niektóre pierwiastki mają inną mieszankę izotopową na źródło. Na przykład tal w skale magmowej zawiera więcej lżejszych izotopów, podczas gdy w skale osadowej ma więcej ciężkich izotopów. Nie ma ziemskiej średniej liczby. Elementy te pokazują notację przedziałową: A r, standard (Tl) = [204,38 , 204,39 ]. Ze względów praktycznych publikowany jest również uproszczony „konwencjonalny” numer (dla Tl: 204,38).
Te trzy niepewności mają charakter kumulacyjny. Opublikowana wartość jest wynikiem tego wszystkiego.
Wyznaczanie względnej masy atomowej
Współczesne względne masy atomowe (termin specyficzny dla danej próbki pierwiastka) są obliczane na podstawie zmierzonych wartości masy atomowej (dla każdego nuklidu) i składu izotopowego próbki. Bardzo dokładne masy atomowe są dostępne dla praktycznie wszystkich nieradioaktywnych nuklidów, ale składy izotopowe są trudniejsze do zmierzenia z dużą precyzją i bardziej podatne na zmienność między próbkami. Z tego powodu względne masy atomowe 22 pierwiastków jednonuklidowych (które są takie same jak masy izotopowe każdego z pojedynczych naturalnie występujących nuklidów tych pierwiastków) są znane ze szczególnie wysoką dokładnością. Na przykład, istnieje niepewność tylko jednej części na 38 milionów dla względnej masy atomowej fluoru , co jest precyzją, która jest większa niż obecnie najlepsza wartość stałej Avogadro (jedna część na 20 milionów).
| Izotop | Masa atomowa | Obfitość | |
|---|---|---|---|
| Standard | Zasięg | ||
| 28 Si | 27.976 926 532 46(194) | 92,2297(7)% | 92,21–92,25% |
| 29 Si | 28,976 494 700(22) | 4.6832(5)% | 4,67-4,69% |
| 30 Si | 29,973 770 171(32) | 3.0872(5)% | 3,08–3,10% |
Przykładem obliczeń jest krzem , którego względna masa atomowa jest szczególnie ważna w metrologii . Krzem występuje w naturze jako mieszanina trzech izotopów: 28 Si, 29 Si i 30 Si. Masy atomowe tych nuklidów są znane z dokładnością do jednej części na 14 miliardów dla 28 Si i około jednej części na miliard dla pozostałych. Jednak zakres naturalnej liczebności izotopów jest taki, że standardową liczebność można podać jedynie na poziomie około ±0,001% (patrz tabela). Obliczenie jest
- R (Si) = (x 0,922297 27,97693) + (0,046832 28,97649 x) + (0,030872 29,97377 x) = 28.0854
Oszacowanie niepewności jest skomplikowane, zwłaszcza że rozkład próbki niekoniecznie jest symetryczny: standardowe względne masy atomowe IUPAC są podawane z oszacowanymi niepewnościami symetrycznymi, a wartość dla krzemu wynosi 28,0855(3). Względna niepewność standardowa tej wartości wynosi 1 × 10 –5 lub 10 ppm. Aby jeszcze bardziej odzwierciedlić tę naturalną zmienność, w 2010 r. IUPAC podjął decyzję o wymienieniu względnych mas atomowych 10 pierwiastków jako przedziału, a nie jako stałą liczbę.
Kontrowersje nazewnictwa
Użycie nazwy „masa atomowa” wzbudziło wiele kontrowersji wśród naukowców. Przeciwnicy nazwy zwykle preferują określenie „względna masa atomowa” (nie mylić z masą atomową ). Sprzeciw podstawowy jest masa atomowa nie jest masa , to jest siła wywierana na przedmiot w polu grawitacyjnym , mierzona w jednostkach siły, takie jak Newton lub poundal .
W odpowiedzi zwolennicy terminu „masa atomowa” wskazują (między innymi), że:
- nazwa była w ciągłym użyciu dla tej samej ilości, odkąd została po raz pierwszy opracowana w 1808 roku;
- przez większość tego czasu masy atomowe rzeczywiście mierzono poprzez ważenie (czyli analizę grawimetryczną ) i nazwa wielkości fizycznej nie powinna się zmieniać tylko dlatego, że zmieniła się metoda jej wyznaczania;
- Termin „względna masa atomowa” powinny być zarezerwowane dla masy określonego izotopu (lub izotopem ), podczas gdy „atomowy masa ” może być wykorzystany do ważonej średniej o masie atomowej w zakresie wszystkich atomów w próbce;
- nierzadko zdarzają się mylące nazwy wielkości fizycznych, które są zachowywane ze względów historycznych, takie jak:
- siła elektromotoryczna , która nie jest siłą
- moc rozdzielcza , która nie jest wielkością mocy
- stężenie molowe , które nie jest ilością molową (ilość wyrażona na jednostkę ilości substancji).
Można by dodać, że masa atomowa również często nie jest prawdziwie „atomowa”, ponieważ nie odpowiada właściwości żadnego pojedynczego atomu. Ten sam argument można by wysnuć przeciwko „względnej masie atomowej” użytej w tym znaczeniu.
Opublikowane wartości
IUPAC publikuje jedną formalną wartość dla każdego stabilnego pierwiastka, zwaną standardową masą atomową . Wszelkie aktualizacje są publikowane co dwa lata (w nieparzystych latach). W 2015 roku zaktualizowano masę atomową iterbu. Do 2017 r. zmieniono 14 mas atomowych, w tym zmianę argonu z pojedynczej liczby na wartość przedziału.
Opublikowana wartość może mieć niepewność, jak w przypadku neonu: 20.1797(6) lub może być przedziałem, jak dla boru: [10.806, 10.821].
Oprócz tych 84 wartości IUPAC publikuje również wartości skrócone (do pięciu cyfr na liczbę), a dla dwunastu wartości przedziałowych wartości konwencjonalne (wartości jednoliczbowe).
Symbol R ma względną masę atomową, na przykład z konkretnej próbki. Mówiąc konkretnie, średnia masa atomowa można zauważyć w A r, standardowy (E) , gdzie (e) jest symbolem elementem.
Skrócona masa atomowa
Skrócone masie atomowej , a także opublikowane przez CIAAW wywodzi się od standardowej masie atomowej zmniejszenia liczby pięć cyfr (pięć cyfr znaczących). Nazwa nie mówi „zaokrąglony”.
Granice odstępu są zaokrąglone w dół do pierwszej (lowmost) granicy i do góry do góry (sprawą najwyższej) obramowania. W ten sposób w pełni pokrywany jest dokładniejszy oryginalny interwał.
Przykłady:
- Wapń: A r, standard (Ca) = 40,078(4) → A r, skrócony (Ca) = 40,078
- Hel: A r, standardowe (He) = 4,002602(2) → A r, skrócone (He) = 4,0026
- Wodór: R standardowe (H) = [1,00784, 1,00811] → R skróconego (H) = [1,0078, 1,0082]
Konwencjonalna masa atomowa
Trzynaście pierwiastków chemicznych ma standardową masę atomową, która jest definiowana nie jako pojedyncza liczba, ale jako przedział. Na przykład, wodór ma A r, średnia (H) = 1,00 [784 1,00811] . Ten zapis stwierdza, że różne źródła na Ziemi mają zasadniczo różne składy izotopowe, a niepewność jest zawarta w tych dwóch liczbach. Dla tych pierwiastków nie ma „średniej ziemskiej” konstytucji, a „właściwa” wartość nie jest jej środkiem (to byłoby 1,007975 dla wodoru, z niepewnością (±0,000135), która po prostu pokryłaby ten przedział). Jednak w sytuacjach, w których dopuszczalna jest mniej dokładna wartość, CIAAW opublikowała jednoliczbową konwencjonalną masę atomową, którą można wykorzystać na przykład w handlu. Atom wodoru, R konwencjonalne (H) = 1,008 . Trzynaście pierwiastków to: wodór, lit, bor, węgiel, azot, tlen, magnez, krzem, siarka, chlor, argon, brom i tal.
Formalna krótka masa atomowa
Stosując skróconą wartość i umowną wartość dla trzynastu wartości przedziału, można podać krótką wartość określoną przez IUPAC (5 cyfr plus niepewność) dla wszystkich stabilnych pierwiastków. W wielu sytuacjach iw tablicach okresowych może to być wystarczająco szczegółowe.
|
Przegląd: formalne wartości standardowej masy atomowej
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pierwiastek
(E) |
A r, standard (E) Tablica 1 |
Typ wartości |
A r, std skrócony (E) Tabela 2 |
A r, std konwencjonalne (E) Tabela 3 |
A r, std formalne krótkie (E) Tabele 2 i 3 |
Liczba masowa [najbardziej stabilny izotop] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| wodór | 1 godz | [1.007 84 , 1.008 11 ] | Interwał | [1.0078 , 1.0082 ] | 1.008 | 1.008 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| azot | 7 N | [14.006 43 , 14.007 28 ] | Interwał | [14.006 , 14.008 ] | 14.007 | 14.007 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fluor | 9 F | 18,998 403 163 (6) | Wartość (niepewność) | 18,998 | 18,998 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| wapń | 20 Ca | 40.078(4) | Wartość (niepewność) | 40.078(4) | 40.078(4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| technet | 43 Tc | (Żaden) | Najbardziej stabilny izotop | [97] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lista mas atomowych
| Z | Symbol | Nazwa | A r, standard | skrócony | standardowy | → formalny, krótki | rok się zmienił |
|---|---|---|---|---|---|---|---|
| 1 | H | wodór | [1.007 84 , 1.008 11 ] | [1.0078 , 1.0082 ] | 1.008 | 1.008 | 2009 |
| 2 | On | hel | 4.002 602 (2) | 4.0026 | 4.0026 | 1983 | |
| 3 | Li | lit | [6.938 , 6.997 ] | [6.938 , 6.997 ] | 6.94 | 6.94 | 2009 |
| 4 | Być | beryl | 9.012 1831 (5) | 9.0122 | 9.0122 | 2013 | |
| 5 | b | bor | [10.806 , 10.821 ] | [10.806 , 10.821 ] | 10.81 | 10.81 | 2009 |
| 6 | do | węgiel | [12.0096 , 12.0116 ] | [12.09 , 12.012 ] | 12.011 | 12.011 | 2009 |
| 7 | N | azot | [14.006 43 , 14.007 28 ] | [14.006 , 14.008 ] | 14.007 | 14.007 | 2009 |
| 8 | O | tlen | [15.999 03 , 15.999 77 ] | [15.999 , 16.000 ] | 15.999 | 15.999 | 2009 |
| 9 | fa | fluor | 18,998 403 163 (6) | 18,998 | 18,998 | 2013 | |
| 10 | Ne | neon | 20.1797(6) | 20.180 | 20.180 | 1985 | |
| 11 | Na | sód | 22.989 769 28 (2) | 22,990 | 22,990 | 2005 | |
| 12 | Mg | magnez | [24.304 , 24.307 ] | [24.304 , 24.307 ] | 24.305 | 24.305 | 2011 |
| 13 | Glin | aluminium | 26.981 5384 (3) | 26,982 | 26,982 | 2017 | |
| 14 | Si | krzem | [28.084 , 28.086 ] | [28.084 , 28.086 ] | 28,085 | 28,085 | 2009 |
| 15 | P | fosfor | 30,973 761 998 (5) | 30,974 | 30,974 | 2013 | |
| 16 | S | siarka | [32.059 , 32.076 ] | [32.059 , 32.076 ] | 32.06 | 32.06 | 2009 |
| 17 | Cl | chlor | [35.446 , 35.457 ] | [35.446 , 35.457 ] | 35,45 | 35,45 | 2009 |
| 18 | Ar | argon | [39,792 , 39,963 ] | [39,792 , 39,963 ] | 39,95 | 39,95 | 2017 |
| 19 | K | potas | 39.0983(1) | 39,098 | 39,098 | 1979 | |
| 20 | Ca | wapń | 40.078(4) | 40.078(4) | 40.078(4) | 1983 | |
| 21 | Sc | skand | 44.955 908 (5) | 44,956 | 44,956 | 2013 | |
| 22 | Ti | tytan | 47.867(1) | 47.867 | 47.867 | 1993 | |
| 23 | V | wanad | 50.9415(1) | 50,942 | 50,942 | 1977 | |
| 24 | Cr | chrom | 51.9961(6) | 51,996 | 51,996 | 1983 | |
| 25 | Mn | mangan | 54.938 043 (2) | 54,938 | 54,938 | 2017 | |
| 26 | Fe | żelazo | 55.845(2) | 55.845(2) | 55.845(2) | 1993 | |
| 27 | Współ | kobalt | 58,933 194 (3) | 58,933 | 58,933 | 2017 | |
| 28 | Ni | nikiel | 58.6934(4) | 58.693 | 58.693 | 2007 | |
| 29 | Cu | miedź | 63.546(3) | 63.546(3) | 63.546(3) | 1969 | |
| 30 | Zn | cynk | 65,38(2) | 65,38(2) | 65,38(2) | 2007 | |
| 31 | Ga | gal | 69,723(1) | 69,723 | 69,723 | 1987 | |
| 32 | Ge | german | 72.630(8) | 72.630(8) | 72.630(8) | 2009 | |
| 33 | Tak jak | arsen | 74 921 595 (6) | 74,922 | 74,922 | 2013 | |
| 34 | Se | selen | 78,971(8) | 78,971(8) | 78,971(8) | 2013 | |
| 35 | Br | brom | [79.901 , 79,907 ] | [79.901 , 79,907 ] | 79,904 | 79,904 | 2011 |
| 36 | Kr | krypton | 83.798(2) | 83.798(2) | 83.798(2) | 2001 | |
| 37 | Rb | rubid | 85.4678(3) | 85,468 | 85,468 | 1969 | |
| 38 | Sr | stront | 87,62(1) | 87,62 | 87,62 | 1969 | |
| 39 | Tak | itr | 88,905 84 (1) | 88,906 | 88,906 | 2017 | |
| 40 | Zr | cyrkon | 91.224(2) | 91.224(2) | 91.224(2) | 1983 | |
| 41 | Nb | niobu | 92.906 37 (1) | 92,906 | 92,906 | 2017 | |
| 42 | Mo | molibden | 95,95(1) | 95,95 | 95,95 | 2013 | |
| 43 | Tc | technet | - | - | |||
| 44 | Ru | ruten | 101.07(2) | 101.07(2) | 101.07(2) | 1983 | |
| 45 | Rh | rod | 102.905 49 (2) | 102,91 | 102,91 | 2017 | |
| 46 | Pd | paladium | 106,42(1) | 106,42 | 106,42 | 1979 | |
| 47 | Ag | srebro | 107,8682(2) | 107,87 | 107,87 | 1985 | |
| 48 | Płyta CD | kadm | 112,414(4) | 112,41 | 112,41 | 2013 | |
| 49 | W | ind | 114.818(1) | 114,82 | 114,82 | 2011 | |
| 50 | Sn | cyna | 118.710(7) | 118,71 | 118,71 | 1983 | |
| 51 | Sb | antymon | 121.760(1) | 121,76 | 121,76 | 1993 | |
| 52 | Te | tellur | 127,60(3) | 127,60(3) | 127,60(3) | 1969 | |
| 53 | ja | jod | 126.904 47 (3) | 126,90 | 126,90 | 1985 | |
| 54 | Xe | ksenon | 131.293(6) | 131,29 | 131,29 | 1999 | |
| 55 | Cs | cez | 132,905 451 96 (6) | 132,91 | 132,91 | 2013 | |
| 56 | Ba | bar | 137,327(7) | 137,33 | 137,33 | 1985 | |
| 57 | La | lantan | 138,905 47 (7) | 138,91 | 138,91 | 2005 | |
| 58 | Ce | cer | 140.116(1) | 140,12 | 140,12 | 1995 | |
| 59 | Pr | prazeodym | 140.907 66 (1) | 140,91 | 140,91 | 2017 | |
| 60 | Nd | neodym | 144.242(3) | 144,24 | 144,24 | 2005 | |
| 61 | Po południu | promet | - | - | |||
| 62 | Sm | samar | 150,36(2) | 150,36(2) | 150,36(2) | 2005 | |
| 63 | Eu | europ | 151,964(1) | 151,96 | 151,96 | 1995 | |
| 64 | Bóg | gadolin | 157.25(3) | 157.25(3) | 157.25(3) | 1969 | |
| 65 | Tb | terb | 158,925 354 (8) | 158,93 | 158,93 | 2017 | |
| 66 | Dy | dysproz | 162.500(1) | 162,50 | 162,50 | 2001 | |
| 67 | Ho | holmium | 164 930 328 (7) | 164,93 | 164,93 | 2017 | |
| 68 | Er | erb | 167.259(3) | 167,26 | 167,26 | 1999 | |
| 69 | Tm | tul | 168.934 218 (6) | 168,93 | 168,93 | 2017 | |
| 70 | Yb | iterb | 173.045(10) | 173,05 | 173,05 | 2015 | |
| 71 | Lu | lutet | 174,9668(1) | 174,97 | 174,97 | 2007 | |
| 72 | Hf | hafn | 178.486(6) | 178,49 | 178.49(2) | 2019 | |
| 73 | Ta | tantal | 180.947 88 (2) | 180,95 | 180,95 | 2005 | |
| 74 | W | wolfram | 183,84(1) | 183,84 | 183,84 | 1991 | |
| 75 | Re | ren | 186.207(1) | 186,21 | 186,21 | 1973 | |
| 76 | Os | osm | 190.23(3) | 190.23(3) | 190.23(3) | 1991 | |
| 77 | Ir | iryd | 192.217(2) | 192.22 | 192.22 | 2017 | |
| 78 | Pt | platyna | 195.084(9) | 195.08 | 195.08 | 2005 | |
| 79 | Au | złoto | 196.966 570 (4) | 196.97 | 196.97 | 2017 | |
| 80 | Hg | rtęć | 200.592(3) | 200,59 | 200,59 | 2011 | |
| 81 | Tl | tal | [204.382 , 204.385 ] | [204,38 , 204,39 ] | 204,38 | 204,38 | 2009 |
| 82 | Pb | prowadzić | [206.14 , 207.94 ] | [206.14 , 207.94 ] | 207,2 ± 1,1 | 207,2 ± 1,1 | 2021 |
| 83 | Bi | bizmut | 208.980 40 (1) | 208,98 | 208,98 | 2005 | |
| 84 | Po | polon | - | - | |||
| 85 | W | astatyn | - | - | |||
| 86 | Rn | radon | - | - | |||
| 87 | Fr | franko | - | - | |||
| 88 | Ra | rad | - | - | |||
| 89 | Ac | aktyn | - | - | |||
| 90 | Cz | tor | 232.0377(4) | 232.04 | 232.04 | 2013 | |
| 91 | Rocznie | protaktyn | 231.035 88 (1) | 231.04 | 231.04 | 2017 | |
| 92 | U | uran | 238.028 91 (3) | 238,03 | 238,03 | 1999 | |
| 93 | Np | neptun | - | - | |||
| 94 | Pu | pluton | - | - | |||
| 95 | Jestem | ameryk | - | - | |||
| 96 | Cm | kiur | - | - | |||
| 97 | Bk | berkel | - | - | |||
| 98 | cf | kaliforn | - | - | |||
| 99 | Es | einsteina | - | - | |||
| 100 | Fm | ferm | - | - | |||
| 101 | Md | mendelewen | - | - | |||
| 102 | Nie | nobel | - | - | |||
| 103 | Lr | lawrencium | - | - | |||
| 104 | Rf | rutherford | - | - | |||
| 105 | Db | dubniusz | - | - | |||
| 106 | Sg | seaborgium | - | - | |||
| 107 | Bh | bohrium | - | - | |||
| 108 | Hs | hasz | - | - | |||
| 109 | Mt | meitnerium | - | - | |||
| 110 | Ds | darmsztadt | - | - | |||
| 111 | Rg | rentgen | - | - | |||
| 112 | Cn | Kopernik | - | - | |||
| 113 | Nh | nihonium | - | - | |||
| 114 | Fl | flerow | - | - | |||
| 115 | Mc | moskwa | - | - | |||
| 116 | Lv | wątrobowiec | - | - | |||
| 117 | Ts | tennessine | - | - | |||
| 118 | Og | oganesson | - | - | |||
W układzie okresowym
Zobacz też
- Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC)
- Komisja ds. Obfitości Izotopów i Mas Atomowych (CIAAW)

