UGT2B7 - UGT2B7
UGT2B7 (UDP-glukuronozylotransferaza-2B7) jest izoenzymem metabolizmu II fazy, który jest aktywny w wątrobie , nerkach , komórkach nabłonka dolnego odcinka przewodu pokarmowego, a także w mózgu . U ludzi UDP-glukuronozylotransferaza-2B7 jest kodowana przez gen UGT2B7 .
Funkcjonować
UGT odgrywają główną rolę w koniugacji i późniejszej eliminacji potencjalnie toksycznych ksenobiotyków i związków endogennych. UGT2B7 ma niepowtarzalną swoistość 3,4 katecholowych estrogenów i estriolu , sugerując, że może odgrywać ważną rolę w regulowaniu poziomu i aktywności tych silnych metabolitów estrogenu.
Enzym ten znajduje się na retikulum endoplazmatycznym i błonach jądrowych komórek. Jego funkcją jest katalizowanie sprzęgania szerokiej gamy lipofilowych substratów aglikonu z kwasem glukuronowym przy użyciu kwasu urydynodifosforanowo-glukuronowego .
Wraz z UGT2B4 UGT2B7 jest zdolny do glukozydacji kwasu hiodeoksycholowego w wątrobie, ale w przeciwieństwie do izoformy 2B4, 2B7 jest również zdolny do glukuronidowania różnych hormonów steroidowych ( androsteronu , epitestosteronu ) i kwasów tłuszczowych . Jest również w stanie sprzęgać główne klasy leków, takich jak środki przeciwbólowe ( morfina ), karboksylowe niesteroidowe leki przeciwzapalne ( ketoprofen ) i przeciwrakowe (kwas all-trans retinowy ). UGT2B7 jest główną izoformą enzymu odpowiedzialną za metabolizm morfiny , kodeiny , norkodeiny i innych opiatów do odpowiadających im 3- i 6-glukuronidów. Na przykład, metabolizm morfiny wytwarza 3-glukuronid morfiny (M3G), który nie ma działania przeciwbólowego oraz 6-glukuronid morfiny (M6G), który ma działanie przeciwbólowe silniejsze niż morfina. W konsekwencji zmieniona aktywność UGT2B7 może znacząco wpływać zarówno na skuteczność, jak i skutki uboczne morfiny, a także niektórych pokrewnych leków opiatowych.
Struktura
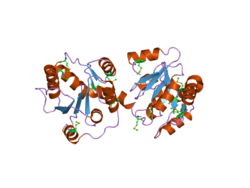
Nie ustalono jeszcze struktury pełnego ludzkiego enzymu UGT, jednak Miley et al. rozwiązano częściową strukturę UGT2B7 części C-końcowej, ukazując dwie domeny dimeryczne z złożonymi fałdami podobnymi do Rossmana . Fałd Rossmana zazwyczaj wiąże substraty nukleotydowe , w tym przypadku kofaktor kwasu UDP-glukuronowego zaangażowany w glukuronidację przez UGT2B7. Ogólnie rzecz biorąc, C-koniec enzymów UGT jest wysoce konserwatywny i wiąże kofaktor kwasu UDP-glukuronowego, podczas gdy N-koniec (nierozdzielony w tej strukturze) jest odpowiedzialny za wiązanie substratu. Ta pierwsza rozwiązana struktura wskazuje, że C-koniec jednego z dwóch dimerów wystaje w miejsce wiązania kwasu UDP-glukuronowego drugiego dimeru, czyniąc w ten sposób drugi dimer nieskutecznym.
Dalsze badania dotyczyły dimeryzacji polimorfizmów enzymów UGT i stwierdzono, że możliwe jest tworzenie zarówno homodimerów, jak i heterodimerów (z genetycznymi polimorfizmami UGT2B7 lub innymi enzymami UGT, takimi jak UGT1A1), przy czym niektóre kombinacje mają wpływ na aktywność enzymu.
Polimorfizm genetyczny
UGT2B7 jest uważany za gen wysoce polimorficzny. Różne prace badawcze badały potencjalny wpływ tych wariantów polimorficznych na aktywność glukuronidacyjną UGT2B7, a zwłaszcza jego klirens z podawanych leków , w tym terapii przeciwnowotworowych. Obniżona aktywność glukuronidacji przez wariant genetyczny UGT2B7 może prowadzić do zwiększonej toksyczności ze względu na podwyższony poziom leku pozostającego lub gromadzącego się w narządach pacjenta, zwłaszcza w wątrobie, podczas gdy zwiększona aktywność może oznaczać niższą skuteczność zastosowanej terapii ze względu na niższe niż oczekiwane stężenie w organizmie.
Jedno z badań wykazało, że pracownicy chińskiego przemysłu farbiarskiego Han narażeni na benzydynę byli bardziej narażeni na rozwój raka pęcherza, jeśli mieli polimorfizm pojedynczego nukleotydu UGT2B7 (SNP) C802T kodujący His268Tyr. Mutacja histydyny do tyrozyny w reszcie 268 znajduje się w N-końcowej części UGT2B7, która wiąże substrat ksenobiotyczny, w przeciwieństwie do końca C, który wiąże kwas UDP-glukuronowy. Spekulowany mechanizm tego zwiększonego ryzyka raka obejmował zwiększoną glukuronidację benzydyny przez zmutowany UGT2B7, a następnie rozszczepienie glukuronidowanej benzydyny przy poziomach pH moczu, uwalniając wyższe stężenia benzydyny w pęcherzu. W innym badaniu szukano podobnego związku wariantu UGT2B7 G900A z ryzykiem raka jelita grubego, ale nie znaleziono znaczącego związku.
Badanie klirensu erlotynibu u pacjentów z niedrobnokomórkowym rakiem płuca nie wykazało statystycznego znaczenia dla SNP UGT2B7, który potencjalnie metabolizuje erlotynib, na co wskazuje hamowanie przez erlotynib UGT2B7. Badanie klirensu diklofenaku , niesteroidowego leku przeciwzapalnego (NLPZ), który może powodować poważne polekowe uszkodzenie wątroby , wykazało, że zmutowany UGT2B7 z SNP C802T miał 6-krotnie niższy klirens diklofenaku niż UGT27B typu dzikiego, prawdopodobnie przyczyniając się do zwiększonej toksyczności wątroby u pacjentów z tą mutacją. Analiza polimorfizmów genetycznych UGT2B7 w uszkodzeniu wątroby wywołanym lekiem przeciwgruźliczym (ATLI) nie wykazała związku między mutacjami UGT2B7 i ATLI w badanej populacji.
Wiadomo również, że UGT2B7 bierze udział w metabolizmie opioidów poprzez glukuronidację, a badanie dotyczące wpływu polimorfizmów na skuteczność przeciwbólową buprenorfiny wykazało, że mutacja C802T znacznie pogorszyła odpowiedź przeciwbólową na buprenorfinę po operacji klatki piersiowej , szczególnie w dłuższym czasie. punkty (48 godzin), w których ten długotrwały opioid ma pozostać skuteczny. Oddzielnie stwierdzono, że ten sam wariant ma znaczący wpływ na stężenie kwasu walproinowego w osoczu krwi podawanego pacjentom z padaczką , co może wyjaśniać pewną indywidualną zmienność obserwowaną w przypadku tego leczenia o wąskim oknie terapeutycznym . Oba te przypadki wskazują na zmniejszone stężenia związku leku prawdopodobnie z powodu zwiększonej aktywności glukuronidacyjnej UGT2B7 z polimorfizmem C802T.
Ponieważ UGT2B7 bierze udział w glukuronidacji wielu związków ksenobiotycznych , a polimorfizmy UGT2B7 są dominujące, badanie potencjalnego wpływu polimorfizmów UGT2B7 na klirens farmakologicznie istotnych związków jest często przedmiotem zainteresowania, jak pokazują różnorodne podjęte badania. Na przykład polimorfizm UGT2B7 C802T odnotowano w 73% rozpowszechnieniu u Azjatów i 46% u rasy kaukaskiej; dlatego skutki tego polimorfizmu mogą mieć wpływ na dużą część populacji. Jednak nie wszystkie badania wykazują znaczące zmiany w klirensie z powodu tych polimorfizmów genetycznych. Nie zawsze jest jasne, czy jest to spowodowane szczególnym polimorfizmem, który nie wpływa na aktywność enzymatyczną UGT2B7, czy też ponieważ związek będący przedmiotem zainteresowania jest metabolizowany różnymi drogami, które mogą maskować wszelkie różnice spowodowane zmianami aktywności UGT2B7.
Bibliografia
Dalsza lektura
- Kwara A, Lartey M, Boamah I, Rezk NL, Oliver-Commey J, Kenu E, Kaszuba AD, Court MH (wrzesień 2009). „Zmienność międzyosobnicza w farmakokinetyce generycznych nukleozydowych inhibitorów odwrotnej transkryptazy u pacjentów z Ghany zakażonych gruźlicą/HIV: UGT2B7*1c wiąże się z szybszym klirensem zydowudyny i glukuronidacją” . Czasopismo Farmakologii Klinicznej . 49 (9): 1079–90. doi : 10.1177/0091270009338482 . PMC 2749505 . PMID 19628728 .
- Hwang MS, Lee SJ, Jeong HE, Lee S, Yoo MA, Shin JG (2010). „Odmiany genetyczne w genie UDP-glukuronozylotransferazy 2B7 (UGT2B7) w populacji koreańskiej”. Metabolizm leków i farmakokinetyka . 25 (4): 398–402. doi : 10.2133/dmpk.DMPK-10-SC-021 . PMID 20814162 .
- Rose JE, Behm FM, Drgon T, Johnson C, Uhl GR (2010). „Spersonalizowane zaprzestanie palenia: interakcje między dawką nikotyny, uzależnieniem i wynikiem genotypu rzucenia palenia” . Medycyna molekularna . 16 (7-8): 247-53. doi : 10.2119/molmed.2009.00159 . PMC 2896464 . PMID 20379614 .
- Holmes MV, Shah T, Vickery C, Smeeth L, Hingorani AD, Casas JP (grudzień 2009). „Spełnienie obietnicy medycyny spersonalizowanej? Przegląd systematyczny i podsumowanie badań farmakogenetycznych w terenie” . PLOS 1 . 4 (12): e7960. Kod Bib : 2009PLoSO...4.7960H . doi : 10.1371/journal.pone.0007960 . PMC 2778625 . PMID 19956635 .
- Kwara A, Lartey M, Sagoe KW, Kenu E, Court MH (październik 2009). „Polimorfizmy genetyczne CYP2B6, CYP2A6 i UGT2B7 są predyktorami średniego stężenia efawirenzu u pacjentów zakażonych wirusem HIV” . AIDS . 23 (16): 2101–6. doi : 10.1097/QAD.0b013e3283319908 . PMC 2875867 . PMID 19779319 .
- Setlur SR, Chen CX, Hossain RR, Ha JS, Van Doren VE, Stenzel B, Steiner E, Oldridge D, Kitabayashi N, Banerjee S, Chen JY, Schäfer G, Horninger W, Lee C, Rubin MA, Klocker H, Demichelis F (styczeń 2010). „Zmienność genetyczna genów zaangażowanych w metabolizm dihydrotestosteronu i ryzyko raka prostaty” (PDF) . Epidemiologia nowotworów, biomarkery i profilaktyka . 19 (1): 229–39. doi : 10.1158/1055-9965.EPI-09-1018 . PMID 20056642 . S2CID 11725521 .
- Sánchez MB, Herranz JL, Leno C, Arteaga R, Oterino A, Valdizán EM, Nicolás JM, Adín J, Armijo JA (marzec 2010). „Czynniki genetyczne związane z lekoopornością padaczki: znaczenie stratyfikacji według wieku pacjenta i etiologii padaczki” . Zajęcie . 19 (2): 93-101. doi : 10.1016/j.seizure.2009.12.004 . PMID 20064729 . S2CID 17525536 .
- Chen M, LeDuc B, Kerr S, Howe D, Williams DA (marzec 2010). „Identyfikacja ludzkiego UGT2B7 jako głównej izoformy zaangażowanej w O-glukuronidację chloramfenikolu”. Metabolizm i rozmieszczenie leków . 38 (3): 368–75. doi : 10.1124/dmd.109.029900 . PMID 20008037 . S2CID 10438280 .
- Ross CJ, Katzov-Eckert H, Dubé MP, Brooks B, Rassekh SR, Barhdadi A, Feroz-Zada Y, Visscher H, Brown AM, Rieder MJ, Rogers PC, Phillips MS, Carleton BC, Hayden MR (grudzień 2009). „Warianty genetyczne w TPMT i COMT są związane z utratą słuchu u dzieci otrzymujących chemioterapię cisplatyną”. Genetyka przyrody . 41 (12): 1345–9. doi : 10.1038/ng.478 . PMID 19898482 . S2CID 21293339 .
- Tang L, Ye L, Singh R, Wu B, Lv C, Zhao J, Liu Z, Hu M (czerwiec 2010). „Wykorzystanie odcisku palca glukuronidacji do opisania i przewidywania metabolizmu mono- i dihydroksyflawonu przez rekombinowane izoformy UGT oraz ludzkie mikrosomów jelitowych i wątrobowych” . Farmaceutyka molekularna . 7 (3): 664–79. doi : 10.1021/mp900223c . PMC 2941766 . PMID 20297805 .
- Woillard JB, Rerolle JP, Picard N, Rousseau A, Drouet M, Munteanu E, Essig M, Marquet P, Le Meur Y (czerwiec 2010). „Ryzyko biegunki w długoterminowej kohorcie pacjentów po przeszczepieniu nerki, którym podawano mykofenolan mofetylu: istotna rola wariantu allelu UGT1A8 2” . Brytyjski Czasopismo Farmakologii Klinicznej . 69 (6): 675–83. doi : 10.1111/j.1365-2125.2010.03625.x . PMC 2883760 . PMID 20565459 .
- Yu L, Qian M, Liu Y, Yao T, Zeng S (maj 2010). „Stereoselektywny metabolizm glukuronidacji propranololu przez ludzkie UDP-glukuronozylotransferazy 2B7 i 1A9”. Chiralność . 22 (4): 456–61. doi : 10.1002/chir.20765 . PMID 19644937 .
- Yang JW, Lee PH, Hutchinson IV, Pravica V, Shah T, Min DI (październik 2009). „Genetyczne polimorfizmy MRP2 i UGT2B7 oraz objawy żołądkowo-jelitowe u biorców przeszczepu nerki przyjmujących kwas mykofenolowy”. Monitorowanie leków terapeutycznych . 31 (5): 542–8. doi : 10.1097/FTD.0b013e3181b1dd5e . PMID 19730281 . S2CID 6454841 .
- Ahn J, Schumacher FR, Berndt SI, Pfeiffer R, Albanes D, Andriole GL, Ardanaz E, Boeing H, Bueno-de-Mesquita B, Chanock SJ, Clavel-Chapelon F, Diver WR, Feigelson HS, Gaziano JM, Giovannucci E , Haiman CA, Henderson BE, Hoover RN, Kolonel LN, Kraft P, Ma J, Le Marchand L, Overvad K, Palli D, Stattin P, Stampfer M, Stram DO, Thomas G, Thun MJ, Travis RC, Trichopoulos D, Virtamo J, Weinstein SJ, Yeager M, Kaaks R, Hunter DJ, Hayes RB (październik 2009). „Loci cech ilościowych przewidujące krążące steroidowe hormony płciowe u mężczyzn z konsorcjum kohortowego NCI-Breast and Prostate Cancer Cohort (BPC3)” . Genetyka molekularna człowieka . 18 (19): 3749–57. doi : 10,1093/hmg/ddp302 . PMC 2742399 . PMID 19574343 .
- Hu M, Lui SS, Mak VW, Chu TT, Lee VW, Poon EW, Tsui TK, Ko GT, Baum L, Tam LS, Li EK, Tomlinson B (październik 2010). „Analiza farmakogenetyczna odpowiedzi lipidowych na rosuwastatynę u chińskich pacjentów”. Farmakogenetyka i genomika . 20 (10): 634–7. doi : 10.1097/FPC.0b013e32833de489 . PMID 20679960 . S2CID 3475599 .
- Zhao W, Fakhoury M, Deschênes G, Roussey G, Brochard K, Niaudet P, Tsimaratos M, André JL, Cloarec S, Cochat P, Bensman A, Azougagh S, Jacqz-Aigrain E (listopad 2010). „Farmakokinetyka populacyjna i farmakogenetyka kwasu mykofenolowego po podaniu mykofenolanu mofetylu u dzieci po przeszczepieniu nerki de novo”. Czasopismo Farmakologii Klinicznej . 50 (11): 1280–91. doi : 10.1177/0091270009357429 . PMID 20147615 . S2CID 22875166 .
- Blanca Sánchez M, Herranz JL, Leno C, Arteaga R, Oterino A, Valdizán EM, Nicolas JM, Adín J, Shushtarian M, Armijo JA (kwiecień 2010). „Polimorfizm UGT2B7_-161C>T jest związany ze stosunkiem stężenia lamotryginy do dawki w badaniu wieloczynnikowym”. Monitorowanie leków terapeutycznych . 32 (2): 177–84. doi : 10.1097/FTD.0b013e3181ceecc6 . hdl : 10261/49808 . PMID 20216122 . S2CID 44807993 .
- Yong M, Schwartz SM, Atkinson C, Makar KW, Thomas SS, Newton KM, Aiello Bowles EJ, Holt VL, Leisenring WM, Lampe JW (luty 2010). „Związki między polimorfizmami enzymów glukuronidacji i siarczanowania a mammograficzną gęstością piersi u kobiet przed menopauzą w Stanach Zjednoczonych” . Epidemiologia nowotworów, biomarkery i profilaktyka . 19 (2): 537–46. doi : 10.1158/1055-9965.EPI-09-0898 . PMC 2820123 . PMID 20142249 .
- Joy MS, Boyette T, Hu Y, Wang J, La M, Hogan SL, Stewart PW, Falk RJ, Dooley MA, Smith PC (listopad 2010). „Wpływ farmakogenomiki urydynodifosforanu glukuronozylotransferazy 2B7 i 1A7 oraz parametrów klinicznych pacjenta na farmakokinetykę kwasu mykofenolowego w stanie stacjonarnym w kłębuszkowym zapaleniu nerek” . European Journal of Clinical Pharmacology . 66 (11): 1119–30. doi : 10.1007/s00228-010-0846-x . PMC 3739695 . PMID 20567810 .
Zewnętrzne linki
- człowiek+UGT2B7 w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- UGT2B7+białko,+człowiek w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- „GT2B7” . FarmaGKB . FarmaGKB . Pobrano 13.01.2009 .