Ununennium - Ununennium
| Ununennium | ||||||
|---|---|---|---|---|---|---|
| Wymowa |
/ ˌ ù n . ù n ɛ n i ə m / ( słuchania ) |
|||||
| Alternatywne nazwy | pierwiastek 119, eka-francium | |||||
| Ununennium w układzie okresowym | ||||||
| ||||||
| Liczba atomowa ( Z ) | 119 | |||||
| Grupa | grupa 1: wodór i metale alkaliczne | |||||
| Okres | okres 8 | |||||
| Blok | s-blok | |||||
| Konfiguracja elektronów | [ Og ] 8s 1 (przewidywane) | |||||
| Elektrony na powłokę | 2, 8, 18, 32, 32, 18, 8, 1 (przewidywane) | |||||
| Właściwości fizyczne | ||||||
| Faza w STP | nieznany (może być stały lub płynny) | |||||
| Temperatura topnienia | 273-303 K (0-30 ° C, 32-86 ° F) (przewidywane) | |||||
| Temperatura wrzenia | 903 K (630 °C, 1166 °F) (przewidywane) | |||||
| Gęstość (w pobliżu rt ) | 3 g / cm 3 (przewidywane) | |||||
| Ciepło stapiania | 2,01–2,05 kJ/mol (ekstrapolowane) | |||||
| Właściwości atomowe | ||||||
| Stany utleniania | ( +1 ), (+3) (przewidywane) | |||||
| Elektroujemność | Skala Paulinga: 0,86 (przewidywana) | |||||
| Energie jonizacji | ||||||
| Promień atomowy | empiryczne: 240 pm (przewidywane) | |||||
| Promień kowalencyjny | 263-281 po południu (ekstrapolowany) | |||||
| Inne właściwości | ||||||
| Struktura krystaliczna | Ciało skoncentrowane sześcienny (BCC)
(ekstrapolowane) |
|||||
| Numer CAS | 54846-86-5 | |||||
| Historia | ||||||
| Nazewnictwo | Nazwa systematyczna elementu IUPAC | |||||
Ununennium , znany również jako eka-francium lub pierwiastek 119 , jest hipotetycznym pierwiastkiem chemicznym o symbolu Uue i liczbie atomowej 119. Ununennium i Uue to odpowiednio tymczasowa systematyczna nazwa i symbol IUPAC , które są używane do czasu odkrycia pierwiastka, potwierdzenia i ustala się stałą nazwę. W układzie okresowym pierwiastków oczekuje się, że będzie to pierwiastek s-blokowy , metal alkaliczny i pierwszy pierwiastek w ósmym okresie . Jest to najlżejszy pierwiastek, który nie został jeszcze zsyntetyzowany.
Nieudane próby zsyntetyzowania tego pierwiastka trwają w RIKEN (Japonia) i Wspólnym Instytucie Badań Jądrowych ( Dubna , Rosja). Dowody teoretyczne i eksperymentalne wykazały, że synteza ununennium będzie prawdopodobnie znacznie trudniejsza niż poprzednich pierwiastków, a może to być nawet przedostatni pierwiastek, który można zsyntetyzować przy użyciu obecnej technologii.
Pozycja Ununennium jako siódmego metalu alkalicznego sugeruje, że miałby podobne właściwości do swoich lżejszych kongenerów . Jednak efekty relatywistyczne mogą sprawić, że niektóre jego właściwości będą odbiegać od tych, których można oczekiwać od prostego zastosowania trendów okresowych . Na przykład, oczekuje ununennium znajduje się mniej reaktywny niż cez i frans i bliżej w zachowaniu się potasu lub rubidu , a jednocześnie powinien wykazywać charakterystyczny +1 stopniu utlenienia metali alkalicznych, to również przewiduje się, że wykazują +3 stopień utlenienia, który jest nieznany w żadnym innym metalu alkalicznym.
Wstęp

| Wideo zewnętrzne | |
|---|---|
|
|
Najcięższe jądra atomowe powstają w reakcjach jądrowych, które łączą dwa inne jądra o nierównej wielkości w jedno; z grubsza im bardziej nierówne są dwa jądra pod względem masy, tym większe prawdopodobieństwo, że oba zareagują. Materiał z cięższych jąder zostaje przerobiony na cel, który jest następnie bombardowany przez wiązkę lżejszych jąder. Dwa jądra mogą się złączyć w jedno tylko wtedy, gdy zbliżą się do siebie wystarczająco blisko; normalnie jądra (wszystkie naładowane dodatnio) odpychają się nawzajem z powodu odpychania elektrostatycznego . Oddziaływanie silne może przezwyciężyć to odpychanie, ale tylko w bardzo niewielkiej odległości od jądra; jądra wiązki są zatem znacznie przyspieszane , aby takie odpychanie było nieznaczne w porównaniu z prędkością jądra wiązki. Samo zbliżenie się nie wystarcza, aby dwa jądra się złączyły: gdy dwa jądra zbliżają się do siebie, zwykle pozostają razem przez około 10-20 sekund, a następnie rozchodzą się (niekoniecznie w tym samym składzie jak przed reakcją) zamiast tworzyć pojedyncze jądro. Jeśli nastąpi fuzja, tymczasowe połączenie – zwane jądrem złożonym – jest stanem wzbudzonym . Aby stracić energię wzbudzenia i osiągnąć bardziej stabilny stan, złożone jądro albo rozszczepia się, albo wyrzuca jeden lub kilka neutronów , które odprowadzają energię. Dzieje się to w około 10-16 sekund po początkowej kolizji.
Wiązka przechodzi przez cel i dociera do następnej komory, separatora; jeśli wytworzone zostanie nowe jądro, jest ono niesione tą wiązką. W separatorze nowo wytworzone jądro jest oddzielane od innych nuklidów (pierwotnej wiązki i wszelkich innych produktów reakcji) i przenoszone do detektora bariery powierzchniowej , który zatrzymuje jądro. Zaznaczona jest dokładna lokalizacja nadchodzącego uderzenia w detektor; zaznaczona jest również jego energia i czas przybycia. Transfer trwa około 10-6 sekund; aby zostać wykrytym, jądro musi przetrwać tak długo. Jądro jest ponownie rejestrowane po zarejestrowaniu jego rozpadu i zmierzeniu lokalizacji, energii i czasu rozpadu.
Stabilność jądra zapewnia oddziaływanie silne. Jednak jego zasięg jest bardzo krótki; w miarę powiększania się jąder jego wpływ na najbardziej zewnętrzne nukleony ( protony i neutrony) słabnie. Jednocześnie jądro jest rozrywane przez odpychanie elektrostatyczne między protonami, ponieważ ma nieograniczony zasięg. Jądra najcięższych pierwiastków są zatem przewidywane teoretycznie i jak dotąd zaobserwowano, że rozpadają się głównie poprzez sposoby rozpadu, które są powodowane przez takie odpychanie: rozpad alfa i spontaniczne rozszczepienie ; tryby te dominują dla jąder pierwiastków superciężkich . Rozpady alfa są rejestrowane przez emitowane cząstki alfa , a produkty rozpadu są łatwe do określenia przed faktycznym rozpadem; jeśli taki rozpad lub seria kolejnych rozpadów wytwarza znane jądro, oryginalny produkt reakcji można wyznaczyć arytmetycznie. Spontaniczne rozszczepienie wytwarza jednak różne jądra jako produkty, więc nie można określić oryginalnego nuklidu na podstawie jego potomków.
Informacjami dostępnymi dla fizyków dążących do syntezy jednego z najcięższych pierwiastków są zatem informacje zbierane przez detektory: położenie, energia i czas przybycia cząstki do detektora oraz jej rozpadu. Fizycy analizują te dane i starają się dojść do wniosku, że rzeczywiście był on spowodowany przez nowy pierwiastek i nie mógł być spowodowany przez inny nuklid niż ten, który twierdził. Często podane dane są niewystarczające do stwierdzenia, że definitywnie powstał nowy element i nie ma innego wytłumaczenia obserwowanych efektów; popełniono błędy w interpretacji danych.
Historia
Pierwiastki superciężkie są produkowane przez fuzję jądrową . Te reakcje syntezy jądrowej można podzielić na „gorącą” i „zimną” fuzję, w zależności od energii wzbudzenia wytworzonego jądra złożonego. W reakcjach gorącej fuzji bardzo lekkie, wysokoenergetyczne pociski są przyspieszane w kierunku bardzo ciężkich celów ( aktynowców ), co powoduje powstanie jąder złożonych o wysokiej energii wzbudzenia (~40–50 MeV ), które mogą rozszczepiać się lub alternatywnie wyparowywać kilka (3 do 5) ) neutrony. W reakcjach zimnej fuzji (w których używa się cięższych pocisków, zwykle z czwartego okresu , i lżejszych celów, zwykle ołowiu i bizmutu ), wytworzone jądra skondensowane mają stosunkowo niską energię wzbudzenia (~10–20 MeV), co zmniejsza prawdopodobieństwo, że te produkty ulegną reakcjom rozszczepienia. Gdy skondensowane jądra ochładzają się do stanu podstawowego , wymagają emisji tylko jednego lub dwóch neutronów. Jednak reakcje fuzji na gorąco mają tendencję do wytwarzania produktów bogatych w neutrony, ponieważ aktynowce mają najwyższe stosunki neutronów do protonów spośród wszystkich pierwiastków, które można obecnie wytwarzać w ilościach makroskopowych.
Ununennium i unbinilium (elementy 119 i 120) są elementami o najniższej liczbie atomów, które nie zostały dotychczas zsyntetyzowanych. Próby ich zsyntetyzowania przesunęłyby granice obecnej technologii ze względu na zmniejszające się przekroje reakcji produkcyjnych i ich prawdopodobnie krótkie okresy półtrwania , które mają być rzędu mikrosekund. Pierwiastki poza unbinium (pierwiastek 121) byłyby prawdopodobnie zbyt krótkotrwałe, aby można je było wykryć przy użyciu obecnej technologii: rozpadłyby się w ciągu mikrosekundy, zanim dotrą do detektorów. Możliwość wykrycia pierwiastków od 121 do 124 zależy w dużej mierze od zastosowanego modelu teoretycznego, ponieważ przewiduje się, że ich okresy półtrwania będą bardzo bliskie granicy jednej mikrosekundy. Wcześniej ważną pomocą (określaną jako „srebrne kule”) w syntezie superciężkich pierwiastków były zdeformowane otoczki jądrowe wokół has- 270, które zwiększyły stabilność otaczających ją jąder, oraz istnienie quasi-stabilnego, bogatego w neutrony izotopu wapnia- 48, który mógłby zostać wykorzystany jako pocisk do produkcji bardziej bogatych w neutrony izotopów superciężkich pierwiastków. Im bardziej bogaty w neutrony nuklid superciężki , tym bardziej oczekuje się, że będzie się znajdował w poszukiwanej wyspie stabilności . Mimo to zsyntetyzowane izotopy wciąż mają mniej neutronów niż te, które mają znajdować się na wyspie stabilności. Co więcej, użycie wapnia-48 do syntezy ununennium wymagałoby celu einsteinium -253 lub -254, które są bardzo trudne do wyprodukowania w wystarczająco dużych ilościach (obecnie dostępne są tylko mikrogramy; dla porównania dostępne są miligramy berkelu i kalifornu). Bardziej praktyczna produkcja kolejnych superciężkich elementów wymagałaby pocisków cięższych niż 48 Ca.
Próby syntezy
Przeszłość
Syntezę ununennium podjęto po raz pierwszy w 1985 roku, bombardując cel einsteinium-254 jonami wapnia-48 w akceleratorze superHILAC w Berkeley w Kalifornii:
-
254
99Es
+ 48
20Ca
→ 302
119Uue
* → brak atomów
Nie zidentyfikowano żadnych atomów, co doprowadziło do granicznego przekroju 300 nb . Późniejsze obliczenia sugerują, że przekrój poprzeczny reakcji 3n (która dałaby 299 Uue i trzy neutrony jako produkty) byłby w rzeczywistości sześćset tysięcy razy mniejszy niż górna granica, przy 0,5 pb.
Ponieważ ununennium jest najlżejszym nieodkrytym pierwiastkiem, w ostatnich latach było celem eksperymentów syntezy prowadzonych przez zespoły niemieckie, rosyjskie i japońskie. Rosyjski zespół ze Zjednoczonego Instytutu Badań Jądrowych w Dubnej planował przeprowadzić eksperyment przed 2012 rokiem i nie opublikowano żadnych wyników, co wyraźnie sugeruje, że eksperymentu nie przeprowadzono lub nie zidentyfikowano atomów unennium. Od kwietnia do września 2012 r. podjęto próbę zsyntetyzowania izotopów 295 Uue i 296 Uue, bombardując cel z berkelu -249 tytanem -50 w GSI Helmholtz Center for Heavy Ion Research w Darmstadt w Niemczech. Na podstawie przewidywanego teoretycznie przekroju oczekiwano, że atom unennium zostanie zsyntetyzowany w ciągu pięciu miesięcy od rozpoczęcia eksperymentu.
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 296
119Uue
+ 3 1
0
n
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 295
119Uue
+ 4 1
0
n
Eksperyment planowano początkowo kontynuować do listopada 2012 r., ale przerwano go wcześniej, aby wykorzystać cel 249 Bk do potwierdzenia syntezy tennessine (w ten sposób zmieniając pociski na 48 Ca). Przewiduje się, że ta reakcja pomiędzy 249 Bk a 50 Ti jest najbardziej korzystną praktyczną reakcją dla powstania unennium, ponieważ jest raczej asymetryczna, choć również nieco zimna. (Reakcja pomiędzy 254 Es i 48 Ca byłaby lepsza, ale przygotowanie miligramowych ilości 254 Es dla celu jest trudne.) Niemniej jednak konieczna zmiana ze „srebrnej kuli” 48 Ca na 50 Ti dzieli oczekiwany plon z unennium o około dwudziestu, ponieważ wydajność jest silnie zależna od asymetrii reakcji fuzji.
Ze względu na przewidywane krótkie okresy półtrwania zespół GSI zastosował nową „szybką” elektronikę zdolną do rejestrowania zdarzeń rozpadu w ciągu mikrosekund. Nie zidentyfikowano atomów ununennium, co oznacza graniczny przekrój 65 fb. Przewidywany rzeczywisty przekrój wynosi około 40 fb, co jest na granicy obecnej technologii. (Rekordowo najniższy przekrój eksperymentalnie udanej reakcji wynosi 30 fb dla reakcji pomiędzy 209 Bi i 70 Zn, w wyniku której powstaje nihonium ).
Obecny
Zespół RIKEN w Wakō w Japonii rozpoczął bombardowanie celów curium- 248 wiązką wanadu- 51 w czerwcu 2018 roku w celu poszukiwania pierwiastka 119. Curium zostało wybrane jako cel, a nie cięższy berkel lub kaliforn , ponieważ te cięższe cele są trudne do przygotować. Oczekuje się, że zmniejszona asymetria reakcji zmniejszy przekrój poprzeczny w przybliżeniu o połowę, co wymaga czułości „rzędu co najmniej 30 fb”. Cele 248 Cm zostały dostarczone przez Oak Ridge National Laboratory , które dostarczyło niezbędne cele 249 Bk z syntezy tennessyny (pierwiastek 117) w Dubnej. Eksperyment RIKEN rozpoczął się od przeprowadzenia w cyklotronie podczas modernizacji akceleratorów liniowych; modernizacja została zakończona w 2020 roku. Bombardowanie może być kontynuowane obiema maszynami do momentu zaobserwowania pierwszego zdarzenia; eksperyment trwa obecnie z przerwami przez co najmniej 100 dni w roku. Hideto En'yo , dyrektor RIKEN Nishina Centre, przewidział, że pierwiastki 119 i 120 zostaną prawdopodobnie odkryte do 2022 roku. Wysiłki zespołu RIKEN są finansowane przez Cesarza Japonii .
-
248
96Cm
+ 51
23V
→ 299
119Uue
* → 296
119Uue
+ 3 1
0
n
-
248
96Cm
+ 51
23V
→ 299
119Uue
* → 295
119Uue
+ 4 1
0
n
Oczekuje się, że wytworzone izotopy ununennium ulegną dwóm rozpadom alfa do znanych izotopów moskwy (odpowiednio 288 Mc i 287 Mc), co zakotwiczy je w znanej sekwencji pięciu dalszych rozpadów alfa i potwierdzi ich produkcję. Przewidywany przekrój dla tych reakcji to około 10 fb.
Zaplanowany
Po rzekomej syntezie 293 Og w 1999 roku w Lawrence Berkeley National Laboratory z 208 Pb i 86 Kr, zaproponowano analogiczne reakcje 209 Bi + 86 Kr i 208 Pb + 87 Rb do syntezy pierwiastka 119 i jego nieznanej wówczas alfa. córki rozpadu , pierwiastki 117 , 115 i 113 . Cofnięcie tych wyników w 2001 r. i nowsze obliczenia dotyczące przekrojów dla „zimnych” reakcji fuzji podają w wątpliwość tę możliwość; na przykład przewiduje się maksymalną wydajność 2 fb dla produkcji 294 Uue w poprzedniej reakcji. Wiązki jonów promieniotwórczych mogą stanowić alternatywną metodę wykorzystującą tarczę ołowiową lub bizmutową i mogą umożliwić produkcję izotopów bardziej bogatych w neutrony, jeśli staną się one dostępne przy wymaganej intensywności.
Zespół ze Zjednoczonego Instytutu Badań Jądrowych w Dubnej w Rosji planował rozpocząć nowe eksperymenty syntezy ununennium z wykorzystaniem reakcji 249 Bk + 50 Ti przy użyciu nowego kompleksu doświadczalnego. Od listopada 2019 r. wyników spodziewano się najwcześniej w połowie 2021 r.
Laboratoria w RIKEN w Japonii iw JINR w Rosji najlepiej nadają się do tych eksperymentów, ponieważ są jedynymi na świecie, w których długie czasy wiązki są dostępne dla reakcji o niskich przewidywanych przekrojach poprzecznych.
Nazewnictwo
Stosując nomenklaturę Mendelejewa dla elementów nienazwanych i nieodkrytych , powinien być znany jako ununennium eka- francium . Stosując zalecenia IUPAC z 1979 roku , pierwiastek powinien być czasowo nazywany ununennium (symbol Uue ) do czasu odkrycia, potwierdzenia odkrycia i wybrania stałej nazwy. Chociaż są szeroko stosowane w środowisku chemicznym na wszystkich poziomach, od klas chemii po zaawansowane podręczniki, zalecenia są w większości ignorowane wśród naukowców, którzy teoretycznie lub eksperymentalnie pracują nad superciężkimi pierwiastkami, którzy nazywają je „pierwiastkiem 119” o symbolu E119 , (119). lub 119 .
Przewidywane właściwości
Stabilność jądrowa i izotopy


Stabilność jąder znacznie spada wraz ze wzrostem liczby atomowej po Curium , element 96, którego czas połowicznego rozpadu wynosi cztery rzędy wielkości dłuższy niż znane aktualnie elementu wyższej numerowanej. Wszystkie izotopy o liczbie atomowej powyżej 101 ulegają rozpadowi radioaktywnemu z okresem półtrwania krótszym niż 30 godzin. Żadne pierwiastki o liczbie atomowej powyżej 82 (po ołowiu ) nie mają stabilnych izotopów. Niemniej jednak, z powodów jeszcze nie do końca zrozumiałych, następuje nieznaczny wzrost stabilności jądrowej wokół liczby atomowej 110 – 114 , co prowadzi do pojawienia się czegoś, co w fizyce jądrowej znane jest jako „ wyspa stabilności ”. Ta koncepcja, zaproponowana przez profesora Uniwersytetu Kalifornijskiego Glenna Seaborga , wyjaśnia, dlaczego superciężkie elementy trwają dłużej niż przewidywano.
Przewidywane okresy połowicznego rozpadu alfa dla 291-307 Uue są rzędu mikrosekund. Najdłuższy przewidywany okres połowicznego rozpadu alfa wynosi ~485 mikrosekund dla izotopu 294 Uue. Po uwzględnieniu wszystkich trybów zaniku przewidywane okresy półtrwania spadają do zaledwie kilkudziesięciu mikrosekund. Niektóre cięższe izotopy mogą być bardziej stabilne; Fricke i Waber przewidzieli, że 315 Uue będzie najbardziej stabilnym izotopem ununennium w 1971. Ma to konsekwencje dla syntezy unennium, ponieważ izotopy o okresie półtrwania poniżej jednej mikrosekundy rozpadłyby się przed dotarciem do detektora, a cięższe izotopy nie mogą być zsyntetyzowane przez zderzenie dowolnego znanego użytecznego jądra celu i pocisku. Niemniej jednak nowe modele teoretyczne pokazują, że oczekiwana przerwa w energii między orbitalami protonowymi 2f 7/2 (wypełnionym w elemencie 114) i 2f 5/2 (wypełnionym w elemencie 120) jest mniejsza niż oczekiwano, tak że pierwiastek 114 nie wydaje się już być stabilną sferyczną zamkniętą powłoką jądrową, a ta przerwa energetyczna może zwiększyć stabilność pierwiastków 119 i 120. Oczekuje się, że następne podwójnie magiczne jądro będzie teraz wokół sferycznego 306 Ubb ( pierwiastek 122 ), ale oczekiwany niski okres półtrwania i niski przekrój produkcji tego nuklidu sprawia, że jego synteza jest trudna.
Atomowe i fizyczne
Przewiduje się, że jako pierwiastek pierwszego okresu 8 , unennium jest metalem alkalicznym, zajmując miejsce w układzie okresowym poniżej litu , sodu , potasu , rubidu , cezu i fransu . Każdy z tych elementów zawiera jeden elektronów wartościowości w najdalszym s orbitalnej (konfiguracja elektronowa wartościowość n y 1 ), który jest łatwo utracone w reakcjach chemicznych, które tworzą +1 stopniu utlenienia ; tak metali alkalicznych są bardzo reaktywne elementy. Przewiduje się, że Ununennium będzie kontynuował ten trend i będzie miał konfigurację elektronów walencyjnych wynoszącą 8s 1 . Dlatego oczekuje się, że będzie zachowywał się podobnie jak jego lżejsze kongenery ; jednak przewiduje się również, że różni się od lżejszych metali alkalicznych niektórymi właściwościami.
Główną przyczyną przewidywanych różnic między metalem ununennium a innymi metalami alkalicznymi jest oddziaływanie spin-orbita (SO) — wzajemne oddziaływanie między ruchem elektronów a spinem . Oddziaływanie SO jest szczególnie silne w przypadku superciężkich pierwiastków, ponieważ ich elektrony poruszają się szybciej — z prędkością porównywalną z prędkością światła — niż te w lżejszych atomach. W atomach ununennium obniża poziom energii elektronów 7p i 8s, stabilizując odpowiednie elektrony, ale dwa z poziomów energii elektronów 7p są bardziej ustabilizowane niż pozostałe cztery. Efekt ten nazywa się dzieleniem podpowłoki, ponieważ dzieli podpowłokę 7p na bardziej ustabilizowane i mniej ustabilizowane części. Chemicy obliczeniowi rozumieją rozszczepienie jako zmianę drugiej ( azymutalnej ) liczby kwantowej l z 1 na 1/2 i 3/2 odpowiednio dla bardziej i mniej stabilizowanych części podpowłoki 7p. W ten sposób zewnętrzny elektron 8s ununennium jest stabilizowany i staje się trudniejszy do usunięcia niż oczekiwano, podczas gdy elektrony 7p 3/2 są odpowiednio destabilizowane, być może pozwalając im uczestniczyć w reakcjach chemicznych. Ta stabilizacja najbardziej zewnętrznego orbitalu s (już znacząca we frans) jest kluczowym czynnikiem wpływającym na chemię unennium i powoduje, że wszystkie trendy atomowych i molekularnych właściwości metali alkalicznych odwracają kierunek po cezu.
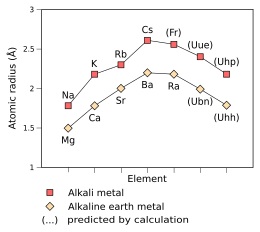
Empiryczne (Na–Cs, Mg–Ra) i przewidywane (Fr–Uhp, Ubn–Uhh) promienie atomowe metali alkalicznych i ziem alkalicznych od trzeciego do dziewiątego okresu , mierzone w angstremach
|

Empiryczne (Na-Cs), półempiryczne (Fr) i przewidywane (Uue) powinowactwa elektronowe metali alkalicznych od trzeciego do ósmego okresu , mierzone w elektronowoltach . Zmniejszają się od Li do Cs, ale wartość Fr,492 ± 10 meV , jest o 20 meV wyższy niż dla Cs, a Uue jest znacznie wyższy i wynosi 662 meV.
|
Ze względu na stabilizację jego zewnętrznego elektronu 8s, przewiduje się, że pierwsza energia jonizacji ununennium – energia wymagana do usunięcia elektronu z neutralnego atomu – wynosi 4,53 eV, czyli jest wyższa niż w przypadku znanych metali alkalicznych, począwszy od potasu. Efekt ten jest tak duży, że przewiduje się, że unbiun (pierwiastek 121) będzie miał niższą energię jonizacji wynoszącą 4,45 eV, tak że metal alkaliczny w okresie 8 nie miałby najniższej energii jonizacji w tym okresie, jak ma to miejsce we wszystkich poprzednich okresach. Oczekuje się, że powinowactwo elektronowe Ununennium będzie znacznie większe niż w przypadku cezu i fransu; rzeczywiście oczekuje się, że ununennium ma powinowactwo elektronowe wyższe niż wszystkie metale alkaliczne lżejsze od niego przy około 0,662 eV, zbliżone do kobaltu (0,662 eV) i chromu (0,676 eV). Efekty relatywistyczne powodują również bardzo duży spadek polaryzowalności ununennium do 169,7 au. Rzeczywiście, statyczna polaryzacja dipolowa (α D ) ununennium, wielkość, dla której wpływy względności są proporcjonalne do kwadratu liczby atomowej pierwiastka, została obliczony jako mały i podobny do sodu.
Przewiduje się, że elektron podobnego do wodoru atomu ununennium – utleniony tak, że ma tylko jeden elektron, Uue 118+ – porusza się tak szybko, że jego masa jest 1,99 razy większa od masy elektronu nieruchomego, co jest wynikiem efektów relatywistycznych . Dla porównania, liczba wodoropodobnego fransu wynosi 1,29, a liczba wodoropodobnego cezu wynosi 1,091. Zgodnie z prostymi ekstrapolacjami praw względności, które pośrednio wskazują na skrócenie promienia atomu do około 240 pm , bardzo blisko promienia rubidu (247 pm); promień metaliczny jest również odpowiednio obniża się do 260 pm. Promień jonowy o Uue + ma być 180 pm.
Przewiduje się, że Ununennium ma temperaturę topnienia między 0 ° C a 30 ° C: dlatego może być cieczą w temperaturze pokojowej. Nie wiadomo, czy jest to kontynuacja trendu obniżania temperatury topnienia w dół grupy, ponieważ temperatura topnienia cezu wynosi 28,5°C, a fransu szacuje się na około 8,0°C. Oczekuje się, że temperatura wrzenia ununennium wyniesie około 630 °C, podobnie jak francium, szacowana na około 620 °C; jest to temperatura niższa niż temperatura wrzenia cezu wynosząca 671 °C. Przewiduje się, że gęstość unennium wynosi od 3 do 4 g/cm 3 , kontynuując tendencję zwiększania gęstości w dół grupy: gęstość fransu szacuje się na 2,48 g/cm 3 , a cez jest znany jako 1,93 g / cm 3 .
Chemiczny
| Pogarszać | Długość wiązania (Å) | Energia dysocjacji wiązania (kJ/mol) |
|---|---|---|
| Li 2 | 2,673 | 101,9 |
| Na 2 | 3.079 | 72.04 |
| K 2 | 3,924 | 53,25 |
| Rb 2 | 4,210 | 47,77 |
| CS 2 | 4,648 | 43,66 |
| Pt 2 | ~ 4,61 | ~ 42,1 |
| Zue 2 | ~ 4.27 | ~ 53,4 |
Przewiduje się, że chemia ununennium jest podobna do chemii metali alkalicznych, ale prawdopodobnie zachowywałaby się bardziej jak potas lub rubid niż cez lub frans. Wynika to z efektów relatywistycznych, ponieważ w przypadku ich braku okresowe trendy przewidywałyby, że unennium będzie jeszcze bardziej reaktywne niż cez i frans. Ta obniżona reaktywność wynika z relatywistycznej stabilizacji elektronu walencyjnego ununennium, zwiększając pierwszą energię jonizacji ununennium i zmniejszając promienie metaliczne i jonowe ; efekt ten jest już widoczny dla franka.
Chemia ununennium na stopniu utlenienia +1 powinna być bardziej podobna do chemii rubidu niż do fransu. Z drugiej strony przewiduje się , że promień jonowy jonu Uue + będzie większy niż promienia Rb + , ponieważ orbitale 7p są zdestabilizowane, a zatem są większe niż orbitale p niższych powłok. Ununennium może również wykazywać stopień utlenienia +3 , który nie występuje w żadnym innym metalu alkalicznym, oprócz stanu utlenienia +1, który jest charakterystyczny dla innych metali alkalicznych i jest również głównym stopniem utlenienia wszystkich znanych metali alkalicznych: dzieje się tak z powodu destabilizacji i ekspansji spinora 7p 3/2 , powodującego, że jego najbardziej zewnętrzne elektrony mają niższą energię jonizacji niż można by się tego spodziewać. Oczekuje się, że wiele związków ununennium będzie mieć duży charakter kowalencyjny , ze względu na udział elektronów 7p 3/2 w wiązaniu: efekt ten jest również obserwowany w mniejszym stopniu we fransie, który wykazuje udział 6p 3/2 w wiązaniu w nadtlenku francu (FrO 2 ). Tak więc, zamiast ununennium jest najbardziej naładowany elementu, jak prosta ekstrapolacja wydaje się wskazywać, cezu zamiast zachowuje tę pozycję, z ununennium za elektroujemność najprawdopodobniej będąc blisko sód „s (0,93 w skali Paulinga). Przewiduje się, że standardowy potencjał redukcyjny pary Uue + /Uue wynosi −2,9 V, taki sam jak w przypadku pary Fr + /Fr i nieco większy niż w przypadku pary K + /K przy −2,931 V.
Długości wiązań i energie dysocjacji wiązań MAu (M = metal alkaliczny). Przewiduje się wszystkie dane, z wyjątkiem energii dysocjacji wiązania KAu, RbAu i CsAu. Pogarszać Długość wiązania (Å) Energia dysocjacji wiązania (kJ/mol) KAu 2,856 2,75 RbAu 2,967 2,48 CsAu 3.050 2,53 FrAu 3.097 2,75 UueAu 3.074 2,44
W fazie gazowej iw bardzo niskich temperaturach w fazie skondensowanej metale alkaliczne tworzą związane kowalencyjnie cząsteczki dwuatomowe. Metalami metalu długości wiązań w tych M 2 cząsteczek zwiększa dół grupy z Li 2 z CS 2 , a następnie zmniejsza się po to, aby uue 2 , ze względu na wyżej wymienione efekty relatywistycznymi które stabilizują 8S orbitalnej. Odwrotny trend pokazano dla energii dysocjacji wiązania metal-metal . Wiązanie Uue-Uue powinno być nieco silniejsze niż wiązanie K-K. Z tych M 2 energii dysocjacji The entalpia sublimacji (Δ H Sub ) z ununennium przewiduje się, że wynosi 94 kJ / mol (wartość frans powinna wynosić około 77 kJ / mol).
Oczekuje się, że cząsteczka UueF będzie miała znaczący charakter kowalencyjny ze względu na wysokie powinowactwo elektronowe ununennium. Wiązanie w UueF jest głównie między orbitalem 7p na ununennium i orbitalem 2p na fluorze, z mniejszym udziałem orbitalu 2s dla fluoru i 8s, 6d z 2 i dwóch innych orbitali 7p z unennium. To bardzo różni się od zachowania pierwiastków s-block, a także złota i rtęci , w których s-orbitale (czasami zmieszane z d-orbitalami) uczestniczą w wiązaniu. Wiązanie Uue-F jest relatywistycznie rozszerzane z powodu podziału orbitalu 7p na spinory 7p 1/2 i 7p 3/2 , zmuszając elektrony wiążące do największego orbitalu mierzonego zasięgiem promieniowym: podobne rozszerzenie długości wiązania znajduje się w wodorki At H TSH. Wiązanie Uue-Au powinno być najsłabszym ze wszystkich wiązań między złotem a metalem alkalicznym, ale nadal powinno być stabilne. Daje to ekstrapolowane średnie entalpie adsorpcji (-Δ H ads ) wynoszące 106 kJ/mol na złocie (wartość franka powinna wynosić 136 kJ/mol), 76 kJ/mol na platynie i 63 kJ/mol na srebrze , najmniejsza wszystkich metali alkalicznych, które pokazują, że byłoby możliwe badanie adsorpcji chromatograficznej ununennium na powierzchniach wykonanych z metali szlachetnych . Entalpia od adsorpcji do ununennium na teflonowej powierzchni przewiduje się 17,6 kJ / mol, które byłoby tańsze spośród metali alkalicznych: Ta informacja mogłaby być bardzo przydatna do eksperymentów w przyszłości chemii na ununennium. Δ H sub i -Δ H ogłoszenia wartości nie są proporcjonalnie podobne do metali alkalicznych, jak zmieniają się w przeciwnych kierunkach, jak wzrostem liczby atomowej.
Zobacz też
Uwagi
Bibliografia
Bibliografia
- Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). „Ocena właściwości jądrowych NUBASE2016” (PDF) . Fizyka chińska C . 41 (3): 030001. Kod Bib : 2017ChPhC..41c0001A . doi : 10.1088/1674-1137/41/3/030001 .
- Beiser, A. (2003). Koncepcje fizyki współczesnej (wyd. 6). McGraw-Hill. Numer ISBN 978-0-07-244848-1. OCLC 48965418 .
- Hoffmana, DC ; Ghiorso, A .; Seaborg, GT (2000). Ludzie z Transuranium: Historia wewnętrzna . Światowy Naukowy . Numer ISBN 978-1-78-326244-1.
- Kragh, H. (2018). Od transuranicznych do superciężkich pierwiastków: historia sporu i stworzenia . Springer . Numer ISBN 978-3-319-75813-8.
- Zagrzebajew, W.; Karpow, A.; Greiner, W. (2013). „Przyszłość badań nad superciężkimi pierwiastkami: które jądra mogą zostać zsyntetyzowane w ciągu najbliższych kilku lat?”. Journal of Physics: Seria konferencji . 420 (1). 012001. arXiv : 1207.5700 . Kod Bib : 2013JPhCS.420a2001Z . doi : 10.1088/1742-6596/420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
Zewnętrzne linki
-
 Słownikowa definicja ununennium w Wikisłowniku
Słownikowa definicja ununennium w Wikisłowniku


