Chlorek uranu(III) - Uranium(III) chloride
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Chlorek uranu(III)
|
|
| Inne nazwy
Chlorek
uranu Trichlorek uranu Chlorek poduranowy |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Ćw 3 U | |
| Masa cząsteczkowa | 344,38 g·mol -1 |
| Wygląd zewnętrzny | Zielone krystaliczne ciało stałe |
| Gęstość | 5,500 g / cm 3 , ciekłe |
| Temperatura topnienia | 837 ° C (1539 ° F; 1110 K) |
| Temperatura wrzenia | 1657 ° C (3015 ° F; 1930 K) |
| Rozpuszczalny | |
| Struktura | |
| Hybrydyzacja | Trigonalny pryzmatyczny trójkątny |
| Zagrożenia | |
| Temperatura zapłonu | Nie palne |
| Nie palne | |
| Związki pokrewne | |
|
Związki pokrewne
|
Uranu (IV), chlorek , uranu (V), chlorek , (VI), chlorek uranu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Chlorek uranu(III) , UCl 3 , jest związkiem chemicznym zawierającym uran i chlor jako metal ziem . UCl 3 jest używany głównie do przerobu zużytego paliwa jądrowego. Chlorek uranu(III) jest syntetyzowany na różne sposoby z chlorku uranu(IV) ; Jednakże ucl 3 jest mniej stabilna niż ucl 4 .
Przygotowanie
Istnieją dwa sposoby syntezy chlorku uranu(III). Poniższe procesy opisują sposób wytwarzania chlorku uranu(III).
(1) W mieszaninie NaCl-KCl w temperaturze 670–710 °C dodać czterochlorek uranu z uranem metalicznym.
(2) Podgrzej chlorek uranu(IV) w gazowym wodorze.
Nieruchomości
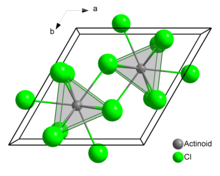
W stałym chlorku uranu(III) każdy atom uranu ma dziewięć atomów chloru jako bliskich sąsiadów, w przybliżeniu w tej samej odległości, w trygonalnej konfiguracji pryzmatycznej.
Chlorek uranu(III) jest zielonym krystalicznym ciałem stałym w temperaturze pokojowej. Ucl 3 topi się w temperaturze 837 ° C i wrze w temperaturze 1657 ° C. Chlorek uranu (III), o gęstości 5500 kg / m 3 i 5,500 g / cm 3 .
Jego skład wagowy:
- Chlor: 30,84%
- Uran: 69,16%
Jego formalne stany oksydacyjne:
- Chlor: -1
- Uran: +3
Chlorek uranu(III) jest bardzo dobrze rozpuszczalny w wodzie i bardzo higroskopijny . Ucl 3 jest bardziej stabilne w roztworze kwasu solnego .
Zastosowania
Odczynnik
Chlorek uranu(III) jest stosowany w reakcjach z tetrahydrofuranem (THF) i metylocyklopentadienem sodu do wytwarzania różnych kompleksów metalocenowych uranu .
Katalizator
Chlorek uranu (III) stosuje się jako katalizator w reakcji pomiędzy wodorku litowo-glinowego (LiAlH 4 ) i alkenów do produkcji związków alkilowych glinian.
Stopiona forma
Stopiona forma chlorku uranu(III) jest typowym związkiem w procesach pirochemicznych, ponieważ jest ważna w powtórnym przetwarzaniu wypalonego paliwa jądrowego. UCl 3 jest zwykle formą, jaką uran przyjmuje jako wypalone paliwo w procesach elektrorafinacji.
Hydraty
Istnieją trzy hydraty chlorku uranu(III):
- UCL 3 . 2H 2 O . 2CH 3 CN
- UCL 3 . 6 H 2 O
- UCL 3 . 7H 2 O
Każdy z nich jest syntetyzowany przez redukcję chlorku uranu(IV) w cyjanek metylu ( acetonitryl ) z określoną ilością wody i kwasu propionowego .
Środki ostrożności
Chociaż nie ma długoterminowych danych dotyczących skutków toksycznych Thas ucl 3 , ważne jest, aby zminimalizować ekspozycję na ten związek, jeśli to możliwe.
Podobnie jak inne związki uranu, które są rozpuszczalne, UCl 3 jest prawdopodobnie wchłaniany do krwi przez pęcherzyki płucne w ciągu kilku dni od ekspozycji. Narażenie na chlorek uranu(III) prowadzi do toksycznego działania na układ nerkowy .
Bibliografia
- ^ Serrano, K.; Taxil, P.; Dugne, O.; Bouvet, S.; Puech, EJ Nucl. Matko. 2000, 282, 137-145.
- ^ Remsen, Ira. Chemia nieorganiczna. Nowy Jork: Henry Holt and Company, 1890.
- ^ Wells AF (1984) Strukturalna Chemia Nieorganiczna 5. wydanie Oxford Science Publications ISBN 0-19-855370-6
- ^ Comey, Artur M.; Hahn, Dorothy A. Słownik rozpuszczalności chemicznej: nieorganiczny. Nowy Jork: The MacMillan Company, 1921.
- ^ Brenna JG; Andersona, RA; Zalkin, A. Inorg. Chem. 1986, 25, 1756-1760.
- ^ Le Marechal, JF; Efrytykina, M.; Folcher, GJ Organomet. Chem. 1986, 309, C1-C3.
- ^ B Okamoto, Y .; Madden, P.; Minato, KJ Nucl. Matko. 2005, 344, 109-114.
- ^ Okamoto, Y.; Kobayashi, F.; Ogawa, TJ Alloys Compd. 1998, 271, 355-358.
- ^ Mech, A.; Karbowick, M.; Lis, T. Wielościan. 2006, 25, 2083-2092.
- ^ Bertell, Rosalie. „Weterani wojny w Zatoce Perskiej i zubożony uran”. Maj 1999. Dostępne: http://ccnr.org/du_hague.html
Zewnętrzne linki
- Informacje o chlorku uranu(III) w Webelements
- Chlorek uranu(III) International Bio-Analytical Industries, Inc.
- Zubożony uran: na wszystkie pytania dotyczące syndromu DU i wojny w Zatoce nie ma jeszcze odpowiedzi
