Wirus Zachodniego Nilu -West Nile virus
| wirus Zachodniego Nilu | |
|---|---|
|
|
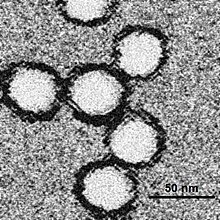
| Mikrografia wirusa Zachodniego Nilu, widoczna na żółto | |
|
Klasyfikacja wirusów |
|
| (bez rankingu): | Wirus |
| Królestwo : | Rybowiria |
| Królestwo: | Orthornavirae |
| Gromada: | Kitrinoviricota |
| Klasa: | Flasuviricetes |
| Zamówienie: | Amarylowirusy |
| Rodzina: | Flaviviridae |
| Rodzaj: | Flawiwirus |
| Gatunek: |
wirus Zachodniego Nilu
|
Wirus Zachodniego Nilu ( WNV ) to jednoniciowy wirus RNA , który wywołuje gorączkę Zachodniego Nilu . Jest członkiem rodziny Flaviviridae , z rodzaju Flavivirus , która zawiera również wirusa Zíka , denga wirusa i żółta febra wirusa. Wirus jest przenoszony głównie przez komary , głównie z gatunku Culex . Głównymi żywicielami WNV są ptaki, więc wirus pozostaje w cyklu przenoszenia „ptak-komar-ptak” . Wirus jest genetycznie spokrewniony z rodziną wirusów japońskiego zapalenia mózgu .
Zarówno ludzie, jak i konie wykazują objawy choroby wywołane przez wirusa, a objawy rzadko występują u innych zwierząt. Identyfikacji ludzkiej choroby dokonano po raz pierwszy w 1937 roku w Ugandzie, aw drugiej połowie XX wieku rozprzestrzeniła się na wiele innych części świata.
Struktura
Jak większość innych flawiwirusów, WNV jest wirusem otoczkowym o symetrii dwudziestościennej . Badania pod mikroskopem elektronowym ujawniają wirion 45-50 nm pokryty stosunkowo gładką otoczką białkową ; ta struktura jest podobna do wirusa gorączki denga , innego Flaviwirusa . Powłoka białkowa składa się z dwóch białek strukturalnych: glikoproteiny E i małego białka błonowego M. Białko E pełni wiele funkcji, w tym wiązanie receptora , przyłączanie wirusa i wnikanie do komórki poprzez fuzję błon .
Zewnętrzna otoczka białkowa pokryta jest błoną lipidową pochodzącą od gospodarza , otoczką wirusową . Stwierdzono, że błona lipidowa flawiwirusa zawiera cholesterol i fosfatydyloserynę , ale inne elementy błony nie zostały jeszcze zidentyfikowane. Błona lipidowa odgrywa wiele ról w infekcji wirusowej , w tym działa jako cząsteczki sygnałowe i ułatwia wejście do komórki. W szczególności cholesterol odgrywa integralną rolę w wnikaniu WNV do komórki gospodarza . Do błony wprowadzane są dwa białka otoczki wirusa, E i M.
Genom RNA jest związany z białkami kapsydu (C), które mają długość 105 aminokwasów, tworząc nukleokapsyd . Białka kapsydu są jednymi z pierwszych białek tworzonych w zakażonej komórce; białko kapsydu jest białkiem strukturalnym, którego głównym celem jest pakowanie RNA do rozwijających się wirusów. Stwierdzono, że kapsyd zapobiega apoptozie poprzez wpływ na szlak Akt.
Genom
WNV jest wirusem o jednoniciowym RNA o dodatnim znaczeniu . Jego genom ma długość około 11 000 nukleotydów i jest oflankowany przez niekodujące struktury 5' i 3' pnia-pętla . Region kodujący genomu koduje trzy białka strukturalne i siedem białek niestrukturalnych (NS) , które nie są włączone do struktury nowych wirusów. Genom WNV jest najpierw tłumaczony na poliproteinę, a następnie cięty przez wirusy i proteazy gospodarza na oddzielne białka (tj. NS1, C, E).
Białka strukturalne
Białka strukturalne (C, prM/M, E) to odpowiednio kapsyd, prekursorowe białka błonowe i białka otoczki. Białka strukturalne znajdują się na końcu 5' genomu i są cięte na dojrzałe białka zarówno przez proteazy gospodarza, jak i wirusa.
| Białko strukturalne | Funkcjonować |
|---|---|
| C | białko kapsydu; zamyka genom RNA, pakuje RNA w niedojrzałe wiriony. |
| prM/M | Wirusy z białkiem M są zakaźne: obecność białka M pozwala na aktywację białek biorących udział we wnikaniu wirusa do komórki. Białko prM (prekursor błony) jest obecne na niedojrzałych wirionach, przez dalsze rozszczepienie przez furynę do białka M wiriony stają się zakaźne. |
| mi | Glikoproteina, która tworzy otoczkę wirusa, wiąże się z receptorami na powierzchni komórki gospodarza, aby dostać się do komórki. |
Białka niestrukturalne
Białka niestrukturalne składają się z NS1, NS2A, NS2B, NS3, NS4A, NS4B i NS5. Białka te pomagają głównie w replikacji wirusa lub działają jako proteazy. Białka niestrukturalne znajdują się w pobliżu końca 3' genomu.
| Białko niestrukturalne | Funkcjonować |
|---|---|
| NS1 | NS1 jest kofaktorem replikacji wirusa, szczególnie do regulacji kompleksu replikacyjnego. |
| NS2A | NS2A pełni różne funkcje: bierze udział w replikacji wirusa, tworzeniu wirionów i indukowaniu śmierci komórek gospodarza. |
| NS2B | Kofaktorem dla NS3 i razem tworząca NS2B-NS3 proteazą złożone. Zawiera domeny transbłonowe, które wiążą proteazę z błonami wewnątrzkomórkowymi. |
| NS3 | Proteaza serynowa jest odpowiedzialna za rozszczepiania poliproteiny do wytwarzania dojrzałego białka; działa również jak helikaza . |
| NS4A | NS4A jest kofaktorem replikacji wirusa, w szczególności reguluje aktywność helikazy NS3. |
| NS4B | Hamuje sygnalizację interferonową . |
| NS5 | Największe i najbardziej konserwatywne białko WNV, NS5, działa jako metylotransferaza i polimeraza RNA , chociaż nie ma właściwości korekcyjnych. |
Koło życia
Gdy WNV dostanie się do krwiobiegu zwierzęcia żywiciela, białko otoczki E wiąże się z czynnikami przyłączania zwanymi glikozaminoglikanami w komórce gospodarza. Te czynniki przyłączania ułatwiają wejście do komórki, jednak konieczne jest również wiązanie z pierwszorzędowymi receptorami. Receptory obejmować pierwotne DC-SIGN , DC-SIGN-R, jak i integryny a v p 3 . Wiążąc się z tymi pierwszorzędowymi receptorami, WNV wnika do komórki poprzez endocytozę za pośrednictwem klatryny . W wyniku endocytozy WNV wnika do komórki w obrębie endosomu .
Kwasowość endosomu katalizuje fuzję błon endosomalnych i wirusowych, umożliwiając uwolnienie genomu do cytoplazmy. Translacja jednoniciowego RNA o dodatnim znaczeniu zachodzi w retikulum endoplazmatycznym ; RNA ulega translacji do poliproteiny, która jest następnie rozcinana przez proteazy gospodarza i wirusa NS2B-NS3 w celu wytworzenia dojrzałych białek.
W celu replikacji swojego genomu, NS5, polimeraza RNA , tworzy kompleks replikacyjny z innymi niestrukturalnymi białkami w celu wytworzenia pośredniego jednoniciowego RNA o negatywnym sensie ; nić sensowna ujemna służy jako matryca do syntezy końcowego RNA o sensownym dodatnim. Po zsyntetyzowaniu pozytywnego RNA, białko kapsydu C zamyka nici RNA w niedojrzałe wiriony. Reszta wirusa jest gromadzona wzdłuż retikulum endoplazmatycznego i przez aparat Golgiego , w wyniku czego powstają niezakaźne niedojrzałe wiriony. Białko E jest następnie glikozylowane, a prM jest rozszczepiane przez furynę , proteazę komórki gospodarza, do białka M, wytwarzając w ten sposób zakaźny dojrzały wirion. Dojrzałe wirusy są następnie wydzielane z komórki.
Filogeneza

WNV jest jednym z japońskiemu zapaleniu mózgu antygenowej serocomplex wirusów, wraz z wirusem japońskiego zapalenia mózgu, Zapalenia mózgu doliny Murray , wirus zapalenia mózgu Saint Louis oraz niektórych innych flawirusów. Badania linii filogenetycznych wykazały, że WNV pojawił się jako odrębny wirus około 1000 lat temu. Ten początkowy wirus rozwinął się w dwie odrębne linie rodowe. Lineage 1 i jego liczne profile są źródłem transmisji epidemii w Afryce i na całym świecie. Linia 2 została uznana za afrykańską zoonozę . Jednak w 2008 r. linia 2, wcześniej obserwowana tylko u koni w Afryce subsaharyjskiej i na Madagaskarze, zaczęła pojawiać się u koni w Europie, gdzie pierwsza znana epidemia dotknęła 18 zwierząt na Węgrzech. Wirus Zachodniego Nilu Lineage 1 został wykryty w Republice Południowej Afryki w 2010 roku u klaczy i jej abortowanego płodu ; poprzednio u koni i ludzi w Afryce Południowej wykryto tylko wirusa zachodniego Nilu linii 2. Wirus Kunjin jest podtypem wirusa Zachodniego Nilu endemicznym dla Oceanii . W 2007 r. śmiertelny przypadek orki w Teksasie poszerzył znany zakres żywicieli wirusa Zachodniego Nilu o walenie .
Od pierwszych przypadków w Ameryce Północnej w 1999 roku wirus był zgłaszany w Stanach Zjednoczonych, Kanadzie, Meksyku, na Karaibach i Ameryce Środkowej. Zdarzały się przypadki u ludzi i koni, a wiele ptaków jest zarażonych. Barbary makaki , Macaca sylvanus , był pierwszym nieludzkie prymas zamówieniu WNV. Zarówno amerykańskie, jak i izraelskie szczepy charakteryzują się wysoką śmiertelnością w zakażonych populacjach ptaków; obecność martwych ptaków — zwłaszcza Corvidae — może być wczesnym wskaźnikiem pojawienia się wirusa.
Zasięg hosta i transmisja
Naturalnymi żywicielami WNV są ptaki i komary. Wykazano, że wirusem zostało zarażonych ponad 300 różnych gatunków ptaków. Niektóre ptaki, w tym wrona amerykańska ( Corvus brachyrhynchos ), sójka niebieska ( Cyanocitta cristata ) i cietrzew wielkolistny ( Centrocercus urophasianus ), giną w wyniku infekcji, ale inne przeżywają. Amerykański Robin ( Turdus migratorius ) i Wróbel ( Passer domesticus ) są uważane za jedne z najważniejszych gatunków Zbiornik w N. amerykańskich i europejskich miastach. Wśród innych pospolitych ptaków północnoamerykańskich , u których występuje wysokie stężenie ptaków w Ameryce Północnej , znajdują się młótodzioby brunatne ( Toxostoma rufum ), szare kocice ( Dumetella carolinensis ), kardynały północne ( Cardinalis cardinalis ), przedrzeźniacze północne ( Mimus polyglottos ), drozdy ( Hylocichla mustelina ) i rodzina gołębi stwierdzono poziomy przeciwciał przeciwko WNV.
WNV wykazano u wielu gatunków komarów, ale najbardziej znaczące dla przenoszenia wirusa są gatunki Culex żywiące się ptakami, w tym Culex pipiens , C. restuans , C. salinarius , C. quinquefasciatus , C. nigripalpus , C. erraticus i C. tarsalis . Zakażenie eksperymentalne zostało również wykazane z wektorami kleszczy miękkich , ale jest mało prawdopodobne, aby miało ono znaczenie w naturalnym przenoszeniu.
WNV ma szeroki zakres gospodarzy i wiadomo również, że może zarażać co najmniej 30 gatunków ssaków , w tym ludzi, niektóre naczelne inne niż człowiek, konie, psy i koty. Niektórzy zakażeni ludzie i konie doświadczają choroby, ale psy i koty rzadko wykazują objawy. Zakażone mogą być również gady i płazy , w tym niektóre gatunki krokodyli, aligatorów, węży, jaszczurek i żab. Ssaki są uważane za przypadkowych lub ślepych nosicieli wirusa: zwykle nie rozwijają wystarczająco wysokiego poziomu wirusa we krwi ( viremia ), aby zarazić innego komara, który się nimi żywi, i kontynuować cykl przenoszenia; niektóre ptaki są również ślepymi żywicielami.
W normalnym wiejskim lub enzootycznym cyklu przenoszenia wirus naprzemiennie przechodzi między ptasim rezerwuarem a komarem. Może być również przenoszony między ptakami poprzez bezpośredni kontakt, poprzez zjedzenie zakażonej tuszy ptaka lub picie zakażonej wody. Przenoszenie pionowe między samicą a potomstwem jest możliwe u komarów i może być potencjalnie ważne podczas zimowania. W cyklu miejskim lub rozlanym zakażone komary, które żywią się zarażonymi ptakami, przenoszą wirusa na ludzi. Wymaga to gatunków komarów, które gryzą zarówno ptaki, jak i ludzi, określanych jako wektory pomostowe. Wirus może również rzadko rozprzestrzeniać się poprzez transfuzje krwi, przeszczepy narządów lub z matki na dziecko podczas ciąży, porodu lub karmienia piersią. W przeciwieństwie do ptaków nie rozprzestrzenia się bezpośrednio między ludźmi.
Choroba
Ludzie
Gorączka Zachodniego Nilu to infekcja wirusem Zachodniego Nilu, który jest zwykle przenoszony przez komary . W około 80% infekcji ludzie mają niewiele objawów lub nie mają ich wcale . Około 20% ludzi ma gorączkę , ból głowy, wymioty lub wysypkę. U mniej niż 1% osób występuje zapalenie mózgu lub opon mózgowo-rdzeniowych , z towarzyszącą sztywnością karku, dezorientacją lub drgawkami. Odzyskiwanie może potrwać od tygodni do miesięcy. Ryzyko śmierci wśród osób dotkniętych układem nerwowym wynosi około 10 procent.
Wirus Zachodniego Nilu (WNV) jest zwykle przenoszony przez komary, które zarażają się, gdy żywią się zarażonymi ptakami, które często przenoszą chorobę . Rzadko wirus rozprzestrzenia się poprzez transfuzje krwi, przeszczepy narządów lub z matki na dziecko podczas ciąży, porodu lub karmienia piersią, ale poza tym nie przenosi się bezpośrednio między ludźmi. Ryzyko ciężkiej choroby obejmuje wiek powyżej 60 lat i inne problemy zdrowotne. Diagnoza jest zazwyczaj oparta na objawach i badaniach krwi.
Nie ma szczepionki dla ludzi . Najlepszym sposobem na zmniejszenie ryzyka infekcji jest unikanie ukąszeń komarów. Populacje komarów można zmniejszyć, eliminując stojące kałuże wody, takie jak stare opony, wiadra, rynny i baseny. Kiedy nie można uniknąć komarów, środki odstraszające komary , ekrany okienne i moskitiery zmniejszają prawdopodobieństwo ugryzienia. Nie ma specyficznego leczenia choroby; leki przeciwbólowe mogą zmniejszać objawy.
Wirus został odkryty w Ugandzie w 1937 roku, a po raz pierwszy został wykryty w Ameryce Północnej w 1999 roku. WNV wystąpił w Europie, Afryce, Azji, Australii i Ameryce Północnej. W Stanach Zjednoczonych odnotowuje się tysiące przypadków rocznie, przy czym większość ma miejsce w sierpniu i wrześniu. Może wystąpić w wybuchach choroby. Ciężka choroba może również wystąpić u koni, dla których dostępna jest szczepionka. System nadzoru ptaków jest przydatny do wczesnego wykrywania potencjalnej epidemii u ludzi.Konie
Ciężka choroba może również wystąpić u koni. Obecnie dostępnych jest kilka szczepionek dla tych zwierząt. Przed dostępnością szczepionek weterynaryjnych zmarło około 40% zarażonych koni w Ameryce Północnej.
Epidemiologia
Według Centrum Kontroli Chorób, infekcja wirusem Zachodniego Nilu jest sezonowa w strefach umiarkowanych. W klimacie umiarkowanym, na przykład w Stanach Zjednoczonych i Europie, szczyt sezonu przypada na okres od lipca do października. Szczyt sezonu zmienia się w zależności od regionu geograficznego, a cieplejsze i wilgotne klimaty mogą powodować dłuższe sezony szczytowe. W każdym wieku istnieje jednakowe prawdopodobieństwo zarażenia, ale u osób w wieku 60-89 lat występuje większa liczba zgonów i neuroinwazyjnego wirusa Zachodniego Nilu. Osoby w starszym wieku są bardziej narażone na negatywne skutki.
Istnieje kilka sposobów przenoszenia, ale najczęstszą przyczyną infekcji u ludzi jest ugryzienie przez zarażonego komara. Inne sposoby przenoszenia obejmują transfuzję krwi, przeszczepianie narządów, karmienie piersią, transmisję przezłożyskową i pozyskiwanie danych laboratoryjnych. Te alternatywne sposoby transmisji są niezwykle rzadkie.
Zapobieganie
Działania prewencyjne przeciwko WNV koncentrują się głównie na zapobieganiu kontaktowi ludzi z zarażonymi komarami i ich ukąszeniom. Jest to dwojakie, po pierwsze przez działania ochrony osobistej, a po drugie przez działania przeciw komarom. Kiedy dana osoba znajduje się w obszarze, w którym występuje WNV, ważne jest, aby unikać aktywności na świeżym powietrzu, a jeśli wyjdzie na zewnątrz, powinna użyć środka odstraszającego komary z DEET. Osoba może również nosić ubrania, które zakrywają więcej skóry, takie jak długie rękawy i spodnie. Zwalczanie komarów może odbywać się na poziomie społeczności i obejmować programy nadzoru i programy kontroli, w tym pestycydy i ograniczanie siedlisk komarów. Obejmuje to odprowadzanie stojącej wody. Szczególnie przydatne są systemy nadzoru ptaków. Jeśli w sąsiedztwie zostaną znalezione martwe ptaki, zdarzenie należy zgłosić władzom lokalnym. Może to pomóc departamentom zdrowia w nadzorze i ustaleniu, czy ptaki są zakażone wirusem Zachodniego Nilu.
Pomimo dostępności handlowej czterech szczepień weterynaryjnych dla koni, nie człowieka szczepionki postępuje za II fazy prób klinicznych . Podjęto wysiłki, aby wyprodukować szczepionkę do stosowania u ludzi i opracowano kilka kandydatów, ale żaden nie ma licencji do stosowania. Najlepszą metodą zmniejszenia ryzyka infekcji jest unikanie ukąszeń komarów. Można to zrobić, eliminując stojące kałuże wody, takie jak w starych oponach, wiadrach, rynnach i basenach. Przydatne mogą być również środki odstraszające komary , ekrany okienne , moskitiery i unikanie obszarów, w których występują komary.
Zmiana klimatu
Podobnie jak w przypadku innych chorób tropikalnych, co do których oczekuje się, że nasiliły się rozprzestrzenianie z powodu zmiany klimatu, istnieje obawa, że zmieniające się warunki pogodowe zwiększą rozprzestrzenianie się wirusa Zachodniego Nilu. Zmiana klimatu wpłynie na wskaźniki, zasięgi, sezonowość i rozprzestrzenianie się wirusa Zachodniego Nilu.
Przewidywane zmiany w częstotliwości i dotkliwości powodzi mogą nieść nowe wyzwania w zarządzaniu ryzykiem powodziowym , umożliwiając zwiększenie populacji komarów na obszarach miejskich. Warunki pogodowe dotknięte zmianą klimatu, w tym temperatura, opady i wiatr, mogą wpływać na przeżywalność i reprodukcję komarów, odpowiednie siedliska, rozmieszczenie i liczebność. Temperatury otoczenia wpływają na tempo namnażania się komarów i przenoszenie WNV, wpływając na szczyt sezonu komarów i zróżnicowanie geograficzne. Na przykład podwyższone temperatury mogą wpływać na szybkość replikacji wirusa, przyspieszać tempo ewolucji wirusa i wydajność przenoszenia wirusa. Ponadto wyższe temperatury zimą i cieplejsza wiosna mogą prowadzić do większych letnich populacji komarów, zwiększając ryzyko WNV. Podobnie opady deszczu mogą również wpływać na tempo namnażania się komarów i wpływać na sezonowość i zmienność geograficzną wirusa. Badania wykazują związek między obfitymi opadami a większą częstością występowania WNV. Podobnie wiatr jest kolejnym czynnikiem środowiskowym, który służy jako mechanizm rozprzestrzeniania się komarów.
Komary mają niezwykle szeroką tolerancję środowiskową i prawie wszechobecny zasięg geograficzny, występując na wszystkich głównych masach lądowych z wyjątkiem Antarktydy i Islandii. Niemniej jednak zmiany w klimacie i użytkowaniu gruntów w ekologicznych skalach czasowych mogą w różny sposób rozszerzać lub fragmentować wzorce ich rozmieszczenia, budząc w konsekwencji obawy o zdrowie ludzkie.
Zobacz też
Bibliografia
Zewnętrzne linki
- Profil gatunkowy — wirus Zachodniego Nilu , Narodowe Centrum Informacji o Gatunkach Inwazyjnych, Narodowa Biblioteka Rolnicza Stanów Zjednoczonych . Zawiera ogólne informacje i zasoby dotyczące wirusa Zachodniego Nilu
| Scholia ma profil tematyczny dla wirusa Zachodniego Nilu . |