Batrachochytrium dendrobatidis -Batrachochytrium dendrobatidis
| Batrachochytrium dendrobatidis | |
|---|---|
|
|
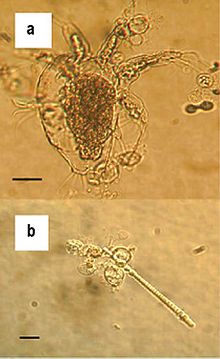
| Zoosporangia z B. dendrobatidis rosnące na stawonogi słodkiej wody (A) i (B) z alg; podziałki = 30 µm | |
|
Klasyfikacja naukowa |
|
| Królestwo: | Grzyby |
| Podział: | Chytridiomycota |
| Klasa: | Chytridiomycetes |
| Zamówienie: | Rhizophydiales |
| Rodzaj: | Batrachochytrium |
| Gatunek: |
B. dendrobatidis
|
| Nazwa dwumianowa | |
|
Batrachochytrium dendrobatidis Longcore, Pessier & DK Nichols (1999)
|
|
Batrachochytrium dendrobatidis ( / b ə ˂ t r eɪ k oʊ K ɪ t r ı əm d ɛ n d r oʊ b ə t aɪ d ɪ s / bə- PODAJNIK -koh- KIT -ree-əm DEN -droh-bə -ty-dis ), znany również jako Bd lub płaz chytrid fungus , jest grzybem wywołującym chorobę chytridiomycosis u płazów .
Od czasu jej odkrycia w 1998 roku przez Lee Bergera , choroba ta niszczyła populacje płazów na całym świecie, w globalnym spadku ku wielokrotnym wyginięciom, będącym częścią wymierania holocenu . Niedawno opisany drugi gatunek, B. salamandrivorans , również powoduje chytridiomikozę i śmierć salamandr .
Jak donosi Nature, patogeny grzybicze wywołujące chorobę chytridiomycosis niszczą skórę żab, ropuch i innych płazów, zaburzając ich równowagę wody i soli i ostatecznie powodując niewydolność serca. Wydaje się, że niektóre gatunki płazów mają wrodzoną zdolność do przetrwania zakażenia chytridiomikozą z powodu symbiozy z Janthinobacterium lividum . Nawet w obrębie gatunków, które generalnie giną, niektóre populacje przeżywają, co może świadczyć o tym, że te cechy lub allele gatunków podlegają selekcji ewolucyjnej .
Etymologia
Nazwa rodzajowa wywodzi się od greckich słów batrachos (żaba) i chytra (ziemna doniczka), natomiast specyficzny epitet wywodzi się od rodzaju żab, od którego dokonano oryginalnego potwierdzenia chorobotwórczości ( Dendrobates ), dendrobatidis pochodzi od greckiego dendron , „drzewo” i Bates , „ten, który się wspina”, odnosząc się do rodzaju trujących żab.
Systematyka
Batrachochytrium dendrobatidis był do niedawna uważany za pojedynczy gatunek rodzaju Batrachochytrium . Wstępna klasyfikacja patogenu jako chytrid opierała się na ultrastrukturze zoospor. Analiza DNA SSU - rDNA potwierdziła ten pogląd, z najbliższym dopasowaniem do Chytridium confitvae . Drugi gatunek Batrachochytrium został odkryty w 2013 roku: B. salamandrivorans , który atakuje głównie salamandry, a także powoduje chytridiomykozę . B. salamandrivorans różni się od B. dendrobatidis przede wszystkim tworzeniem bulw zarodkowych in vitro , tworzeniem plech kolonialnych z licznymi zarodniami in vivo oraz niższą preferencją termiczną.
Morfologia

B. dendrobatidis infekuje zrogowaciałą skórę płazów . Grzyb w naskórku ma plechę z siecią ryzoidów i gładkościennymi, w przybliżeniu kulistymi, nieperkulowanymi (bez wieczko ) zarodniami . Każde zarodnie wytwarza pojedynczą rurkę do uwalniania zarodników.
Struktura zoospor
Zoospor z B. dendrobatidis , które są typowo 3-5 | im rozmiar, mają wydłużony korpus, ovoidal z jednym, tylny wici (długości 19-20 mikrometrów), oraz posiada część rdzenia rybosomów często związanym z błoną sfer rybosomy w głównej masie rybosomalnej. Zaobserwowano niewielką ostrogę, zlokalizowaną z tyłu korpusu komórki, przylegającą do wici, ale może to być artefakt w próbkach utrwalonych w formalinie. Główny obszar rybosomów jest otoczony przez jeden Cisterny z retikulum endoplazmatycznego , dwa do trzech mitochondriów i rozległej microbody -lipid kompleksu kuleczki. Mikrociała ściśle przylegają i prawie otaczają cztery do sześciu globulek lipidowych (trzy przednie i jedna do trzech z boku), z których niektóre wydają się być związane cysterną. Wydaje się, że niektóre zoospory zawierają więcej kuleczek lipidowych (może to być wynikiem efektu płaszczyzny przekroju, ponieważ w badanych zarodnikach globule te często były płatami). Rumposome nie został dotrzymany.
Struktura wici
Niedziałająca centriola leży w sąsiedztwie kinetosomu . Dziewięć połączonych rekwizytów łączy kinetosomy z plazmalemą , a płytka końcowa znajduje się w strefie przejściowej. W przekroju poprzecznym zaobserwowano wewnętrzną strukturę pierścieniową połączoną z kanalikami dubletów wici w strefie przejściowej. Nie zaobserwowano żadnych korzeni związanych z kinetosomem. W wielu zoosporach jądro znajduje się częściowo w agregacji rybosomów i było niezmiennie usytuowane bocznie. W cytoplazmie poza obszarem rybosomalnym wystąpiły małe wakuole i ciałko Golgiego z ułożonymi cysternami. Mitochondria , które często zawierają niewielką liczbę rybosomów, gęsto wybarwiają się tarczowatymi grzebieniami .
Koło życia
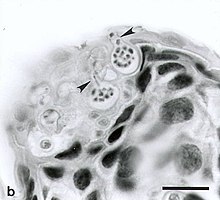
B. dendrobatidis ma dwa podstawowe etapy życia: siedzący, reprodukcyjny zoosporangium i ruchliwy, nieflagelowany zoospor, uwalniany z zoosporangium. Wiadomo, że zoospory są aktywne tylko przez krótki czas i mogą pokonywać krótkie odległości od jednego do dwóch centymetrów. Jednak zoospory są zdolne do chemotaksji i mogą poruszać się w kierunku różnych cząsteczek obecnych na powierzchni płazów, takich jak cukry, białka i aminokwasy . B. dendrobatidis zawiera również różne enzymy proteolityczne i esterazy, które pomagają mu trawić komórki płazów i wykorzystują skórę płazów jako źródło składników odżywczych. Gdy zoospor dotrze do swojego żywiciela, tworzy pod powierzchnią skóry cystę i rozpoczyna reprodukcyjną część swojego cyklu życiowego. Otorbione zoospory rozwijają się w zoosporangia, które mogą wytwarzać więcej zoospor, które mogą ponownie zainfekować żywiciela lub zostać uwolnione do otaczającego środowiska wodnego. Wykazano, że płazy zakażone tymi zoosporami umierają z powodu zatrzymania akcji serca .
Oprócz płazów B. dendrobatidis zaraża także raki ( Procambarus alleni , P. clarkii , Orconectes virilis i O. immunis ), ale nie komary ( Gambusia holbrooki ).
Fizjologia
B. dendrobatidis może rosnąć w szerokim zakresie temperatur (4–25°C), przy czym optymalna temperatura wynosi od 17 do 25°C. Szeroki zakres temperatur wzrostu, w tym zdolność do przetrwania w temperaturze 4 °C, daje grzybowi możliwość zimowania u swoich żywicieli, nawet w przypadku niskich temperatur w środowisku wodnym. Gatunek nie rośnie znacznie powyżej temperatury 25 °C, a wzrost jest zatrzymywany powyżej 28 °C. Zainfekowane żaby drzewiaste ( Litoria chloris ) wyzdrowiały z infekcji podczas inkubacji w temperaturze 37 °C.
Różne formy
B. dendrobatidis jest czasami znajdowany w formach odmiennych od jego tradycyjnych stadiów zarodników i zarodni. Na przykład przed europejską falą upałów w 2003 r., która zdziesiątkowała populacje żaby wodnej Rana lekcja przez chytridiomikozę, grzyb istniał na płazach jako kuliste, jednokomórkowe organizmy, ograniczone do maleńkich plamek (o średnicy 80–120 mikrometrów). Organizmy te, nieznane w tamtym czasie, zostały następnie zidentyfikowane jako B. dendrobatidis . Charakterystyka organizmów sugerowała otorbione zoospory; mogą uosabiać spoczynkowy zarodnik, saprobę lub pasożytniczą formę grzyba, która jest niepatogenna.
Siedlisko i związek z płazami
Grzyb rośnie na skórze płazów i wytwarza wodne zoospory. Jest szeroko rozpowszechniony i rozciąga się od lasów nizinnych po zimne szczyty górskie. Czasami jest nieśmiercionośnym pasożytem i prawdopodobnie saprofitem . Grzyb wiąże się ze śmiertelnością żywiciela na terenach górskich lub zimą i staje się bardziej chorobotwórczy w niższych temperaturach.
Podział geograficzny
Sugerowano, że B. dendrobatidis pochodzi z Afryki lub Azji, a następnie rozprzestrzenił się na inne części świata w wyniku handlu żabami szponiastymi ( Xenopus laevis ). W tym badaniu przebadano 697 archiwalnych okazów trzech gatunków Xenopus , zebranych wcześniej w latach 1879-1999 w Afryce Południowej. Najwcześniejszy przypadek chytridiomycosis został znaleziony w próbce X. laevis z 1938 roku. Badanie sugeruje również, że chytridiomycosis była stabilną infekcją w Afryce Południowej od 23 lat przed wykryciem jakiegokolwiek zakażenia poza Afryką. Istnieją nowsze informacje, że gatunek pochodzi z Półwyspu Koreańskiego i został rozprzestrzeniony przez handel żabami.
Amerykańskie żaby ryczące ( Lithobates catesbeianus ), również szeroko rozpowszechnione, są również uważane za nosicieli choroby ze względu na ich wrodzoną niską podatność na zakażenie B. dendrobatidis . Żaba rycząca często ucieka z niewoli i może założyć zdziczałe populacje, w których może wprowadzić chorobę na nowe obszary. Wykazano również, że B. dendrobatidis może przetrwać i rosnąć w wilgotnej glebie i na ptasich piórach, co sugeruje, że B. dendrobatidis może być również przenoszony w środowisku przez ptaki i transport gleby. Infekcje powiązano z masową śmiertelnością płazów w Ameryce Północnej , Południowej , Środkowej , Europie i Australii . B. dendrobatidis bierze udział w wyginięciu żaby dziennej ostropysa ( Taudactylus acutirostris ) w Australii.
Szeroka gama żywicieli płazów została zidentyfikowana jako podatna na infekcję B. dendrobatidis , w tym żaby leśne ( Lithobates sylvatica ), żaba górska żółtonoga ( Lithobates muscosa ), salamandra południowa ( Eurycea cirigera ), San Marcos Salamander ( Eurycea nana ), Texas Salamander ( neotenes Eurycea ), Blanco Rzeka Springs Salamander ( Eurycea pterophila ), Barton Springs Salamander ( Eurycea sosorum ) Jollyville Plateau Salamander ( Eurycea tonkawae ) Ambystoma jeffersonianum zachodnia pseudacris ( Pseudacris triseriata ) , żaba świerszcza południowego ( Acris gryllus ), ropucha grzebiuszka ( Scaphiopus holbrooki ), żaba lamparta ( Lithobates sphenocephala ), żaba z Rio Grande Leopard ( Lithobates berlandieri ) i traszka sardyńska ( Euproctus platycephalus ). i endemiczny gatunek żaby, żaba Beysehir w Turcji ( Pelophylax caralitanus ).
Azja Południowo-Wschodnia
Chociaż większość badań dotyczących B. dendrobatidis przeprowadzono w różnych miejscach na świecie, obecność grzyba w Azji Południowo-Wschodniej pozostaje stosunkowo niedawnym zjawiskiem. Dokładny proces, w którym grzyb został wprowadzony do Azji, nie jest znany, jednak, jak wspomniano powyżej, sugeruje się, że transport bezobjawowych gatunków nosicieli (np. Lithobates catesbeianus , żaba rycząca ) może być kluczowym elementem w rozprzestrzenianiu się grzyba. , przynajmniej w Chinach . Wstępne badania wykazały obecność grzyba na wyspach/krajach, takich jak Hongkong , Indonezja , Tajwan i Japonia . Wkrótce potem kraje Azji kontynentalnej, takie jak Tajlandia , Korea Południowa i Chiny, zgłosiły przypadki występowania B. dendrobatidis wśród swoich populacji płazów. Wiele wysiłku włożono w sklasyfikowanie herpetofauny w krajach takich jak Kambodża , Wietnam i Laos, gdzie często odkrywane są nowe gatunki żab, ropuch i innych płazów i gadów. Naukowcy jednocześnie pobierają wymaz z herpetofauny, aby ustalić, czy te nowo odkryte zwierzęta posiadają ślady grzyba.
W Kambodży badania wykazały, że B. dendrobatidis występuje w całym kraju na terenach w pobliżu Phnom Penh (we wsi <5 km), Sihanoukville (żaby zebrane z lokalnego targu), Kratie (żaby zebrane z ulic wokół miasta), i Siem Reap (żaby zebrane z rezerwatu narodowego: Angkor Center for Conservation of Biodiversity ). W innym badaniu w Kambodży zakwestionowano potencjalny wpływ antropologiczny na rozprzestrzenianie się B. dendrobatidis na lokalne populacje płazów w 3 różnych obszarach w odniesieniu do interakcji człowieka: niski (izolowany las na szczycie rzadko odwiedzanej przez ludzi gór), średni (droga leśna ~15). km od wioski, z której korzysta się co najmniej raz w tygodniu) i wysokiej (mała wioska, w której ludzie na co dzień wchodzą w interakcję ze swoim środowiskiem). Stosując ilościową PCR , dowody na B. dendrobatidis znaleziono we wszystkich 3 stanowiskach z najwyższym odsetkiem płazów pozytywnych na obecność grzyba z drogi leśnej (średni wpływ; 50%), a następnie w lesie górskim (mały wpływ; 44%) i wieś (duży wpływ; 36%). Wpływ człowieka najprawdopodobniej wyjaśnia wykrycie grzyba w średnich i wysokich obszarach, jednak nie dostarcza wystarczającego wyjaśnienia, dlaczego nawet izolowane płazy były pozytywne w kierunku B. dendrobatidis . Może to pozostać bez odpowiedzi, dopóki nie zostanie przeprowadzone więcej badań nad przenoszeniem grzyba przez krajobrazy. Jednak ostatnie dowody sugerują, że komary mogą być potencjalnym wektorem, który może pomóc w rozprzestrzenianiu się B. dendrobatidis. Inne badanie w Gujanie Francuskiej donosi o powszechnym zakażeniu, przy czym 8 z 11 pobranych miejsc dało wynik pozytywny pod kątem zakażenia B. dendrobatidis dla co najmniej jednego gatunku. Badanie to sugeruje, że Bd jest bardziej rozpowszechnione niż wcześniej sądzono.
Wpływ na płazy
Światowe populacje płazów stale spadają z powodu nasilenia się choroby Chytridiomycosis , wywoływanej przez tego grzyba Bd . Bd można wprowadzić do płazów głównie poprzez kontakt z wodą, kolonizując palce i brzuszne powierzchnie ciała zwierzęcia i rozprzestrzeniając się po całym ciele w miarę dojrzewania zwierzęcia. Potencjalne skutki tego patogenu to hiperkeratoza , przerost naskórka , wrzody, a przede wszystkim zmiana w regulacji osmotycznej, często prowadząca do zatrzymania akcji serca. Śmiertelność płazów zależy od wielu czynników, ale przede wszystkim od intensywności infekcji. Stwierdzono, że niektóre gatunki płazów przystosowują się do infekcji po początkowym obumarciu, przy czym wskaźniki przeżycia osobników zakażonych i niezakażonych są równe.
Według badań przeprowadzonych przez Australijski Uniwersytet Narodowy szacuje się, że grzyb Bd spowodował spadek liczby 501 gatunków płazów – około 6,5 procent światowej znanej całości. Spośród nich 90 zostało całkowicie zlikwidowanych, a inne 124 gatunki spadły o ponad 90 procent, a ich szanse na powrót do zdrowia dotkniętych gatunków do zdrowej populacji są wątpliwe. Jednak wnioski te zostały skrytykowane w późniejszych badaniach, które sugerowały, że Bd nie był tak głównym motorem spadku liczby płazów, jak stwierdzono w poprzednim badaniu.
Zobacz też
Bibliografia
Dalsza lektura
- Daszak, Piotr; Bergera L; Cunninghama AA; Hyatt AD; zielony DE; Speare R. (1999). „Pojawiające się choroby zakaźne i spadki populacji płazów” . Pojawiające się choroby zakaźne . 5 (6): 735–748. doi : 10.3201/eid0506.990601 . PMC 2640803 . PMID 10603206 .
- Johnson, Megan L.; Speare, Richard (sierpień 2003). „Przeżycie Batrachochytrium dendrobatidis w wodzie: implikacje kwarantanny i kontroli chorób” . Pojawiające się choroby zakaźne . 9 (8): 915–921. doi : 10.3201/eid0908.030145 . PMC 3020615 . PMID 12967488 .
