Blastocysta - Blastocyst
| Blastocysta | |
|---|---|
 Blastocysta tuż przed implantacją
| |
 Ludzka blastocysta z wewnętrzną masą komórkową w prawym górnym rogu
| |
| Detale | |
| Etap Carnegie | 3 |
| Dni | 5–9 |
| Daje początek | Gastrula |
| Identyfikatory | |
| łacina | Blastocystis |
| Siatka | D001755 |
| TE | E2.0.1.2.0.0.12 |
| FMA | 83041 |
| Terminologia anatomiczna | |
Blastocysta jest strukturą utworzoną w wczesnego rozwoju ssaków . Posiada wewnętrzną masę komórkową (ICM), która następnie tworzy zarodek . Zewnętrzna warstwa blastocysty składa się z komórek zwanych łącznie trofoblastem . Warstwa ta otacza wewnętrzną masę komórek i wypełnioną płynem jamę znaną jako blastocoel . Trofoblast daje początek łożysku . Nazwa „blastocysty” wynika z greckich βλαστός blastos ( „główką”) i κύστις kystis ( „pęcherza, kapsułka”). U innych zwierząt nazywa się to blastulą .
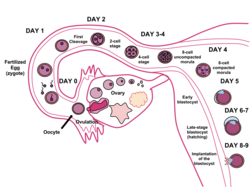
U ludzi tworzenie blastocysty rozpoczyna się około 5 dni po zapłodnieniu, kiedy w moruli , we wczesnym stadium embrionalnym kuli złożonej z 16 komórek, otwiera się wypełniona płynem jama . Blastocysta ma średnicę około 0,1-0,2 mm i składa się z 200-300 komórek po szybkim rozszczepieniu (podział komórek). Około siedmiu dni po zapłodnieniu blastocysty ulega implantacji , osadzania w endometrium w ścianie macicy . Tam przechodzi dalsze procesy rozwojowe, w tym gastrulację . Osadzenie blastocysty w endometrium wymaga wyklucia się z osłonki przejrzystej , co zapobiega przyleganiu do jajowodu, gdy przedzarodek przedostaje się do macicy.
Zastosowanie blastocyst w zapłodnieniu in vitro (IVF) polega na hodowaniu zapłodnionego jaja przez pięć dni przed przeniesieniem go do macicy. Może to być bardziej opłacalna metoda leczenia niepłodności niż tradycyjne IVF. Wewnętrzna masa komórkowa blastocyst jest źródłem embrionalnych komórek macierzystych , które mają szerokie zastosowanie w terapiach komórkami macierzystymi, w tym w naprawie, wymianie i regeneracji komórek.
Cykl rozwoju
Podczas rozwoju embrionalnego człowieka , około 5–6 dni po zapłodnieniu , komórki moruli zaczynają się różnicować , a morula przekształca się w blastocystę. W macicy ulega rozpadowi otoczka przejrzysta otaczająca blastocystę, umożliwiając jej zagnieżdżenie się w ścianie macicy około 6 dni po zapłodnieniu. Implantacja oznacza koniec zarodkowego etapu embriogenezy.
Formacja blastocysty
Zygoty rozwija się mitozy i gdy stała się 16 komórek staje się znane jako moruli . Do tego etapu rozwoju wszystkie komórki ( blastomery ) są autonomiczne i nie są określone żadnym losem. U wielu zwierząt morula rozwija się następnie przez kawitację, stając się blastulą. Różnicowanie komórkowe następnie rozwija komórki blastuli w dwa typy: komórki trofoblastu otaczające blastocoel i wewnętrzną masę komórek (embrioblast). Zarodek jest wtedy znany jako blastocysta. Strona blastocysty, gdzie tworzy się wewnętrzna masa komórkowa, nazywana jest biegunem zwierzęcym, a strona przeciwna to biegun roślinny. Zewnętrzna warstwa komórek trofoblastu, powstająca w wyniku zagęszczenia, pompuje jony sodu do blastocysty, co powoduje, że woda wnika przez osmozę i tworzy wewnętrzną, wypełnioną płynem jamę blastocysty (blastocoel). Blastokoel, komórki trofoblastu i komórki masy komórek wewnętrznych są cechami charakterystycznymi blastocysty.
Implantacja
Implantacja ma kluczowe znaczenie dla przetrwania i rozwoju wczesnego embrionu ludzkiego. Ustanawia połączenie między matką a wczesnym embrionem, które będzie trwało do końca ciąży. Implantacja jest możliwa dzięki zmianom strukturalnym zarówno blastocysty, jak i ściany endometrium. Te osłonki przejrzystej otaczające naruszenia blastocysty, dalej wylęgu . Znosi to ograniczenie fizycznych rozmiarów masy embrionalnej i odsłania zewnętrzne komórki blastocysty do wnętrza macicy. Co więcej, zmiany hormonalne u matki, w szczególności szczyt hormonu luteinizującego (LH), przygotowują endometrium do przyjęcia i otoczenia blastocysty. Układ odpornościowy jest również modulowany, aby umożliwić inwazję obcych komórek embrionalnych. Po związaniu się z macierzą zewnątrzkomórkową endometrium komórki trofoblastu wydzielają enzymy i inne czynniki w celu osadzenia blastocysty w ścianie macicy. Uwolnione enzymy degradują wyściółkę endometrium, podczas gdy autokrynne czynniki wzrostu, takie jak ludzka gonadotropina kosmówkowa (hCG) i insulinopodobny czynnik wzrostu (IGF), pozwalają blastocyście na dalszą inwazję endometrium.
Implantacja w ścianie macicy pozwala na kolejny etap embriogenezy, gastrulację , która obejmuje wytworzenie łożyska z komórek trofoblastycznych i różnicowanie wewnętrznej masy komórkowej do worka owodniowego i epiblastu .
Struktura
Istnieją dwa rodzaje komórek blastomerowych:
- Wewnętrzna masa komórkowa, znana również jako embrioblast , daje początek prymitywnej endodermie i zarodkowi właściwemu (epiblastowi).
- Pierwotna endoderma rozwija się w worek owodniowy, który tworzy wypełnioną płynem jamę, w której przebywa zarodek podczas ciąży.
- Epiblast daje początek trzem listkom zarodkowym rozwijającego się zarodka podczas gastrulacji ( endoderma , mezoderma i ektoderma ).
- Trofoblast to warstwa komórek tworząca zewnętrzny pierścień blastocysty, która łączy się z endometrium matki, tworząc łożysko. Komórki trofoblastu również wydzielają czynniki tworzące blastocoel.
- Po implantacji cytotrofoblast stanowi wewnętrzną warstwę trofoblastu, złożoną z komórek macierzystych, z których powstają komórki składające się z kosmków kosmówki , łożyska i syncytiotrofoblastu .
- Po wszczepieniu syncytiotrofoblast jest najbardziej zewnętrzną warstwą trofoblastu. Komórki te wydzielają enzymy proteolityczne, aby rozbić macierz zewnątrzkomórkową endometrium, aby umożliwić implantację blastocysty w ścianie macicy.
Jama płynu blastocoel zawiera aminokwasy , czynniki wzrostu i inne cząsteczki niezbędne do różnicowania komórek .
Specyfikacja komórki
Szereg procesów kontroluje specyfikację linii komórkowej w blastocyście w celu wytworzenia trofoblastu, epiblastu i prymitywnej endodermy. Procesy te obejmują ekspresję genów, sygnalizację komórkową, kontakt komórka-komórka i relacje pozycyjne oraz epigenetykę .
Po ustaleniu ICM w blastocyście ta masa komórkowa przygotowuje się do dalszej specyfikacji do epiblastu i pierwotnej endodermy. Ten proces specyfikacji jest częściowo określony przez sygnalizację czynnika wzrostu fibroblastów (FGF), która generuje szlak kinazy MAP w celu zmiany genomów komórkowych. Dalsza segregacja blastomerów do trofoblastu i wewnętrznej masy komórkowej jest regulowana przez białko homeodomenowe Cdx2 . Ten czynnik transkrypcyjny hamuje ekspresję czynników transkrypcyjnych Oct4 i Nanog w trofoblastie . Te zmiany genomowe pozwalają na progresywną specyfikację zarówno epiblastów, jak i prymitywnych linii endodermy pod koniec fazy rozwoju blastocysty poprzedzającej gastrulację. Wiele badań prowadzonych na tych wczesnych stadiach embrionalnych dotyczy embrionów myszy, a specyficzne czynniki mogą się różnić między ssakami.
Podczas implantacji trofoblast daje początek błonom pozazarodkowym i typom komórek, które ostatecznie uformują większość łożyska płodowego, wyspecjalizowanego organu, przez który zarodek uzyskuje pożywienie matczyne niezbędne do późniejszego wzrostu wykładniczego. Specyfikację trofoblastu kontroluje się przez kombinację sygnałów morfologicznych wynikających z polarności komórki ze zróżnicowaną aktywnością szlaków sygnałowych, takich jak Hippo i Notch, oraz ograniczeniem do zewnętrznych komórek specyfikatorów linii, takich jak CDX2.
U myszy pierwotne komórki rozrodcze są wyodrębniane z komórek epiblastu , procesowi temu towarzyszy rozległe przeprogramowanie epigenetyczne obejmujące cały genom . Przeprogramowanie obejmuje globalną demetylację DNA i reorganizację chromatyny, co skutkuje totipotencją komórkową . Proces demetylacji całego genomu obejmuje ścieżkę naprawy przez wycinanie zasad DNA .
Trofoblasty eksprymują integryny na swoich powierzchniach komórkowych, co umożliwia adhezję do macierzy zewnątrzkomórkowej ściany macicy. Ta interakcja umożliwia implantację i wyzwala dalszą specyfikację do trzech różnych typów komórek, przygotowując blastocystę do gastrulacji.
Implikacje kliniczne
Testy ciążowe
Poziom ludzkiej gonadotropiny kosmówkowej wydzielanej przez blastocystę podczas implantacji jest czynnikiem mierzonym w teście ciążowym . hCG można zmierzyć zarówno we krwi, jak i moczu, aby ustalić, czy kobieta jest w ciąży. Więcej hCG jest wydzielane w ciąży mnogiej. Badania krwi hCG można również wykorzystać do sprawdzenia nieprawidłowych ciąż.
Zapłodnienie in vitro
Zapłodnienie in vitro (IVF) jest alternatywą dla tradycyjnegozapłodnienia in vivo w celu zapłodnienia komórki jajowej nasieniem i wszczepienia tego zarodka do macicy samicy. Przez wiele lat zarodek był wprowadzany do macicy dwa do trzech dni po zapłodnieniu. Jednak na tym etapie rozwoju bardzo trudno jest przewidzieć, które zarodki rozwiną się najlepiej, a kilka zarodków zostało zazwyczaj wszczepionych. Kilka wszczepionych embrionów zwiększyło prawdopodobieństwo rozwoju płodu, ale także doprowadziło do rozwoju wielu płodów. Był to poważny problem i wada wykorzystania embrionów w IVF.
Skuteczne okazało się zastosowanie blastocyst do zapłodnienia in vitro człowieka . Blastocysta jest wszczepiana pięć do sześciu dni po zapłodnieniu jajeczek. Po pięciu lub sześciu dniach znacznie łatwiej jest określić, które embriony zaowocują zdrowymi, żywymi narodzinami. Wiedza, które zarodki odniosą sukces, pozwala wszczepić tylko jedną blastocystę, co radykalnie zmniejsza ryzyko zdrowotne i koszty porodów mnogich. Teraz, gdy określono wymagania odżywcze dla rozwoju zarodka i blastocysty, znacznie łatwiej jest zapewnić zarodkom odpowiednie składniki odżywcze, aby utrzymać je w fazie blastocysty.
Implantacja blastocysty po zapłodnieniu in vitro jest bezbolesnym zabiegiem, w którym do pochwy wprowadzany jest cewnik, prowadzony przez szyjkę macicy za pomocą ultradźwięków do macicy, gdzie blastocysty są wprowadzane do macicy.
Blastocysty mają również zaletę, ponieważ można je wykorzystać do genetycznego testowania komórek w celu wykrycia problemów genetycznych. W blastocyście jest wystarczająco dużo komórek, aby kilka komórek trofektodermy można było usunąć bez zakłócania rozwijającej się blastocysty. Komórki te mogą być testowane pod kątem aneuploidii chromosomowej za pomocą preimplantacyjnej diagnostyki genetycznej (PGS) lub specyficznych stanów, takich jak mukowiscydoza , często znana jako preimplantacyjna diagnostyka genetyczna (PGD).
Zobacz też
Bibliografia
![]() Ten artykuł zawiera tekst w domenie publicznej z 20. edycji Gray's Anatomy (1918)
Ten artykuł zawiera tekst w domenie publicznej z 20. edycji Gray's Anatomy (1918)
Zewnętrzne linki