Okrągły RNA - Circular RNA
Okrągły RNA (lub circRNA ) to rodzaj jednoniciowego RNA, który w przeciwieństwie do liniowego RNA tworzy kowalencyjnie zamkniętą ciągłą pętlę. W okrągłym RNA końce 3' i 5' normalnie obecne w cząsteczce RNA zostały połączone. Ta cecha nadaje kolistemu RNA liczne właściwości, z których wiele dopiero niedawno zidentyfikowano.
Wiele typów kolistego RNA powstaje z genów kodujących białka. Wykazano, że niektóre okrągłe RNA kodują białka. Niektóre rodzaje kolistego RNA również wykazały niedawno potencjał jako regulatorów genów. Biologiczna funkcja większości kolistego RNA jest niejasna.
Ponieważ kolisty RNA nie ma końców 5' lub 3', jest odporny na degradację za pośrednictwem egzonukleazy i prawdopodobnie jest bardziej stabilny niż większość liniowych RNA w komórkach. Okrągłe RNA powiązano z niektórymi chorobami, takimi jak rak.
Splicing RNA
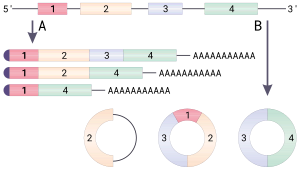
W przeciwieństwie do genów bakterii , geny eukariotyczne są dzielone przez niekodujące sekwencje zwane intronami . U eukariontów, gdy gen jest transkrybowany z DNA do transkryptu informacyjnego RNA (mRNA), interweniujące introny są usuwane, pozostawiając tylko eksony w dojrzałym mRNA, które mogą być następnie poddane translacji w celu wytworzenia produktu białkowego. Spliceosomu białko-RNA kompleks znajduje się w jądrze komórkowym, katalizuje splicingu w następujący sposób:
- Spliceosomu rozpoznaje intron , który jest otoczony przez sekwencje specyficzne na końcu 5' i 3' , znany jako donorowe miejsce składania RNA (lub 5' ) i miejsce splicingowe akceptorowe splicingu w miejscu (lub 3' miejsca złączenia), odpowiednio.
- Sekwencja miejsca splicingu 5' jest następnie poddawana nukleofilowemu atakowi przez sekwencję w dół zwaną punktem rozgałęzienia, co skutkuje kolistą strukturą zwaną lariat.
- Wolny egzon 5' następnie atakuje miejsce splicingu 3', łącząc oba eksony i uwalniając strukturę znaną jako lariat intronowy . Lariat intronowy jest następnie odgałęziony i szybko degradowany.
Splicing alternatywny
Splicing alternatywny jest zjawiskiem, dzięki któremu jeden transkrypt RNA może dawać różne produkty białkowe w oparciu o to, które segmenty są uważane za „introny” i „egzony” podczas splicingu. Chociaż nie jest to specyficzne dla ludzi, jest to częściowe wyjaśnienie faktu, że ludzie i inne znacznie prostsze gatunki (takie jak nicienie) mają podobną liczbę genów (w przedziale 20 – 25 tys.). Jednym z najbardziej uderzających przykładów alternatywnego splicingu jest gen DSCAM Drosophila , który może dać początek około 30 tysiącom odrębnych izoform o alternatywnym splicingu.
Splicing niekanoniczny
Szyfrowanie egzonów
Mieszanie egzonów, zwane również tasowaniem egzonów, opisuje zdarzenie, w którym egzony są splatane w „niekanonicznej” (nietypowej) kolejności. Istnieją trzy sposoby, w jakie może wystąpić szyfrowanie egzonów:
- Tandemowa duplikacja egzonów w genomie, która często występuje w nowotworach.
- Trans-splicing , w którym dwa transkrypty RNA łączą się, w wyniku czego powstaje liniowy transkrypt zawierający eksony, które na przykład mogą pochodzić z genów kodowanych na dwóch różnych chromosomach. Trans-splicing jest bardzo powszechny u C. elegans
- Miejsce donora splicingu połączone z miejscem akceptorowym splicingu dalej w górę pierwotnego transkryptu, dające kolisty transkrypt.
Pogląd, że cyrkularne transkrypty są produktami ubocznymi niedoskonałego splicingu, potwierdza niska liczebność i brak konserwacji sekwencji większości circRNA, ale został zakwestionowany.
Charakterystyka kołowego RNA
Wczesne odkrycia circRNA
Wczesne odkrycia kolistych RNA doprowadziły do przekonania, że nie mają one znaczenia ze względu na ich rzadkość. Te wczesne odkrycia obejmowały analizę genów, takich jak geny DCC i Sry , oraz niedawne odkrycie ludzkiego niekodującego RNA ANRIL , z których wszystkie wyrażały kołowe izoformy. Odkryto również geny wytwarzające CircRNA, takie jak ludzki gen ETS-1 , ludzki i szczurzy gen cytochromu P450 , szczurzy gen białka wiążącego androgeny ( Shbg ) oraz ludzki gen dystrofiny.
Identyfikacja circRNA w całym genomie
Zaszyfrowane izoformy i circRNA
W 2012 roku, starając się wstępnie zidentyfikować specyficzne dla raka zdarzenia szyfrujące egzon, wymieszane eksony odkryto w dużej liczbie zarówno w komórkach normalnych, jak i rakowych. Stwierdzono, że pomieszane izoformy egzonów stanowiły około 10% wszystkich izoform transkryptu w leukocytach , przy czym zidentyfikowano 2748 pomieszanych izoform w embrionalnych komórkach macierzystych HeLa i H9 . Dodatkowo, około 1 na 50 eksprymowanych genów wytwarzało zaszyfrowane izoformy transkryptu przez co najmniej 10% czasu. Testy stosowane do rozpoznawania kolistości obejmowały traktowanie próbek RNazą R , enzymem, który degraduje liniowe, ale nie koliste RNA, oraz badanie na obecność ogonków poli-A , które nie są obecne w cząsteczkach kolistych. Ogólnie rzecz biorąc, 98% zaszyfrowanych izoform reprezentowało circRNA, circRNA znajdowały się w cytoplazmie, a circRNA były liczne.
Odkrycie większej liczebności circRNA
W 2013 roku odkryto większą ilość circRNA. RNA ludzkich fibroblastów potraktowano RNazą R w celu wzbogacenia w koliste RNA, po czym dokonano kategoryzacji kolistych transkryptów na podstawie ich liczebności (niska, średnia, wysoka). Stwierdzono, że około 1 na 8 eksprymowanych genów wytwarza wykrywalne poziomy circRNA, w tym te o niskiej liczebności, która była znacznie wyższa niż wcześniej podejrzewano i została przypisana większej głębokości sekwencjonowania .
Specyficzność tkankowa CircRNA i aktywność antagonistyczna
W tym samym czasie opracowano metodę obliczeniową wykrywania circRNA, która doprowadziła do wykrywania de novo circRNA u ludzi, myszy i C. elegans oraz ich walidacji. Często stwierdzano, że ekspresja circRNA jest specyficzna dla tkanki/stadium rozwojowego. Dodatkowo stwierdzono, że circRNA mają zdolność do działania jako antagoniści miRNA, mikroRNA, które zakłócają translację mRNA, czego przykładem jest CDR1as circRNA , który ma miejsca wiązania miRNA (jak widać poniżej).
CircRNAs i ENCODE Ribozero RNA-seq data
W 2014 roku ludzkie circRNA zostały zidentyfikowane i określone ilościowo na podstawie danych ENCODE Ribozero RNA-seq . Stwierdzono, że większość circRNA to pomniejsze izoformy splicingowe i ulegają ekspresji tylko w kilku typach komórek, przy czym 7112 ludzkich circRNA ma frakcje koliste (ułamek podobieństwa, jakie izoforma ma do transkrypcji tego samego locus) co najmniej 10%. Stwierdzono również, że CircRNA nie są bardziej konserwatywne niż ich liniowe kontrole i, zgodnie z profilowaniem rybosomów, nie ulegają translacji. Jak wcześniej wspomniano, circRNA mają zdolność działania jako antagoniści miRNA, co jest również znane jako potencjał działania jako gąbki mikroRNA. Oprócz CDR1a bardzo niewiele circRNA ma potencjał do działania jako gąbki mikroRNA. Ogólnie rzecz biorąc, większość kolistych RNA okazała się nieistotnymi produktami ubocznymi niedoskonałego splicingu.
CircRNA i CIRCexplorer
W tym samym roku opracowano CIRCexplorer, narzędzie służące do identyfikacji tysięcy circRNA u ludzi bez danych sekwencyjnych RNazy R RNA . Stwierdzono, że zdecydowana większość zidentyfikowanych kolistych RNA o wysokim stopniu ekspresji jest przetwarzana z eksonów znajdujących się w środku genów RefSeq , co sugeruje, że tworzenie kolistego RNA jest generalnie sprzężone ze splicingiem RNA. Ustalono, że większość kolistych RNA zawiera wiele, najczęściej od dwóch do trzech, eksonów. Stwierdzono, że egzony z circRNA z tylko jednym cyrkularnym eksonem są znacznie dłuższe niż te z circRNA z wieloma cyrkularnymi eksonami, co wskazuje, że przetwarzanie może preferować pewną długość, aby zmaksymalizować cyrkulację egzonów. Introny cyrkularnych egzonów zazwyczaj zawierają wysokie gęstości Alu, które mogą tworzyć odwrócone, powtarzające się pary Alu (IRAlus). IRAlus, zbieżne lub rozbieżne, są zestawione w poprzek flankujących intronów circRNA w sposób równoległy z podobnymi odległościami do sąsiednich egzonów. Stwierdzono również, że IRAlus i inne nie powtarzające się, ale komplementarne sekwencje sprzyjają tworzeniu kolistego RNA. Z drugiej strony ustalono, że na wydajność cyrkularyzacji egzonów ma wpływ współzawodnictwo parowania RNA, tak że alternatywne parowanie RNA i jego współzawodnictwo prowadzi do alternatywnej cyrkularyzacji. Wreszcie stwierdzono, że zarówno cyrkulacja egzonów, jak i jej regulacja, są ewolucyjnie dynamiczne.
Wywoływanie całego genomu circRNA w przypadkach choroby Alzheimera
Przypadki choroby Alzheimera (AD) wykazały rolę circRNA w zdrowiu i chorobie. Potok do wywoływania circRNA z ludzkiego sekwencji RNA pozbawionej rybo, zoptymalizowany i zweryfikowany . Wyjaśniono związek między circRNA a chorobami neurodegeneracyjnymi, takimi jak AD i kliniczną demencją, przy czym w sumie 148 circRNA było istotnie skorelowanych z klinicznymi ocenami demencji przy wydechu/śmierci (CDR) po korekcie współczynnika fałszywych odkryć (FDR). Ekspresja circRNA była niezależna od postaci liniowej i ta ekspresja circRNA była również korygowana przez proporcje komórek. Stwierdzono również , że CircRNA ulegają koekspresji ze znanymi przyczynowymi genami Alzheimera, takimi jak APP i PSEN1 , co wskazuje, że niektóre circRNA są również częścią szlaku przyczynowego. Podsumowując, stwierdzono, że ekspresja circRNA w mózgu wyjaśnia więcej objawów klinicznych choroby Alzheimera niż liczbę alleli APOε4, co sugeruje, że circRNA mogą być wykorzystywane jako potencjalny biomarker choroby Alzheimera.
Klasy CircRNA
Okrągłe RNA można podzielić na pięć klas:
| Klasy kołowych RNA | Opis |
| Wiroidy i wirus zapalenia wątroby typu delta (HDV) | W wiroidach i HDV jednoniciowe circRNA są niezbędne w replikacji RNA. Okrągłość pozwala, aby jedno zdarzenie inicjacyjne prowadziło do wielu kopii genomowych w procesie znanym również jako replikacja RNA toczącego się koła . |
| CircRNA z intronów | Cząsteczki kołowe są wytwarzane przez introny powstałe w wyniku splicingu spliceosomalnego, splicingu tRNA oraz intronów grupy I i grupy II (samosplicing rybozymy). Introny grupy I tworzą circRNA poprzez autokatalityczne działanie rybozymów i chociaż można je wykryć in vivo, ich funkcja nie została jeszcze ustalona. Introny grupy II wytwarzają również circRNA in vivo . Okrągłe introny wytwarzane przez eukariotyczne spliceosomalne splicingi są cyrkularnymi lariatami intronowymi, znanymi jako kołowe intronowe RNA (ciRNA). Ze względu na cyrkulację ciRNA mogą uniknąć degradacji i uważa się, że są nadreprezentowane. Funkcja CiRNA jest obecnie nieznana; spekuluje się jednak, że mogą one odgrywać rolę we wzmacnianiu transkrypcji genów, z których są wytwarzane, ponieważ oddziałują z polimerazą RNA II. |
| CircRNA z produktów pośrednich w reakcjach przetwarzania RNA | Są one najpierw składane z prekursorów jako cząsteczki liniowe, a następnie cyrkularne za pomocą ligazy. Są one niezbędne do umożliwienia zmiany kolejności sekwencji RNA i są niezbędne w biogenezie permutowanych genów tRNA w niektórych algach i archeonach. |
| Niekodujące circRNA w archeonach | Niektóre gatunki archeonów mają circRNA, które są wytwarzane z wyciętych cyrkularnych intronów tRNA. Uważa się, że cyrkularyzacja funkcjonalnych niekodujących RNA działa jako mechanizm ochronny przed egzonukleazami i sprzyja prawidłowemu fałdowaniu. |
| CircRNA u eukariontów wytwarzane przez back-splicing | Okrągłe RNA wytwarzane przez back-splicing (forma mieszania egzonów) występują, gdy miejsce splicingu 5' jest połączone z miejscem splicingu 3' w górę. Obecnie u ludzi zidentyfikowano ponad 25 000 różnych circRNA. |
Długość circRNA
Niedawne badanie ludzkich circRNA wykazało, że cząsteczki te zwykle składają się z 1–5 eksonów. Każdy z tych egzonów może być do trzech razy dłuższy niż średni ekson wyrażany, co sugeruje, że długość egzonu może odgrywać rolę w podejmowaniu decyzji, które egzony mają być cyrkularne. 85% cyrkularnych eksonów pokrywa się z eksonami kodującymi białko , chociaż same okrągłe RNA nie wydają się ulegać translacji. Podczas tworzenia circRNA, ekson 2 jest często poprzedzającym eksonem „akceptorowym”.
Introny otaczające egzony wybrane do cyrkularyzacji są średnio do trzech razy dłuższe niż te, które nie otaczają egzonów poprzedzających koło, chociaż nie jest jeszcze jasne, dlaczego tak się dzieje. Porównaniu z obszarami, które nie powstało w środowiskach tych intronów są znacznie częściej zawierają komplementarnych, odwróconych Alu powtórzenia Alu jest najczęstszą transpozonu w genomie. Dzięki temu, że Alu powtarza parowanie zasad ze sobą, zaproponowano, że może to umożliwić odnalezienie się miejsc łączenia, ułatwiając w ten sposób cyrkulację.
Introny w circRNA są zatrzymywane ze stosunkowo dużą częstotliwością (~ 25%), co dodaje dodatkową sekwencję do dojrzałych circRNA.
Lokalizacja circRNA w komórce
W komórce circRNA znajdują się głównie w cytoplazmie , gdzie liczba kolistych transkryptów RNA pochodzących z genu może być nawet dziesięciokrotnie większa niż liczba powiązanych liniowych RNA generowanych z tego locus . Nie jest jasne, w jaki sposób okrągłe RNA opuszczają jądro przez stosunkowo mały por jądrowy . Ponieważ otoczka jądrowa rozpada się podczas mitozy , jedną z hipotez jest to, że cząsteczki opuszczają jądro podczas tej fazy cyklu komórkowego . Jednak niektóre circRNA, takie jak CiRS-7/CDR1a, ulegają ekspresji w tkankach neuronalnych, gdzie podział mitotyczny nie jest powszechny.
CircRNA są stabilne w porównaniu z liniowymi RNA
CircRNA nie mają poliadenylowanego ogona i dlatego przewiduje się, że są mniej podatne na degradację przez egzonukleazy. W 2015 roku Enuka i in. zmierzyli okresy półtrwania 60 circRNA i ich liniowych odpowiedników eksprymowanych z tego samego genu gospodarza i ujawnili, że średni okres półtrwania circRNA komórek sutka (18,8 do 23,7 godzin) jest co najmniej 2,5 razy dłuższy niż średni okres półtrwania ich liniowe odpowiedniki (4,0 do 7,4 godziny). Ogólnie czas życia cząsteczek RNA określa ich czas odpowiedzi. W związku z tym doniesiono, że circRNA sutka powoli reagują na stymulację przez czynniki wzrostu.
Widoczne funkcje kołowego RNA
Ewolucyjna konserwacja mechanizmów i sygnałów cyrkulacyjnych
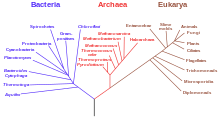
CircRNA zidentyfikowano u różnych gatunków w różnych domenach życia . W 2011 roku Danan i in. zsekwencjonowany RNA z Archaea . Po strawieniu całkowitego RNA za pomocą RNazy R byli w stanie zidentyfikować koliste gatunki, co wskazuje, że circRNA nie są specyficzne dla eukariontów. Jednak te koliste gatunki archeonów prawdopodobnie nie powstają poprzez splicing, co sugeruje, że prawdopodobnie istnieją inne mechanizmy generowania kolistego RNA.
Stwierdzono, że CircRNA są w dużej mierze konserwatywne u ludzi i owiec. Analizując dane z całkowitego sekwencjonowania RNA z kory płata ciemieniowego owcy i jednojądrzastych komórek krwi obwodowej wykazano, że 63% wykrytych circRNA jest homologicznych do znanych ludzkich circRNA.
W bliższym ewolucyjnym związku, porównanie RNA z jąder myszy z RNA z ludzkiej komórki wykazało 69 ortologicznych circRNA. Na przykład, zarówno ludzie, jak i myszy kodują geny HIPK2 i HIPK3 , dwie paralogiczne kinazy, które wytwarzają dużą ilość circRNA z jednego konkretnego eksonu u obu gatunków. Konserwacja ewolucyjna zwiększa prawdopodobieństwo istotnej i znaczącej roli w cyklizacji RNA.
CDR1as/CiRS-7 jako gąbka miR-7
mikroRNA (miRNA) to małe (~21nt) niekodujące RNA, które hamują translację informacyjnego RNA zaangażowanego w duży, zróżnicowany zestaw procesów biologicznych. Bezpośrednio łączą się w pary zasad, aby kierować informacyjnymi RNA (mRNA) i mogą wyzwalać cięcie mRNA w zależności od stopnia komplementarności.
MikroRNA są pogrupowane w „rodziny nasion”. Członkowie rodziny mają wspólne nukleotydy 2-7, znane jako region nasion. Białka argonautów są „białkami efektorowymi”, które pomagają miRNA w wykonywaniu ich pracy, podczas gdy gąbki mikroRNA to RNA, które „wypychają” miRNA z określonej rodziny, służąc tym samym jako konkurencyjne inhibitory, które tłumią zdolność miRNA do wiązania jego celów mRNA, dzięki obecności wielu miejsc wiążących, które rozpoznają określony region nasion. Niektóre koliste RNA mają wiele miejsc wiązania miRNA, co dało wskazówkę, że mogą one działać w gąbce. Dwie ostatnie prace potwierdziły tę hipotezę, szczegółowo badając kolistą gąbkę o nazwie CDR1as/CiRS-7, podczas gdy inne grupy nie znalazły bezpośrednich dowodów na to, że koliste RNA działają jak gąbki miRNA, analizując potencjalną interakcję kolistych RNA z białkiem Argonaut (AGO) za pomocą wysokoprzepustowe sekwencjonowanie RNA wyizolowanego przez dane z sieciowania i immunoprecypitacji (HITS-CLIP).
CDR1as/CiRS-7 jest zakodowany w genomie antysensownym w stosunku do ludzkiego locus CDR1 (genu) (stąd nazwa CDR1as) i celuje w miR-7 (stąd nazwa CiRS-7 – Circular RNA Sponge for miR-7 ). Ma ponad 60 miejsc wiązania miR-7, znacznie więcej niż jakakolwiek znana liniowa gąbka miRNA.
AGO2 jest powiązanym z miR-7 białkiem Argonaute (patrz wyżej). Chociaż CDR1as/CiRS-7 mogą być cięte przez miR-671 i związane z nim białko Argonaute, nie mogą być cięte przez miR-7 i AGO2. Aktywność cięcia mikroRNA zależy od komplementarności poza 12-tą pozycją nukleotydową; żadna z witryn wiążących CiRS-7 nie spełnia tego wymogu.
Eksperyment z danio pręgowanego , które nie mają locus CDR1 w swoim genomie, dostarcza dowodów na aktywność gąbki CIRS-7 za. Podczas rozwoju miR-7 ulega silnej ekspresji w mózgu danio pręgowanego. Aby wyciszyć ekspresję miR-7 u danio pręgowanego, Memczak i współpracownicy wykorzystali narzędzie zwane morfolino , które może tworzyć pary zasad i sekwestrować cząsteczki docelowe. Traktowanie Morfolino miało tak samo silny wpływ na rozwój śródmózgowia jak ektopowa ekspresja CiRS-7 w mózgach danio pręgowanego przy użyciu wstrzykiwanych plazmidów . Wskazuje to na istotną interakcję między CiRS-7 i miR-7 in vivo.
Inną godną uwagi okrągłą gąbką miRNA jest SRY . SRY, który jest silnie eksprymowany w jądrach myszy, działa jak gąbka miR-138 . W genomie SRY jest oflankowany długimi odwróconymi powtórzeniami (IR) o długości ponad 15,5 kilozasad (kb). Gdy jeden lub oba IR zostaną usunięte, cyklizacja nie występuje. To właśnie to odkrycie wprowadziło ideę odwróconych powtórzeń umożliwiających cyrkulację.
Ponieważ gąbki o okrągłym RNA charakteryzują się wysokim poziomem ekspresji, stabilnością i dużą liczbą miejsc wiązania miRNA, prawdopodobnie będą one bardziej skutecznymi gąbkami niż te, które są liniowe.
Inne możliwe funkcje circRNA
Chociaż ostatnio uwaga skupiła się na funkcjach „gąbki” circRNA, naukowcy rozważają również kilka innych możliwości funkcjonalnych. Na przykład, niektóre obszary hipokampu dorosłych myszy wykazują ekspresję CiRS-7, ale nie miR-7, co sugeruje, że CiRS-7 może odgrywać role niezależne od interakcji z miRNA.
Potencjalne role obejmują:
- Wiązanie z białkami wiążącymi RNA (RBP) i RNA oprócz miRNA w celu utworzenia kompleksów RNA-białko. Kompleksy te mogą regulować interakcje RBP i RNA na przykład z kanonicznym liniowym transkryptem genu.
- Produkcja białka
- Chen i Sarnow 1995 wykazali, że syntetyczny circRNA, który zawierał IRES (wewnętrzne miejsce wejścia rybosomu) wytwarzał produkt białkowy in vitro , podczas gdy ten bez IRES nie. Chociaż testowany circRNA był czysto sztucznym konstruktem, Chen i Sarnow stwierdzili w swoim artykule, że byliby zainteresowani sprawdzeniem, czy okręgi naturalnie zawierają elementy IRES.
- Jeck i in. 2013: Przetestowano naturalne circRNA, które zawierały translacyjny kodon startowy. Jednak żadna z tych cząsteczek nie wiązała się z rybosomami, co sugeruje, że wiele circRNA może nie podlegać translacji in vivo .
- Transportowanie miRNA wewnątrz komórki. Fakt, że CiRS-7 może być dzielony przez miR-671 może wskazywać na istnienie systemu uwalniającego „ładunek” miRNA w odpowiednim czasie.
- Regulowanie mRNA w komórce poprzez ograniczone parowanie zasad. Jest formalnie możliwe, że miR-7 moderuje aktywność regulacyjną CiRS-7 zamiast na odwrót!
Okrągłe intronowe długie niekodujące RNA (ciRNA)
Zwykle lariony intronowe (patrz wyżej) są odgałęzione i szybko degradowane. Jednak niepowodzenie odgałęzienia może prowadzić do powstania kolistych intronowych niekodujących długich RNA, znanych również jako ciRNA. Tworzenie CiRNA, zamiast być procesem losowym, wydaje się zależeć od obecności określonych elementów w pobliżu miejsca splicingu 5' i miejsca rozgałęzienia (patrz powyżej).
CiRNA różnią się od circRNA tym, że są bardziej widoczne w jądrze niż w cytoplazmie . Ponadto cząsteczki te zawierają niewiele (jeśli w ogóle) miejsc wiążących miRNA. Zamiast działać jak gąbki, ciRNA wydają się działać w regulowaniu ekspresji genów macierzystych. Na przykład, stosunkowo obfity ciRNA zwany ci-ankrd52 pozytywnie reguluje transkrypcję Pol II . Wiele ciRNA pozostaje w „miejscach syntezy” w jądrze. Jednak ciRNA może pełnić inne role niż po prostu regulowanie swoich genów macierzystych, ponieważ ciRNA lokalizują się w dodatkowych miejscach w jądrze innym niż ich „miejsca syntezy”.
Okrągłe RNA a choroba
Podobnie jak w przypadku większości tematów biologii molekularnej , ważne jest rozważenie, w jaki sposób kolisty RNA może być używany jako narzędzie pomocy ludzkości. Biorąc pod uwagę jego obfitość, konserwację ewolucyjną i potencjalną rolę regulacyjną, warto przyjrzeć się, w jaki sposób można wykorzystać koliste RNA do badania patogenezy i opracowywania interwencji terapeutycznych. Na przykład:
- Okrągły ANRIL (cANRIL) jest kołową formą ANRIL, długiego niekodującego RNA (ncRNA). Ekspresja canril jest skorelowana z ryzykiem miażdżycy , choroby, w której tętnice stają się twarde. Zaproponowano, że cANRIL może modyfikować ekspresję INK4 /ARF, co z kolei zwiększa ryzyko miażdżycy. Dalsze badania nad ekspresją cANRIL można potencjalnie wykorzystać do zapobiegania lub leczenia miażdżycy.
- miR-7 odgrywa ważną rolę regulacyjną w kilku nowotworach oraz w chorobie Parkinsona , która jest chorobą mózgu o nieznanym pochodzeniu. Być może aktywność gąbki CiRS-7 może pomóc w przeciwdziałaniu aktywności miR-7. Jeśli aktywność gąbek kolistych rzeczywiście może pomóc w przeciwdziałaniu szkodliwej aktywności miRNA, naukowcy będą musieli znaleźć najlepszy sposób na wprowadzenie ekspresji gąbek, być może poprzez transgen , który jest genem syntetycznym przenoszonym między organizmami. Ważne jest również rozważenie, w jaki sposób transgeny mogą być wyrażane tylko w określonych tkankach lub wyrażane tylko podczas indukcji.
- Stwierdzono, że kołowe RNA są regulowane przez hipoksję, zwłaszcza stwierdzono, że circRNA cZNF292 ma aktywność proangiogenną w komórkach śródbłonka.
Okrągłe RNA odgrywają rolę w patogenezie choroby Alzheimera
Dube i wsp. wykazali po raz pierwszy, że koliste RNA w mózgu (circRNA) są częścią zdarzeń patogennych prowadzących do choroby Alzheimera , wystawiając hipotezę, że specyficzne circRNA będzie różnie wyrażane w przypadkach AD w porównaniu do kontroli i że te efekty można wykryć we wczesnym stadium choroby. Zoptymalizowali i zwalidowali nowy potok analiz dla kolistych RNA (circRNA). Przeprowadzili trzyetapowy projekt badania, wykorzystując dane sekwencji RNA mózgu Knight ADRC jako odkrycie (etap 1), wykorzystując dane z Mount Sinai jako replikację (etap 2) i metaanalizę (etap 3) w celu zidentyfikowania najbardziej znaczące circRNA ulegające zróżnicowanej ekspresji w chorobie Alzheimera. Korzystając z jego potoku, znaleźli 3547 circRNA, które przeszły rygorystyczną kontrolę jakości w kohorcie Knight ADRC, która obejmuje sekwencje RNA z 13 kontroli i 83 przypadków choroby Alzheimera, a 3924 circRNA przeszło rygorystyczną kontrolę jakości w zestawie danych MSBB. Metaanaliza wyników odkrycia i replikacji wykazała łącznie 148 circRNA, które były istotnie skorelowane z CDR po korekcji FDR. Ponadto, 33 circRNA przeszły surowe genowych, korekta wielokrotnego testu Bonferroni 5 x 10-6 tym circHOMER1 (P = 2,21 x 10 -18 ) i circCDR1-AS (P = 2,83 x 10 -8 ), m.in. . Przeprowadzili również dodatkowe analizy, aby wykazać, że ekspresja circRNA była niezależna od postaci liniowej, a także proporcji komórek, które mogą zakłócać analizy sekwencji RNA mózgu w badaniach nad chorobą Alzheimera. Przeprowadzili analizy koekspresji wszystkich circRNA wraz z formami liniowymi i odkryli, że circRNA, w tym te, które ulegały zróżnicowanej ekspresji w chorobie Alzheimera, w porównaniu do kontroli koekspresji ze znanymi przyczynowymi genami Alzheimera, takimi jak APP i PSEN1, co wskazuje, że niektóre circRNA są również częścią szlaku przyczynowego. Wykazali również, że ekspresja cirRNA w mózgu wyjaśniała więcej objawów klinicznych choroby Alzheimera niż liczbę alleli APOε4, co sugeruje, że może być wykorzystany jako potencjalny biomarker choroby Alzheimera. Jest to ważne badanie w tej dziedzinie, ponieważ po raz pierwszy circRNA są określane ilościowo i walidowane (przez PCR w czasie rzeczywistym) w próbkach ludzkiego mózgu na skalę całego genomu oraz w dużych i dobrze scharakteryzowanych kohortach. Pokazuje również, że te formy RNA mogą mieć wpływ na złożone cechy, w tym chorobę Alzheimera, pomogą zrozumieć zdarzenia biologiczne prowadzące do choroby.
Wiroidy jako okrągłe RNA
Wiroidy to głównie patogeny roślinne, które składają się z krótkich odcinków (kilkaset zasad nukleinowych) wysoce komplementarnych, kolistych, jednoniciowych i niekodujących RNA bez otoczki białkowej. W porównaniu z innymi zakaźnymi patogenami roślin, wiroidy mają bardzo małe rozmiary, od 246 do 467 zasad nukleinowych; składają się zatem z mniej niż 10 000 atomów. Dla porównania, genom najmniejszych znanych wirusów zdolnych do samodzielnego wywołania infekcji ma długość około 2000 zasad nukleinowych.