Podofilotoksyna - Podophyllotoxin
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Condyloks, Wartec, inne |
| Inne nazwy | (5 R 5a R , 8a R , 9 R ) -9-hydroksy-5- (3,4,5-trimetoksyfenylo) -5,8,8a, 9-tetrahydrofuro [3' , 4' : 6,7] nafto [2,3- d ] [1,3] dioksol-6 (5a H ) -on |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a684055 |
Kategoria ciąży |
|
| Kod ATC | |
| Dane farmakokinetyczne | |
| Okres półtrwania eliminacji | 1,0 do 4,5 godziny. |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.007.502 |
| Dane chemiczne i fizyczne | |
| Formuła | C 22 H 22 O 8 |
| Masa cząsteczkowa | 414,410 g·mol -1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | 183,3 do 184 °C (361,9 do 363,2 °F) |
| |
| |
|
| |
Podofilotoksyna ( PPT ) jest aktywnym składnikiem preparatu Podofilox , który jest kremem medycznym stosowanym w leczeniu brodawek narządów płciowych i mięczaka zakaźnego . Nie jest zalecany w zakażeniach HPV bez brodawek zewnętrznych. Może być stosowany przez świadczeniodawcę lub samą osobę.
Jest to nie- alkaloidem toksyna Lignina ekstrahowana z korzeni i kłącza z podophyllum gatunków. Dostępna jest również mniej wyrafinowana forma znana jako żywica podophyllum , ale ma ona większe skutki uboczne.
Podofyllotoksyna został po raz pierwszy wyizolowany w czystej postaci w 1880 Valerian Podwyssotzki (1818 - 28 stycznia 1892), polsko-rosyjski Privatdozent na Uniwersytecie w Dorpacie (obecnie Tartu , Estonia ) i asystent w Instytucie tam farmakologiczne.
Znajduje się na Liście Leków Podstawowych Światowej Organizacji Zdrowia .
Zastosowania medyczne
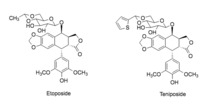
Podofilotoksyna ma wiele zastosowań medycznych, ponieważ jest w stanie zatrzymać replikację zarówno komórkowego, jak i wirusowego DNA poprzez wiązanie niezbędnych enzymów . Może dodatkowo destabilizować mikrotubule i zapobiegać podziałom komórek . Ze względu na te interakcje jest uważany za lek antymitotyczny. Podofilotoksyny i jego pochodne stosuje się jako oczyszczających , przeczyszczający , przeciwwirusowego środka, pęcherzy , antihelminthic i przeciwnowotworowymi środkami. Środki przeciwnowotworowe pochodzące z podofilotoksyny obejmują etopozyd i tenipozyd . Leki te są z powodzeniem stosowane w terapii przeciwko licznym nowotworom, w tym rakowi jąder, piersi, trzustki, płuc, żołądka i jajnika.
Krem z podofilotoksyną jest powszechnie przepisywany jako silny środek przeciwwirusowy do stosowania miejscowego. Stosuje się go w leczeniu infekcji HPV z brodawkami zewnętrznymi oraz infekcji mięczaka zakaźnego. Krem 0,5% PPT jest przepisywany do stosowania dwa razy dziennie przez 3 dni, a następnie 4 dni bez aplikacji, ten tygodniowy cykl jest powtarzany przez 4 tygodnie. Może być również przepisywany jako żel, w przeciwieństwie do kremu. PPT jest również sprzedawany pod nazwami condyline i warticon.
Niekorzystne skutki
Najczęstsze skutki uboczne kremu z podofilotoksyną są zazwyczaj ograniczone do podrażnienia tkanki otaczającej miejsce aplikacji, w tym pieczenia, zaczerwienienia, bólu, swędzenia, obrzęku. Natychmiast po aplikacji może wystąpić pieczenie lub swędzenie. Mogą również wystąpić drobne rany, swędzenie i łuszczenie się skóry, z tych powodów zaleca się, aby aplikacja była wykonywana w sposób, który ogranicza kontakt z otaczającą, niezakażoną tkanką
Ani żywica podofilina, ani płyny ani żele podofilotoksyny nie są używane podczas ciąży, ponieważ wykazano, że leki te są embroytoksyczne zarówno u myszy, jak i szczurów. Ponadto w czasie ciąży zazwyczaj nie zaleca się stosowania leków przeciwmitotycznych. Ponadto nie ustalono, czy podofilotoksyna może przenikać do mleka matki po zastosowaniu miejscowym, dlatego nie jest zalecana dla kobiet karmiących piersią .
Krem z podofilotoksyną jest bezpieczny do stosowania miejscowego; jednak może powodować depresję ośrodkowego układu nerwowego, a także zapalenie jelit w przypadku spożycia . Żywicę podophyllum , z którego pochodzi podofilotoksyny ma taki sam skutek.
Mechanizm akcji
Podofilotoksyna destabilizuje mikrotubule, wiążąc tubulinę i zapobiegając w ten sposób podziałowi komórek. W przeciwieństwie do tego, niektóre z jego pochodnych wykazują aktywność wiązania z enzymem topoizomerazą II (Topo II) w późnym stadium S i wczesnym G2. Na przykład etopozyd wiąże i stabilizuje tymczasowe pęknięcie DNA spowodowane przez enzym, zakłóca naprawę pęknięcia, przez które przechodzi dwuniciowy DNA , a w konsekwencji zatrzymuje rozwijanie i replikację DNA. Mutanty oporne na podofilotoksynę lub jej pochodne hamujące topoizomerazę II, takie jak etopozyd (VP-16), zostały opisane w komórkach chomika chińskiego. Wzajemnie wykluczające się wzorce oporności krzyżowej tych mutantów zapewniają wysoce specyficzny sposób rozróżnienia dwóch rodzajów pochodnych podofilotoksyny. Zmutowane komórki chomika chińskiego oporne na podofilotoksynę są dotknięte białkiem P1, które później zidentyfikowano jako ssacze HSP60 lub białko opiekuńcze . Ponadto podofilotoksyna jest klasyfikowana jako lignan arytetraliny ze względu na jej zdolność do wiązania i dezaktywacji DNA. To i jego pochodne wiążą Topo II i zapobiegają jego zdolności do katalizowania ponownego łączenia DNA, które zostało uszkodzone w celu replikacji. Wreszcie dowody eksperymentalne wykazały, że te lignany arytetraliny mogą wchodzić w interakcje z czynnikami komórkowymi, tworząc chemiczne addukty DNA , a tym samym dalej dezaktywując DNA.
Chemia
Charakterystyka strukturalna
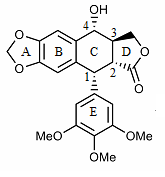
Struktura podofilotoksyny została po raz pierwszy wyjaśniona w latach 30. XX wieku. Podofilotoksyna zawiera cztery kolejne centra chiralne, oznaczone na poniższym obrazku od C-1 do C-4. Cząsteczka zawiera również cztery prawie płaskie skondensowane pierścienie. Cząsteczka podofilotoksyny zawiera wiele grup funkcyjnych zawierających tlen: alkohol , lakton , trzy grupy metoksy i acetal .
Pochodne podofilotoksyny są syntetyzowane, ponieważ właściwości pierścieni i węgla od 1 do 4 są zróżnicowane. Na przykład pierścień A nie jest niezbędny do działania antymitotycznego. Aromatyzacja pierścienia C prowadzi do utraty aktywności, prawdopodobnie ze względu na to, że pierścień E nie jest już umieszczany w pozycji osiowej. Ponadto stereochemia na C-2 i C-3 konfiguruje trans-lakton, który ma większą aktywność niż odpowiednik cis. Chiralność w C-1 jest również ważna, ponieważ implikuje osiową pozycję pierścienia E.
Biosynteza
Droga biosyntezy podofilotoksyny nie została całkowicie wyjaśniona przez wiele lat; jednak we wrześniu 2015 po raz pierwszy zgłoszono tożsamość sześciu brakujących enzymów w biosyntezie podofilotoksyny. Kilka wcześniejszych badań sugerowało wspólny szlak, rozpoczynający się od konwersji alkoholu koniferylowego do (+)-pinorezinolu w obecności jednoelektronowego utleniacza poprzez dimeryzację stereospecyficznego rodnika pośredniego. Pinorezinol jest następnie redukowany w obecności kofaktora NADPH do najpierw larycyrezynolu, a ostatecznie do sekoizolarycyrezynolu. Laktonizacja sekoizolarycyrezynolu prowadzi do powstania matairezinolu. Zakłada się, że sekoizolarycyrezinol jest przekształcany w jateinę poprzez odpowiednie związki pośrednie chinometanowe, co prowadzi do podofilotoksyny.
Stwierdzono, że sekwencja zaangażowanych enzymów jest białkiem dyrygentnym (DIR) przekształcającym alkohol koniferylowy w (+)- pinokrezol , który jest przekształcany przez reduktazę pinokrezolowo-larycyrezynolową (PLR) w (-)- sekoizolarycyrezynol , który jest przekształcany przez sericoizolarycyrezynol dehydrogenaza (SDH) do (-)- matairezinolu , który jest przekształcany przez CYP719A23 do (-)- pluwiatolidu , który jest prawdopodobnie przekształcany przez Phex13114 ( OMT1 ) do (-)- yateiny , która jest przekształcana przez Phex30848 ( 2-ODD ) do (-)- deoksypodofilotoksyna . Chociaż nie przechodzi się przez ostatni etap wytwarzania samej podofilotoksyny, połączenie sześciu genów z jabłoni umożliwiło produkcję aglikonu etopozydu w roślinach tytoniu .
Synteza chemiczna
Podofilotoksyna została z powodzeniem zsyntetyzowana w laboratorium; jednak mechanizmy syntezy wymagają wielu etapów, co skutkuje niską ogólną wydajnością. Dlatego też pozyskiwanie podofilotoksyny z naturalnych źródeł pozostaje bardziej wydajne.
Cztery tras są stosowane do syntezy podofilotoksyny z różnym powodzeniem: okso estru trasy, laktonizację kwasu dihydroksylowe cyklizacji koniugatu produkt addycji i Dielsa-Aldera reakcji.
Naturalna obfitość
Podofilotoksyna jest obecny w stężeniu od 0,3% do 1,0% masy w kłącza z amerykańskiego mayapple ( Podophyllum Peltatum ). Innym powszechnym źródłem jest kłącze Sinopodophyllum hexandrum Royle ( Berberidaceae ).
Jest biosyntetyzowany z dwóch cząsteczek alkoholu koniferylowego przez fenolowe sprzęganie oksydacyjne oraz serię oksydacji , redukcji i metylacji .
Bibliografia
Dalsza lektura
- Kelly M, Hartwell JL (luty 1954). „Skutki biologiczne i skład chemiczny podofiliny: przegląd”. Dziennik Narodowego Instytutu Raka . 14 (4): 967–1010. PMID 13233838 .
- Hartwell JL, Schrecker AW (1951). „Składniki podofiliny V. Konstytucja podofilotoksyny”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 73 (6): 2909–2916. doi : 10.1021/ja01150a143 .