Kinaza związana ze ścianą - Wall-associated kinase
| Kinaza związana ze ścianą | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 WAKs i pektyny w ścianie komórkowej
| |||||||||
| Identyfikatory | |||||||||
| Symbol | WAK | ||||||||
| Pfam | PF08488 | ||||||||
| InterPro | IPR013695 | ||||||||
| Membrana | 725 | ||||||||
| |||||||||
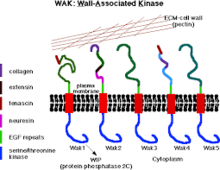
Kinazy związane ze ścianą (WAK) są jedną z wielu klas białek roślinnych, o których wiadomo, że służą jako medium między macierzą zewnątrzkomórkową (ECM) a cytoplazmą ścian komórkowych . Są to kinazy serynowo-treoninowe, które zawierają powtórzenia naskórkowego czynnika wzrostu (EGF) , kinazę cytoplazmatyczną i są zlokalizowane w ścianach komórkowych. Zapewniają połączenie między wewnętrznym i zewnętrznym otoczeniem ścian komórkowych. WAK należą do grupy kinaz podobnych do receptorów (RLK), które są aktywnie zaangażowane w szlaki czuciowe i sygnałowe, zwłaszcza w odpowiedzi na obce ataki patogenów oraz w rozwój komórek. Z drugiej strony, pektyny są obfitą grupą węglowodanów złożonych obecnych w pierwotnej ścianie komórkowej, które odgrywają rolę we wzroście i rozwoju komórek, ochronie, strukturze roślin i zdolności zatrzymywania wody.
Kinazy związane ze ścianą komórkową są kinazami białkowymi podobnymi do receptorów , występującymi w ścianach komórek roślinnych , które mają zdolność do przekazywania sygnałów bezpośrednio przez swoje domeny kinazy cytoplazmatycznej. Zwykle łączą błonę plazmatyczną z białkiem i węglowodanem, z których składa się ściana komórkowa. Białka podobne do receptorów zawierają cytoplazmatyczną kinazę serynowo-treoninową i mniej konserwowany region; związany ze ścianą komórkową i zawiera szereg powtórzeń naskórkowego czynnika wzrostu . WAK można znaleźć w różnych roślinach i uprawach, takich jak ryż i kukurydza. W genomie roślin, takich jak Arabidopsis , WAK są kodowane przez pięć bardzo podobnych genów zgrupowanych w locus o wielkości 30 kb, wśród nich WAK1 i WAK2 są silnie rozmieszczone. Są one przede wszystkim zaangażowane w regulację funkcji ścian komórkowych roślin, w tym ekspansję komórek, wiązanie i odpowiedź na pektyny , odpowiedź na patogeny, a także chronią rośliny przed szkodliwymi skutkami.
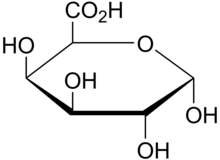
Pektyny są bogate w kwasy galakturonowe (OG) i występują w środkowych blaszkach tkanek roślinnych, gdzie zapewniają siłę, elastyczność i adhezję między komórkami roślinnymi. W handlu iw przemyśle spożywczym są używane jako żele i stabilizatory do deserów i soków. Rola WAK w ścianach komórkowych jako receptorów pektynowych ma kluczowe znaczenie dla różnych funkcji związanych z różnicowaniem komórek, formą i relacjami gospodarz-patogen.
Historia
Powiązanie WAK ze ścianą komórkową roślin zostało po raz pierwszy naruszone przez technikę immunolokalizacji z użyciem surowicy odpornościowej, w której epitom WAK jest ściśle związany z fragmentami ściany komórkowej, tak że nie można ich oddzielić za pomocą detergentu, jednak WAK mogą być uwalniane przez gotowanie ściany z SDS , ditiotreitolem (silnym reduktorem tiolowym), enzymami protopującymi lub pektynazą.
Gen
Białko WAKs złożone z pięciu typów wysoce podobnych genów zlokalizowanych ciasno w 30 kb klastrach genomu Arabidopsis . Większość WAK jest wyrażana w całej roślinie, niezależnie od tego, czy WAK1, 2, 3 i 5 są wyrażane w zielonych organach, WAK1 i 2 są słabo wyrażane w kwiatach i łuszczynach, a WAK2 również w korzeniach, jednakże WAK4 jest wyrażany tylko w łuszczynach. Istnieje również 21 genów podobnych do WAK w genomie Arabitopsis, znanych jako WAKL, które mają niewielkie podobieństwo sekwencji do WAK.
Geny Ara WAK i WAKL są rozmieszczone we wszystkich pięciu chromosomach Arabidopsis
| Numer chromosomu | Zlokalizowane geny |
|---|---|
| ja | WAKL1-13, WAKL22, WAK1-5 |
| II | WAKL14 |
| III | WAKL14 |
| III | WAKL15, WAKL16 |
| IV | WAKL17, WAKL18, WAKL19 |
| V | WAKL20, WAKL21 |
Członkowie rodziny genów WAK/WAKL u Arabidopsis zostali podzieleni na cztery grupy na podstawie porównań parami ich przewidywanych sekwencji białkowych. WAK1 do WAK5 zawierające domenę EGF-Ca 2+ z zachodzącym na siebie miejscem hydroksylacji Asp/Asn i domeną EGF-2 umieszczono w grupie I. Przewidywano, że obie domeny EGF są całkowicie kodowane przez drugi egzon. Siedmiu członków WAKL obejmujących WAKL1 do WAKL6 i WAKL22 zostało umieszczonych w grupie II. We wszystkich tych genach grupy II domeny EGF-Ca 2+ i EGF-2 są oddzielone krótką przerwą 15-18 aminokwasów i zostały odwrócone w kolejności względem grupy I. Domena EGF-Ca 2+ jest kodowana przez pierwszy egzon i domena EGF-Ca 2+ są kodowane przez drugi egzon. Nie przewidywano miejsca hydroksylacji Asn/asp.
Grupa III składa się z sześciu członków: WAKL9, WAKL10, WAKL11, WAKL13, WAKL17 i WAKL18. Wszystkie odpowiadające im białka zawierają domeny EGF-Ca 2+ i EGF2 i są strukturalnie podobne do WAKL z grupy II. W WAKL13 domena EGF-Ca 2+ jest zdegenerowana. Z wyjątkiem WAKL17, wszystkie mają zdegenerowane domeny EGF2.
Grupa IV składa się z czterech członków: WAKL14, WAKL15, WAKL20 i WAKL21. Każdy ma domenę EGF2 zakodowaną przez pierwszy egzon. Ta domena jest zdegenerowana zarówno w WAKL20, jak i WAKL21. Wszystkim czterem członkom brakuje domeny EGF-Ca 2+ . Ponadto każda z nich ma domenę wiążącą cytoplazmatyczną kinazę białkową ATP (PS00107). Przewiduje się, że pozostałe sekwencje (WAKL7, WAKL8, WAKL12, WAKL16 i WAKL19) kodują skrócone białka WAKL. WAKL7, WAKL8 i WAKL19 są podobne do różnych innych WAKL w ich regionach zewnątrzkomórkowych i nie mają domeny transbłonowej. WAKL8 i WAKL9 zawierają domenę EGF-Ca2 +, a WAKL19 zawiera zdegenerowaną domenę EGF2. Żadna z tych domen nie występuje w WAKL7. WAKL12 zawiera również domenę EGF-Ca 2+ , ale w przeciwieństwie do WAKL8 zawiera domenę transbłonową. WAKL16 zawiera domenę transbłonową, domenę STK, która jest najbardziej podobna do WAK3, oraz krótką zewnątrzkomórkową domenę złożoną z ośmiu aminokwasów, w której brakuje obu domen podobnych do EGF.
Rodziny
Kinazy związane ze ścianą (WAK) są podrodziną kinaz receptoropodobnych (RLK) związanych ze ścianą komórkową. Zostały one opisane u Arabidopsis thaliana jako klaster pięciu (WAK1-5) i 22 (WAKL1-WAKL22) genów.
Rodzina genów WAK/WAKL (OsWAK) w ryżu
- OsWAK-RLKs (kinazy receptoropodobne)- zawierają zarówno zewnątrzkomórkowe domeny podobne do EGF, jak i wewnątrzkomórkową domenę kinazy
- OsWAK-RLCK (receptorowe kinazy cytoplazmatyczne) – zawierają tylko domenę kinazy
- OsWAK-RLPs (białka podobne do receptorów) - Zawierają tylko zewnątrzkomórkowe domeny podobne do EGF
- Krótkie geny OsWAK – brak obu domen, ale > 40% identyczności na poziomie aminokwasów z innymi członkami OsWAK
- pseudogeny (z kodonami stop lub przesunięciami ramek w regionie kodującym)
Struktura
Wszystkie pięć białek WAK ma wysoce konserwatywną domenę kinazy białkowej serynowo/treoninowej (86% podobieństwa) po stronie cytoplazmatycznej i domenę zewnątrzkomórkową (tylko 40% do 64% podobieństwa w sekwencjach aminokwasowych). Ponadto, wszystkie izomery białek WAK posiadają powtórzenia typu epidermalnego czynnika wzrostu (EGF) zlokalizowane po stronie aminowej. Sześć cystein (zlokalizowanych w powtórzeniach EGF) jest dobrze utrzymanych we wszystkich pięciu WAK, jednak interakcje białko-białko WAK są nadal nieznane.
Wszystkie WAK (WAKs 1-5) mają miejsce hydroksylacji Asp/Asn (Cx[DN]x(4)[FY]xCxC; Prosite PS00010) nakładające się z domenami EGF wiążącymi wapń, gdzie zarówno hydroksylowane, jak i niehydroksylowane formy proteaz krzepnięcia mają równe powinowactwo do wapń w stężeniach fizjologicznych. Grupa hydroksylowa może być zaangażowana w tworzenie wiązań wodorowych w oddziaływaniach białko-białko, w których pośredniczy domena podobna do EGF.
Związek WAK ze ścianą komórkową jest bardzo silny (mając połączenie kowalencyjne z pektyną), tak że jego uwolnienie ze ściany komórkowej wymaga trawienia enzymatycznego. W warunkach, które załamują turgor komórki roślinnej, aby oddzielić błonę od ściany (plazmoliza), asocjacja WAK-ściana jest tak silna, że pozostają one w ścianie komórkowej. W Arabidopsis występuje pięć izoform WAK ze zmienną domeną zewnątrzkomórkową w obrębie tych izoform, z których wszystkie zawierają co najmniej dwa naskórkowe czynniki wzrostu (EGF). Spośród wszystkich tych izoform, WAK1 i WAK2 są najbardziej wszechobecne, a ich informacyjny RNA (mRNA) i białka są obecne w merystemie wegetatywnym i obszarach ekspansji komórek.
Interakcja
WAK1 jest usieciowany w błonach wewnętrznych , a jego transport na powierzchnię komórki wymaga prawidłowej syntezy ściany komórkowej. Oddziaływanie między WAK1 a pektynami (Pektyny są złożonymi oligopolisacharydami tworzącymi hydrofilową żelowatą matrycę między mikrofibrylami celulozy i mogą być skoncentrowane w różnych regionach ściany komórkowej) potwierdzono przy użyciu przeciwciał anty-WAK1 i antypektynowych JIM5 i JIM7 rozpoznał ten sam prążek białkowy 68 kDa w Western blot białek ściany komórkowej wyekstrahowanych ze ścian komórkowych traktowanych pektynazą. Ta hybryda kinazy pektynowej zlokalizowana w celu przekazywania do cytoplazmy ściany komórkowej, gdzie WAK1 jest związany w konformacji indukowanej wapniem z kwasem poligalakturonowym, oligogalakturonidami i pektynami i temu oddziaływaniu zapobiegano przez estryfikację metylu, chelatory wapnia i depolimeryzację pektyn. Oddziaływanie polianionu pektynowego ze ścianą komórkową lub osoczem może wywoływać zmiany konformacyjne w polimerach pektynowych, które wpływają na ich żelowanie i pęcznienie w obecności wapnia, a wiązanie pektyn z WAK1 w obecności wapnia może powodować zaburzenia muro sieć pektyn, która może generować sygnały w ścianie komórkowej.
Funkcjonować
Kinazy związane ze ścianą (WAK) pełnią kilka funkcji (podział lub wzrost komórki), podobnie jak inne receptory roślinne, takie jak czujniki ściany komórkowej, jednak unikalną cechą jest bezpośrednie wiązanie się z pektyną, która postuluje zależną od WAK ścieżkę sygnalizacyjną regulującą ekspansję komórek. Przyczyniają się również do odpowiedzi na patogeny i stres, tolerancji metali ciężkich i rozwoju roślin.
WAK mogą przyczyniać się do wydłużania komórki, ponieważ mają aktywną domenę cytoplazmatycznej kinazy białkowej, która obejmuje błonę plazmatyczną i zawierają N-koniec, który wiąże ścianę komórkową, niezależnie od tego, czy WAK2 może regulować inwertazę na poziomie transkrypcyjnym . WAK mogą również regulować ekspansję komórek poprzez kontrolę stężenia cukru, a tym samym kontrolę turgoru, gdzie fenotyp wak2-1 może być uratowany przez ekspresję syntazy fosforanu sacharozy, która zmienia pochłaniacze cukru. Jednak antysensowny WAK RNA może być indukowany przy użyciu systemu Dex , który przyczynia się do 50% zmniejszenia poziomu białka WAK, jak również do mniejszego rozmiaru komórek, a nie do mniejszej liczby komórek. Wak2-1 ( WAK2 zerowy allel) powoduje utratę namnażania komórek w korzeniach, ale tylko w ograniczeniu warunków, cukier i sól jednak ubytku alleli funkcyjne w każdym z pozostałych czterech Waks nie skutkuje oczywistą fenotypu. Kohorn i wsp. (2006a) zasugerowali, że WAK mogą być usieciowane z materiałem ściany komórkowej, jednak łączenie i sieciowanie WAK rozpoczyna się na wczesnym etapie w kompartmencie cytoplazmatycznym, a nie w samej ścianie komórkowej, a także jest skoordynowane z syntezą powierzchniowej celulozy. WAK są uwalniane z pektynazy materiału ściany komórkowej, gdzie są związane z pektynami. Dlatego wiązania WAK1 lub 2 z pektyną mają wyższe powinowactwo do deestryfikowanej pektyny niż do estryfikowanych cząsteczek. Ponadto krótkie fragmenty pektyn o stopniu polimeryzacji (dp) 9–15 skutecznie konkurowały z dłuższymi pektynami o wiązanie WAK. Zarówno WAK1, jak i WAK 2 wiążą się z różnymi pektynami, w tym z polimerami homogalakturonanu (HA), OG i ramnogalakturonanem (RG) I i II. Wymagania wiązania nie dotyczą prostego polimeru HA, ale być może obecności kwasu galakturonowego. Aktywność biologiczna fragmentów pektyn, czyli OG, przyczynia się do odpowiedzi obronnych i stresowych oraz w procesach rozwojowych, w których WAK pełnią funkcję receptora.
Kinazy związane ze ścianą biorą udział w odpowiedziach na patogen i stres.
Ścieżka transdukcji sygnału
Kohorn (2016) zasugerował, że „polimery pektynowe mogą być usieciowane w ścianie komórkowej za pomocą Ca + , a WAKs wiążą te pektyny i sygnalizują poprzez aktywację inwertazy wakuolowej i wielu innych indukowanych białek, aby pomóc w ekspansji komórek. Stan estryfikacji metylu pektyny jest modulowana przez metyloesterazy pektynowe (PME), a WAKs wiążą demetylowaną pektynę z wyższym powinowactwem.Pektyna jest fragmentowana przez zdarzenia biotyczne i abiotyczne, a oligogalakturonidy (OG) mają wyższe powinowactwo do WAKs i wywołują stres odpowiedź".
WAKs wiążą pektyny
Kinazy związane ze ścianą są receptorami z sieciowaniem za pośrednictwem wapnia ze ścianą komórkową roślin. Przewiduje się, że obecność szkieletu kwasu galakturonowego w różnych typach pektyn jest istotną cechą wiązania się z WAK, ponieważ WAK1 i WAK2 wiążą się z różnymi pektynami, w tym z polimerami homogalakturonu (HA), najliczniejszej pektyny w ścianach komórkowych; kwasy oligogalakturonowe (OG) oraz ramnogalakturonany (RG) I i II. Wiązanie in vitro pomiędzy WAK i pektyną jest ułatwione przez naładowane grupy tlenowe na czystych fragmentach pektyn i naładowane reszty na ECM WAKs.
Pektynaza , enzym odpowiedzialny za degradację pektyny obecnej w ścianie komórkowej, uwalnia WAK, co stało się główną sugestią, że WAK są związane z pektyną w ścianie komórkowej. Dodatkowo ta hipoteza sugerowała wiązanie kowalencyjne między pektyną i WAK, ponieważ są one nadal połączone ze sobą po ekspozycji na detergent Sodium Dodecyl Sulfate (detergent) i Ditiotreitol (DTT) oraz w żelach akrylamidowych . Metyloesterazy pektynowe (PME) usuwają grupy metylowe powstające z enzymu, który polimeryzuje pektyny (zestryfikowany metylem polimer kwasu α-(1-4) D-galakturonowego) dając deestryfikowany polimer pektyn. WAKs łatwiej wiążą się z deestryfikowanymi pektynami ze względu na ich bardziej ujemny ładunek. Ta sugestia, że ładunek jest odpowiedzialny za korzystne wiązanie WAK z deestryfikowanymi pektynami (naładowanymi ujemnie) została wykazana w mutacji reszt kationowych w genie WAK1 na reszty obojętne, co spowodowało utratę właściwości wiązania do deestryfikowanych pektyn .
Ta rola ładunku w wiązaniu jest dalej udowadniana przez podstawienie reszt argininy na glutaminę i lizyny na treoniny w ECM, które wykazują zmniejszone wiązanie z deestryfikowaną pektyną. Deestryfikacja pektyn jest zatem potrzebą aktywacji WAKs.
Oddziaływania molekularne WAKs i pektyn
Model
Wiązanie się WAK z pektynami wyzwala działanie kilku szlaków. Fragmentacja pektyn (kwasu oligogalakturonowego) podczas zranienia lub ataku patogennego powoduje odpowiedź roślin na stres, a WAKs odgrywają rolę w pośredniczeniu w tej odpowiedzi. Ponieważ jednak WAK są również wymagane do wzrostu komórek poprzez wiązanie się z długimi polimerami pektynowymi do rozwoju roślin, a także z fragmentami pektyn do odpowiedzi na zranienie, nie znaleziono żadnego sposobu na to, jak WAKs różnicują te dwa rodzaje pektyn, aby zainicjować wydłużanie komórek lub ochronę . Zaproponowano jednak model, aby wykazać preferencję WAK dla deestryfikowanych pektyn i możliwe wyjaśnienie inicjacji odpowiedzi patogenu, a nie odpowiedzi wzrostu.
Wykazano, że dominujący allel WAKs, który wymaga domeny wiążącej pektyny i aktywności kinazy, indukuje odpowiedź na stres, jednak allel ten został stłumiony zerowym allelem metyloesterazy pektynowej (pme), co uniemożliwiło usunięcie grup metylowych polimeryzujących pektynę do deestryfikowanego polimeru, w wyniku czego otrzymuje się zestryfikowaną pektynę. Ponieważ WAKs są wiązane luźniej w zestryfikowanych pektynach, więcej było obecnych, aby wiązać kwasy oligogalakturonowe (w tym mutancie), wywołując w ten sposób raczej odpowiedź patogenu na stres niż odpowiedź wzrostu. Aktywacja szlaku ekspansji komórek zależna od WAK obejmuje aktywację MPK3, podczas gdy odpowiedź patogenu pokazuje aktywację zarówno MPK3, jak i MPK6.
WAK1 i WAK2 są wariantami białkowymi WAKS o największej ekspresji spośród pięciu WAK znanych w Arabidopsis, jednak WAK1 ulega największej ekspresji w układzie naczyniowym, podczas gdy WAK2 jest również wyrażany w połączeniach narządów, strefach odcięcia i merystemach.
WAK1: odpowiedź patogenu
Droga patogenu do infekcji zaczyna się od ściany komórkowej; białka łączące ścianę komórkową z błoną plazmatyczną są początkowymi mediatorami w odpowiedzi patogenu. WAK1 jest indukowany w patogennej odpowiedzi rośliny wraz z innymi białkami związanymi z patogenami, które pełnią funkcję ochronną. Wak1 jest obecny w tkance roślinnej Arabidopsis, przy czym ekspresja mRNA WAK1 jest bardziej obfita w łodydze rośliny, liściach niż w korzeniach, a jego domena zewnątrzkomórkowa zawiera powtórzenia wzrostu naskórka, co ułatwia sygnalizację komórkową. Ciepło i sól nie mają wpływu na produkcję WAK1 w tkankach, jednak zranienie jest znaczące, ponieważ powoduje ekspresję komunikatu WAK1 przez kwas 2,2-dichloroizonikotynowy (INA), naturalny salicylan (SA) w szlaku transdukcji sygnału w odpowiedź roślin na infekcję. Ponieważ WAK1 ma kluczowe znaczenie dla przetrwania rośliny w odpowiedzi na patogeny, jednocześnie nadaje odporność na SA do punktu, w którym roślina może przetrwać ekspozycję na wysokie poziomy SA. Zwiększoną oporność na SA poprzez ekspresję WAK1 można nadać jedynie przez ekspresję ektopową całej domeny białka lub kinazy WAK1. To ostatecznie oznacza, że indukowanie ekspresji WAK1 powoduje obniżone poziomy SA i zmniejszoną toksyczność, a zatem ochronę, wykazując rolę WAK1 w regulowaniu ataków patogennych.
WAK2: ekspresja pektyn i genów
Pektyna wpływa na ekspresję genów zależnych od WAK2, takich jak te zaangażowane w integralność ściany komórkowej i odpowiedź zewnętrzną; Sugeruje się, że WAK2 jest ważny w zdarzeniach komórkowych i ekspresji genów w mezofilu Arabidopsis. Ekspresja genów przy użyciu macierzy ekspresyjnych Affymetrix z RNA z protoplastów typu dzikiego lub wak2-1 (mutacja zerowa) leczonych lub nieleczonych pektyną ujawnia wiele rzeczy. W protoplastach typu dzikiego poddanych działaniu pektyny nastąpiła zmiana w ekspresji ponad 200 genów, przy czym prawie 50 z nich to geny zaangażowane w syntezę ściany komórkowej, takie jak esteraza pektynowa, kinaza transbłonowa bogata w leucynę, defensyna roślinna. Pozostałe geny regulowane w dół obejmowały geny zaangażowane w wiele funkcji rośliny; jednakże tylko jeden gen w traktowanym pektyną WAK2-1 ulegał zróżnicowanej ekspresji. W porównaniu z wak2-1, 13 z 50 podwyższonych ekspresji genów w typie dzikim zostało stłumionych w wak2-1, a 37 ulegało ekspresji podobnie do typu dzikiego. 20 genów w obrębie tych obniżonych wykazywało zmniejszoną ekspresję w komórkach wak2-1 , 24 zostały aktywowane, a pozostałe miały poziomy podobne do typu dzikiego.
Wzory te umożliwiły identyfikację genów regulowanych przez WAK2 bez traktowania pektynami, genów niezależnych od WAK2, ale zależnych od odpowiedzi pektynowej WAK2. Ekspresja WAK2 w wak2-1 (mutacja zerowa) wykazała największą redukcję ekspresji, co wskazuje, że gen nie został transkrybowany. WAK1 i WAK2 były podwyższone u osobników dzikich traktowanych pektyną, ale nie zaobserwowano tego w wak2-1. Najwyraźniej WAK2 jest ważnym składnikiem szlaku sygnałowego pektyny, ponieważ brak WAK2 może znacznie zmniejszyć odpowiedź transkrypcyjną na pektynę. Zarówno podwyższone, jak i obniżone geny odpowiedzi na pektyny zależne od WAK2 są związane z czynnikami obronnymi, strukturą ściany komórkowej, czynnikami związanymi z fosforylacją białek lub czynnikami transkrypcyjnymi.
Bibliografia
- ^ Kohorn BD (październik 2001). „WAKs; kinazy związane ze ścianą komórkową”. Aktualna opinia w biologii komórki . 13 (5): 529–33. doi : 10.1016/S0955-0674(00)00247-7 . PMID 11544019 .
- ^ B c Wagner TA Kohorn BD (luty 2001). „Kinazy związane ze ścianą ulegają ekspresji podczas rozwoju rośliny i są wymagane do ekspansji komórek” . Komórka Roślinna . 13 (2): 303–18. doi : 10.1105/tpc.13.2.303 . PMC 102244 . PMID 11226187 .
- ^ Yang K Qi L Zhang Z (2014). „Izolacja i charakterystyka nowego genu kinazy związanej ze ścianą TaWAK5 w pszenicy (Triticum aestivum)” . Dziennik upraw . 2 (5): 255–266. doi : 10.1016/j.cj.2014.04.010 .
- ^ Receptorowe kinazy w roślinach . Sygnalizacja i komunikacja w roślinach. 13 . SpringerLink. 2012. doi : 10.1007/978-3-642-23044-8 . Numer ISBN 978-3-642-23043-1. S2CID 6532313 .
- ^ B c d e Anderson, Catherine M .; Wagner, Tanya A.; Perret, Mireille; On, Zheng-Hui; On, Deze; Kohorn, Bruce D. (2001). „WAK: kinazy związane ze ścianą komórkową łączące cytoplazmę z macierzą pozakomórkową”. Biologia molekularna roślin . 47 (1–2): 197–206. doi : 10.1023/A: 1010691701578 . PMID 11554472 . S2CID 19683854 .
- ^ B c d e f g Kohorn Bruce D. Kohorn, Susan L (2012). „Kinazy związane ze ścianą komórkową, WAK, jako receptory pektynowe” . Granice w naukach o roślinach . 3 : 88. doi : 10.3389/fpls.2012.00088 . PMC 3355716 . PMID 22639672 .
- ^ De Oliveira, Luiz Felipe Valter; Christoff, Ana Paula; De Lima Julio Cezar; De Ross, Bruno Comparsi Feijo; Sachetto-Martins, Gilberto; Margis-Pinheiro, Marcia; Margis, Rogerio (2014). „Rodzina genów Kinazy związanej ze ścianą w genomach ryżu”. Nauka o roślinach . 229 : 181-92. doi : 10.1016/j.plantsci.2014.09.007 . PMID 25443845 .
- ^ Zuo, Weiliang; Chao, Qing; Zhang, Nan; Tak, Jianrongu; Tan, Guoqing; Li, Bailin; Xing, Yuexian; Zhang, Boqi; Liu, Haijun; Fengler, Kevin A; Zhao, Jing; Zhao, Xianrong; Chen, Yongsheng; Lai, Jinsheng; Yan, Jianbing; Xu, Mingliang (2014). „Kinaza związana ze ścianą kukurydzy nadaje ilościową oporność na głowicę”. Genetyka przyrody . 47 (2): 151–7. doi : 10.1038/ng.3170 . PMID 25531751 . S2CID 5535732 .
- ^ B c Wagner Tanya A .; Kohorn, Bruce D. (2001). „Kinazy związane ze ścianą ulegają ekspresji podczas rozwoju rośliny i są wymagane do ekspansji komórek” . Komórka Roślinna . 13 (2): 303–18. doi : 10.1105/tpc.13.2.303 . JSTOR 3871278 . PMC 102244 . PMID 11226187 .
- ^ Kohorn, Bruce D; Kobayashi, Masaru; Johansen, Sue; Riese, Jeff; Huang, Li-Fen; Koch, Karen; Fu, Sarita; Dotson, Anjali; Byers, Nicole (2006). „Kinaza związana ze ścianą komórkową Arabidopsis wymagana do aktywności inwertazy i wzrostu komórek”. Dziennik Roślin . 46 (2): 307-16. doi : 10.1111/j.1365-313X.2006.02695.x . PMID 16623892 .
- ^ Willats WG, McCartney L, Mackie W, Knox JP (2001). Roślinne ściany komórkowe . Springera, Dordrecht. s. 9–27. doi : 10.1007/978-94-010-0668-2_2 . Numer ISBN 9789401038614.
- ^ Decreux A, Messiaen J (luty 2005). „Kinaza związana ze ścianą WAK1 oddziałuje z pektynami ściany komórkowej w konformacji indukowanej wapniem” . Fizjologia roślin i komórek . 46 (2): 268–78. doi : 10.1093/pcp/pci026 . PMID 15769808 .
- ^ a b c He, Zheng-Hui; Fujiki, Masaaki; Kohorn, Bruce D (1996). „Związana ze ścianą komórkową, receptoro-podobna kinaza białkowa” . Czasopismo Chemii Biologicznej . 271 (33): 19789-93. doi : 10.1074/jbc.271.33.19789 . PMID 8702686 .
- ^ a b c d He, Zheng-Hui; Serowarz, Iain; On, Deze; Kohorn, Bruce D (1999). „Grupa pięciu genów kinaz receptorowych związanych ze ścianą komórkową, Wak1-5, ulega ekspresji w określonych narządach Arabidopsis”. Biologia molekularna roślin . 39 (6): 1189–96. doi : 10.1023/A:1006197318246 . PMID 10380805 . S2CID 9362392 .
- ^ B Decreux Annabelle; Messiaen, Johan (2005). „Kinaza związana ze ścianą WAK1 oddziałuje z pektynami ściany komórkowej w konformacji indukowanej wapniem” . Fizjologia roślin i komórek . 46 (2): 268–78. doi : 10.1093/pcp/pci026 . PMID 15769808 .
- ^ B Verica J. A; On, ZH (2002). „Kinaza związana ze ścianą komórkową (WAK) i rodzina genów kinaz podobnych do WAK” . Fizjologia roślin . 129 (2): 455–9. doi : 10.1104/pp.011028 . JSTOR 4280478 . PMC 1540232 . PMID 12068092 .
- ^ B c d e Kanneganti, Vydehi; Gupta, Aditya K (2008). „Kinazy ścienne z roślin — przegląd” . Fizjologia i Biologia Molekularna Roślin . 14 (1–2): 109–18. doi : 10.1007/s12298-008-0010-6 . PMC 3550657 . PMID 23572878 .
- ^ a b c d e f Zhang, S; Chen, C; Li, L; Meng, L; Singha, J; Jiang, N; Deng, XW; On, ZH; Lemaux, PG (2005). „Ewolucyjna ekspansja, struktura genów i ekspresja rodziny genów kinaz związanych ze ścianą ryżu” . Fizjologia roślin . 139 (3): 1107-24. doi : 10.1104/pp.105.069005 . JSTOR 4281942 . PMC 1283751 . PMID 16286450 .
- ^ Sampoli Benitez, Benedetta A; Komives, Elżbieta A (2000). „Plastyczność wiązania dwusiarczkowego w naskórkowym czynniku wzrostu”. Białka: struktura, funkcja i genetyka . 40 (1): 168–74. doi : 10.1002/(SICI)1097-0134(20000701)40:1<168::AID-PROT180>3.0.CO;2-N . PMID 10813841 .
- ^ Sivaguru, M; Ezaki, B; On, ZH; Tong, H; Osawa, H; Bałuska, F; Volkmann, D; Matsumoto, H (2003). „Indukowana glinem ekspresja genów i lokalizacja białek kinazy receptora związanego ze ścianą komórkową w Arabidopsis” . Fizjologia roślin . 132 (4): 2256-66. doi : 10.1104/s.103.022129 . PMC 181309 . PMID 12913180 .
- ^ Stenflo, Johan; Stenberg, Yvonne; Muranyi, Andreas (2000). „Wiążący wapń moduły podobne do EGF w proteinazach krzepnięcia: Funkcja jonu wapnia w oddziaływaniach modułu”. Biochimica et Biophysica Acta (BBA) - Struktura białka i enzymologia molekularna . 1477 (1–2): 51–63. doi : 10.1016/S0167-4838(99)00262-9 . PMID 10708848 .
- ^ B Kohorn Bruce D. Kohorn, Susan L (2012). „Kinazy związane ze ścianą komórkową, WAK, jako receptory pektynowe” . Granice w naukach o roślinach . 3 : 88. doi : 10.3389/fpls.2012.00088 . PMC 3355716 . PMID 22639672 .
- ^ B Kohorn Bruce D .; Kobayashiego, Masaru; Johansen, Sue; Friedman, Henry Perry; Fischera, Andy'ego; Byers, Nicole (2006). „Kinaza związana ze ścianą 1 (WAK1) jest usieciowana w błonach wewnętrznych, a transport na powierzchnię komórki wymaga prawidłowej syntezy ściany komórkowej” . Journal of Cell Science . 119 (11): 2282–90. doi : 10.1242/jcs.02968 . PMID 16723734 .
- ^ Carpita, Mikołaj C; Gibeau, David M (1993). „Modele strukturalne pierwotnych ścian komórkowych roślin kwitnących: Zgodność struktury molekularnej z właściwościami fizycznymi ścian podczas wzrostu” . Dziennik Roślin . 3 (1): 1–30. doi : 10.1111/j.1365-313X.1993.tb00007.x . PMID 8401598 .
- ^ Decreux, A; Tomasz, A; Szpiedzy, B; Biustonosz, R; Cutsem, P; Messiaen, J (2006). „Charakterystyka in vitro domeny wiążącej homogalaktronian kinazy związanej ze ścianą WAK1 przy użyciu ukierunkowanej mutagenezy”. Fitochemia . 67 (11): 1068–79. doi : 10.1016/j.phytochem.2006.03.09 . PMID 16631829 .
- ^ Deeks, Michael J; Hussey, Patrick J; Davies, Brendan (2002). „Formins: pośredniczy w kaskadach przekazywania sygnału, które wpływają na reorganizację cytoszkieletu”. Trendy w nauce o roślinach . 7 (11): 492–8. doi : 10.1016/S1360-1385(02)02341-5 . PMID 12417149 .
- ^ B MacDougall Alistair J; Brett, Gary M; Morris, Wiktor J; Rigby, Neil M; Ridout, Michael J; Pierścień, Stephen G (2001). „Wpływ oddziaływań peptydowo-pektynowych na zachowanie żelowania pektyny ściany komórkowej roślin”. Badania węglowodanów . 335 (2): 115–26. doi : 10.1016/S0008-6215(01)00221-X . PMID 11567642 .
- ^ Wagner, TA; Kohorn, BD (2001). „Kinazy związane ze ścianą ulegają ekspresji podczas rozwoju rośliny i są wymagane do ekspansji komórek” . Komórka Roślinna . 13 (2): 303–318. doi : 10.1105/tpc.13.2.303 . PMC 102244 . PMID 11226187 .
- ^ a b c d Kohorn BD Kobayashi M. Johansen S. Riese J. Huang LF Koch K. Fu S. Dotson A. Byers N. (2006b). Kinaza związana ze ścianą komórkową Arabidopsis wymagana do aktywności inwertazy i wzrostu komórek. Zakład J. 46 307–316
- ^ B Andersena WP Wagner TA Perret M., He He ZH, D., Kohorn BD (2001). WAKs: kinazy związane ze ścianą komórkową łączące cytoplazmę z macierzą pozakomórkową. Roślina Mol. Biol. 47 197–206
- ^ Lally, D.; Ingmire, P.; Tong, HY; On, ZH (2001). „Antysensowna ekspresja kinazy białkowej związanej ze ścianą komórkową, WAK4, hamuje wydłużanie komórek i zmienia morfologię” . Komórka Roślinna . 13 (6): 1317–1331. doi : 10.2307/3871298 . JSTOR 3871298 . PMC 135583 . PMID 11402163 .
- ^ B Kohorn BD (2001). „WAKs; kinazy związane ze ścianą komórkową”. Aktualn. Opinia. Biol komórki . 13 (5): 529–533. doi : 10.1016/s0955-0674(00)00247-7 . PMID 11544019 .
- ^ B c Kohorn BD, Johansen Shishido S, A, T, Martinez TODOROVA R, Defeo E Obregon P (grudzień 2009). „Aktywacja pektyn kinazy MAP i ekspresja genów jest zależna od WAK2” . Roślina J . 60 (6): 974–82. doi : 10.1111/j.1365-313X.2009.04016.x . PMC 3575133 . PMID 19737363 .
- ^ Yamazaki, N.; narybek, SC; Darvilla AG; Albersheim, P. (1983). „Interakcje gospodarz-patogen: XXIV. Fragmenty wyizolowane ze ścian komórkowych jawora hodowanych w zawiesinie hamują zdolność komórek do włączania [C]leucyny do białek” . Fizjol roślin . 72 (3): 864-869. doi : 10.1104/pp.72.3.864 . PMC 1066335 . PMID 16663100 .
- ^ Willats WG, McCartney L, Mackie W, Knox JP (wrzesień 2001). „Pektyna: biologia komórki i perspektywy analizy funkcjonalnej”. Roślina Mol. Biol . 47 (1–2): 9–27. doi : 10.1023/A:1010662911148 . PMID 11554482 . S2CID 13011973 .
- ^ Mohnen D (czerwiec 2008). „Struktura i biosynteza pektyn”. Aktualn. Opinia. Biol roślinny . 11 (3): 266–77. doi : 10.1016/j.pbi.2008.03.006 . PMID 18486536 .
- ^ Harholt J, Suttangkakul A, Vibe Scheller H (czerwiec 2010). „Biosynteza pektyny” . Fizjol roślin . 153 (2): 384–95. doi : 10.1104/pp.110.156588 . PMC 2879803 . PMID 20427466 .
- ^ Kohorn, Bruce D (2016). „Kinazy związane ze ścianą komórkową i percepcja pektyn” . Dziennik Botaniki Eksperymentalnej . 67 (2): 489–94. doi : 10.1093/jxb/erv467 . PMID 26507892 .
- ^ B c d Kohorn BD (07.08.2015). „Stan pektyny ściany komórkowej monitorowanej przez kinazy związane ze ścianą: model” . Sygnalizacja i zachowanie roślin . 10 (7): e1035854. doi : 10.1080/15592324.2015.1035854 . PMC 4622591 . PMID 26251881 .
- ^ B Kohorn BD (styczeń 2016). „Kinazy związane ze ścianą komórkową i percepcja pektyn” . Dziennik Botaniki Eksperymentalnej . 67 (2): 489–94. doi : 10.1093/jxb/erv467 . PMID 26507892 .
- ^ Voragen, Alphons GJ; Coenen, Gerd-Jan; Verhoef, René P.; Schols, Henk A. (2009-04-01). „Pektyna, wszechstronny polisacharyd obecny w ścianach komórkowych roślin” . Chemia strukturalna . 20 (2): 263. doi : 10.1007/s11224-009-9442-z .
- ^ B c Kohorn BD Kohorn SL (2012). „Kinazy związane ze ścianą komórkową, WAK, jako receptory pektynowe” . Granice w naukach o roślinach . 3 : 88. doi : 10.3389/fpls.2012.00088 . PMC 3355716 . PMID 22639672 .
- ^ B c d e f Kohorn BD, Johansen Shishido S, A, T, Martinez TODOROVA R, Defeo E Obregon P (grudzień 2009). „Aktywacja pektyn kinazy MAP i ekspresja genów jest zależna od WAK2” . Dziennik Roślin . 60 (6): 974–82. doi : 10.1111/j.1365-313x.2009.04016.x . PMC 3575133 . PMID 19737363 .
- ^ Kohorn BD (styczeń 2016). „Kinazy związane ze ścianą komórkową i percepcja pektyn” . Dziennik Botaniki Eksperymentalnej . 67 (2): 489–94. doi : 10.1093/jxb/erv467 . PMID 26507892 .
- ^ B on Z, który D Kohorn BD (01.04.1998). „Wymaganie indukowanej ekspresji kinazy receptorowej związanej ze ścianą komórkową dla przeżycia podczas odpowiedzi patogenu” . Dziennik Roślin . 14 (1): 55-63. doi : 10.1046/j.1365-313x.1998.00092.x . PMID 9681026 .