Aldehyd cynkowy - Zincke aldehyde
Aldehydy cynkowe , czyli 5-aminopenta-2,4-dienale , są produktem reakcji soli pirydyniowej z dwoma równoważnikami dowolnej aminy drugorzędowej, po której następuje hydroliza zasadowa. Stosując aminy drugorzędowe (w przeciwieństwie do amin pierwszorzędowych) reakcja Zinckego przybiera inny kształt, tworząc aldehydy Zinckego, w których pierścień pirydynowy jest otwarty z końcową grupą iminową hydrolizowaną do aldehydu . Zastosowanie grupy dinitrofenylowej do aktywacji pirydyny po raz pierwszy opisał Theodor Zincke . Zastosowanie bromku cyjanu do aktywacji pirydyny zostało niezależnie opisane przez W.Königa:
Dokonano przeglądu syntezy i użyteczności aldehydów Zinckego.
W syntezie nowych indoli zastosowano odmianę reakcji Zinckego :
z aktywacją pirydyny za pośrednictwem bromku cyjanu (metoda Königa).
Ostatnio, ciekawym przegrupowanie aldehydów Zincke do Z -nienasycone amidy, odkryto nieoczekiwanie, gdy próbuje wykonać wewnątrzcząsteczkowej reakcji Dielsa-Aldera . Przegrupowanie daje produkt Z stereospecyficznie. W dalszej pracy zastosowano aminy allilowe, które dały produkty przegrupowania / wewnątrzcząsteczkowej kaskady Dielsa-Aldera . Omówiono również szczegóły mechanistyczne, jednak dalsze badania we współpracy z grupą Houk ujawniły niezwykły i nieoczekiwany mechanizm oparty na badaniach obliczeniowych. Nowy mechanizm obejmuje tworzenie winyloketenu .
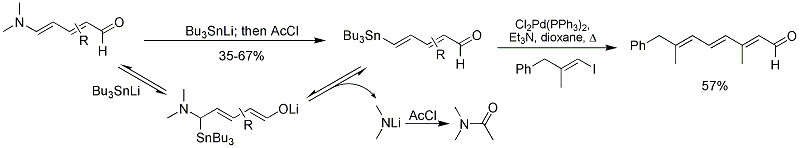
Grupa Vanderwala donosiła również o syntezie 4-stannyldienali z aldehydów Zinckego przez dodanie anionu tributylostannylowego i wygaszenie chlorkiem acetylu. Produkty są użytecznymi substratami w reakcjach sprzęgania krzyżowego Stille'a w celu uzyskania interesujących struktur polienowych.
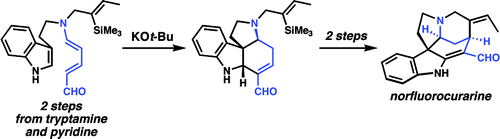
W 2009 roku grupa Vanderwal poinformowała o kolejnej interesującej rearanżacji aldehydów Zinckego. Aldehydy cynkowe pochodzące z tryptaminy są podgrzewane mocną zasadą w celu uzyskania przegrupowanego enalu, jak pokazano poniżej. Ta reakcja była kluczowym etapem ich całkowitej syntezy norfluorokuraryny, alkaloidu Strychnos . Strategia ta została również zastosowana w krótkiej syntezie strychniny , stając się najkrótszą syntezą strychniny opisaną do tej pory w zaledwie sześciu liniowych krokach. Ta praca została wyróżniona na blogu Totally Synthetic .
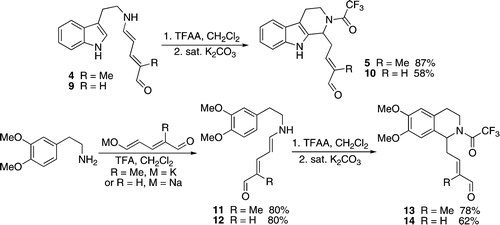
Również w 2009 roku od grupy Christiana Marazano pojawiły się pierwsze doniesienia o aldehydach Zinckego poddawanych reakcji Picteta -Spenglera . Ta reakcja dostarczyła rdzenia tetrahydro- β- karboliny lub tetrahydroizochinoliny obecnego w wielu naturalnych produktach alkaloidowych i zastosowano go do konstrukcji znanego związku pośredniego we wcześniejszej syntezie całkowitej.
Jedną z wad syntezy aldehydu Zinckego jest potrzeba 2 równoważników aminy w początkowej reakcji otwarcia pierścienia pirydynowego. Ma to szczególne znaczenie w przypadku złożonych amin drugorzędowych potrzebnych do syntezy produktów naturalnych. Grupa Marazano niedawno odkryła alternatywną syntezę przez kondensację różnych pochodnych aldehydu glutakonowego przy użyciu TFA. To rozwiązanie znacznie uprościło produkcję i oczyszczanie złożonych aldehydów cynkowych.