ATOX1 - ATOX1
ATOX1 jest miedź metallochaperone białko , które jest kodowane przez ATOX1 genu u ludzi. U ssaków ATOX1 odgrywa kluczową rolę w homeostazie miedzi, ponieważ dostarcza miedź z cytozolu do transporterów ATP7A i ATP7B . Homologiczne białka znajdują się u wielu różnych eukariontów , w tym Saccharomyces cerevisiae jako ATX1 i wszystkie zawierają konserwatywną domenę wiążącą metal.
Funkcjonować
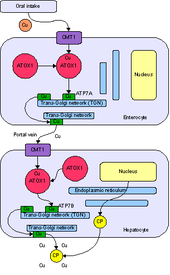
ATOX1 to skrót od pełnej nazwy Antioxidant Protein 1. Nomenklatura wywodzi się z początkowej charakterystyki, która wykazała, że ATOX1 chroni komórki przed reaktywnymi formami tlenu. Od tego czasu ustalono podstawową rolę ATOX1 jako białka metalochaperonu miedzi znajdującego się w cytoplazmie eukariontów. Metalochaperon jest ważnym białkiem, które pełni rolę w transporcie metali i sekwestracji. Jako białko sekwestrujące metal ATOX1 jest zdolny do wiązania wolnych metali in vivo , w celu ochrony komórek przed generowaniem reaktywnych form tlenu i błędną metalizacją metaloprotein . Jako białko transportujące metal, ATOX1 odpowiada za transport miedzi z cytozolu do transporterów ATPazy ATP7A i ATP7B, które przenoszą miedź do sieci trans aparatu Golgiego lub pęcherzyków wydzielniczych . W Saccharomyces cerevisiae Atx1 dostarcza Cu(I) do homologicznego transportera Ccc2. Dostarczenie miedzi do transporterów ATPazy jest niezbędne do późniejszego wprowadzenia miedzi do ceruloplazminy , ferroksydazy niezbędnej do metabolizmu żelaza, w aparacie Golgiego. Oprócz funkcji metalochaperonu w ostatnich doniesieniach scharakteryzowano ATOX1 jako czynnik transkrypcyjny cykliny D1 .
Koordynacja struktury i metalu
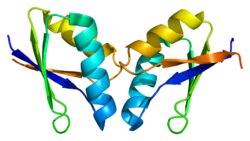
ATOX1 ma fałdowanie βαββαβ podobne do ferrodoksyny i koordynuje się z Cu(I) poprzez motyw wiążący MXCXXC znajdujący się pomiędzy pierwszą kartką β i α-helisą. Motyw wiążący metal jest w dużej mierze eksponowany na rozpuszczalnik w Apo- ATOX1 i zmiana konformacyjna jest indukowana po skoordynowaniu z Cu(I). Cu(I) jest skoordynowany w zniekształconej geometrii liniowej do siarki cystyny, tworząc kąt wiązania wynoszący 120°. Całkowity ładunek -1 pierwotnej sfery koordynacyjnej jest stabilizowany przez drugorzędową sferę koordynacyjną, która zawiera proksymalną dodatnio naładowaną lizynę . ATOX1 wiąże również Hg(II), Cd(II), Ag(I) i cisplatynę poprzez ten motyw, ale rola fizjologiczna, jeśli taka istnieje, nie jest jeszcze znana.
Transfer metalu
ATOX1 przenosi Cu(I) do transporterów ATP7A i ATP7B . Transfer zachodzi poprzez mechanizm wymiany ligandów , w którym Cu(I) przejściowo przyjmuje geometrię 3 współrzędną z ligandami cysteinowymi z ATOX1 i powiązanym transporterem. Mechanizm wymiany ligandów pozwala na szybszą wymianę niż mechanizm dyfuzyjny i nadaje specyficzność zarówno metalowi, jak i transporterowi. Ponieważ wymiana ligandów przyspiesza to przeniesienie, a reakcja ma płytki gradient termodynamiczny, mówi się, że jest pod kontrolą raczej kinetyczną niż termodynamiczną .
Znaczenie kliniczne
Chociaż obecnie nie są znane żadne choroby bezpośrednio związane z nieprawidłowym działaniem ATOX1, obecnie prowadzone są aktywne badania w kilku obszarach:
- Istnieje związek między poziomem ATOX1 a wrażliwością komórek na leki na bazie Pt, takie jak cisplatyna.
- Mechanizm leczenia tetratiomolibdenianu amonu [NH 4 ] 2 MoS 4 w chorobie Wilsona jest w trakcie przeglądu. Ponieważ ATOX1 tworzy stabilny kompleks tetratiomolibdenianu, jest badany jako potencjalny cel terapeutyczny.
Bibliografia
Linki zewnętrzne
- Lokalizacja genomu ludzkiego ATOX1 i strona szczegółów genu ATOX1 w przeglądarce genomu UCSC .
Dalsza lektura
- Hung IH, Casareno RL, Labesse G, Mathews FS, Gitlin JD (1998). „HAH1 jest białkiem wiążącym miedź z odrębnymi resztami aminokwasowymi pośredniczącymi w homeostazie miedzi i obronie antyoksydacyjnej” . J. Biol. Chem . 273 (3): 1749–54. doi : 10.1074/jbc.273.3.1749 . PMID 9430722 .
- Larin D, Mekios C, Das K, Ross B, Yang AS, Gilliam TC (1999). „Charakterystyka interakcji między białkami choroby Wilsona i Menkesa i cytoplazmatycznym chaperonem miedzi, HAH1p” . J. Biol. Chem . 274 (40): 28497-504. doi : 10.1074/jbc.274.40.28497 . PMID 10497213 .
- Hamza I, Schaefer M, Klomp LW, Gitlin JD (1999). „Oddziaływanie białka opiekuńczego miedzi HAH1 z białkiem choroby Wilsona jest niezbędne dla homeostazy miedzi” . Proc. Natl. Acad. Nauka. Stany Zjednoczone . 96 (23): 13363-8. Kod Bib : 1999PNAS...9613363H . doi : 10.1073/pnas.96.23.13363 . PMC 23953 . PMID 10557326 .
- Wernimont AK, Huffman DL, Lamb AL, O'Halloran TV, Rosenzweig AC (2000). „Podstawa strukturalna transferu miedzi przez metalochaperon dla białek choroby Menkesa / Wilsona”. Nat. Struktura. Biol . 7 (9): 766–71. doi : 10.1038/78999 . PMID 10966647 . S2CID 30817425 .
- Boultwood J, Strickson AJ, Jabs EW, Cheng JF, Fidler C, Wainscoat JS (2000). „Fizyczne mapowanie ludzkiego homologu ATX1 (HAH1) do krytycznego regionu zespołu 5q- w obrębie 5q32 i bezpośrednio przylegającego do genu SPARC”. Szum. Genet . 106 (1): 127–9. doi : 10.1007/s004390051020 . PMID 10982193 .
- Walker JM, Tsivkovskii R, Łucenko S (2002). „Metallochaperone Atox1 przenosi miedź do domeny końcowej NH2 białka choroby Wilsona i reguluje jego aktywność katalityczną” . J. Biol. Chem . 277 (31): 27953-9. doi : 10.1074/jbc.M203845200 . PMID 12029094 .
- Moore SD, Helmle KE, Prat LM, Cox DW (2003). „Lokalizacja tkankowa miedzi opiekuńczej ATOX1 i jej potencjalna rola w chorobie”. Mamo. Genom . 13 (10): 563–8. doi : 10.1007/s00335-002-2172-9 . PMID 12420134 . S2CID 19978302 .
- Liu PC, Koeller DM, Kaler SG (2004). „Genomiczna organizacja ATOX1, ludzkiego białka opiekuńczego” . BMC Genet . 4 : 4. doi : 10.1186/1471-2156-4-4 . PMC 150598 . PMID 12594858 .
- Strausak D, Howie MK, Firth SD, Schlicksupp A, Pipkorn R, Multhaup G, Mercer JF (2003). „Analiza kinetyczna oddziaływania opiekuńczego miedzi Atox1 z miejscami wiązania metali w białku Menkesa” . J. Biol. Chem . 278 (23): 20821-7. doi : 10.1074/jbc.M212437200 . PMID 12679332 .
- Ralle M, Łucenko S, Blackburn NJ (2003). „Spektroskopia absorpcji promieniowania rentgenowskiego miedzi opiekuńczej HAH1 ujawnia liniowe dwukoordynacyjne centrum Cu(I) zdolne do tworzenia adduktów z egzogennymi tiolami i fosfinami” . J. Biol. Chem . 278 (25): 23163-70. doi : 10.1074/jbc.M303474200 . PMID 12686548 .
- Łucenko S, Tsivkovskii R, Walker JM (2003). „Właściwości funkcjonalne ludzkiej ATPazy transportującej miedź ATP7B (białko choroby Wilsona) i regulacji przez metalochaperon Atox1”. Anny. Akademia Nowego Jorku. Nauka . 986 (1): 204-11. Kod Bib : 2003NYASA.986..204L . doi : 10.1111/j.1749-6632.2003.tb07161.x . PMID 12763797 . S2CID 39325916 .
- Wernimont AK, Yatsunyk LA, Rosenzweig AC (2004). „Wiązanie miedzi(I) przez białko choroby Wilsona i jego białko opiekuńcze miedzi” . J. Biol. Chem . 279 (13): 12269–76. doi : 10.1074/jbc.M311213200 . PMID 14709553 .
- Brandenberger R, Wei H, Zhang S, Lei S, Murage J, Fisk GJ, Li Y, Xu C, Fang R, Guegler K, Rao MS, Mandalam R, Lebkowski J, Stanton LW (2005). „Charakterystyka transkryptomu wyjaśnia sieci sygnalizacyjne, które kontrolują wzrost i różnicowanie ludzkich komórek ES”. Nat. Biotechnologia . 22 (6): 707–16. doi : 10.1038/nbt971 . PMID 15146197 . S2CID 27764390 .
- Anastassopoulou I, Banci L, Bertini I, Cantini F, Katsari E, Rosato A (2004). „Struktura roztworu apo i miedzi (I) załadowanego ludzkim metalochaperonem HAH1”. Biochemia . 43 (41): 13046-53. doi : 10.1021/bi0487591 . PMID 15476398 .
- Banci L, Bertini I, Ciofi-Baffoni S, Chasapis CT, Hadjiliadis N, Rosato A (2005). „Badanie NMR interakcji między ludzkim opiekuńczym miedzi(I) a drugą i piątą domeną wiążącą metal białka Menkesa” . FEBS J . 272 (3): 865–71. doi : 10.1111/j.1742-4658.2004.04526.x . PMID 15670166 . S2CID 1130281 .
- Jeney V, Itoh S, Wendt M, Gradek Q, Ushio-Fukai M, Harrison DG, Fukai T (2005). „Rola przeciwutleniacza-1 w funkcji i ekspresji zewnątrzkomórkowej dysmutazy ponadtlenkowej” . Okr. Res . 96 (7): 723–9. doi : 10.1161/01.RES.0000162001.57896.66 . PMID 15761197 .