Syntaza cytrynianowa - Citrate synthase
Enzym cytrynian syntazy E.C. 2.3.3.1 (poprzednio 4.1.3.7)] Istnieje prawie wszystkich żywych komórek i oznacza jako enzym tempie, co w pierwszym etapie cyklu kwasu cytrynowego (lub cykl Krebsa ). Syntaza cytrynianowa jest zlokalizowana w komórkach eukariotycznych w macierzy mitochondrialnej , ale jest kodowana raczej przez jądrowe DNA niż mitochondrialne. Jest syntetyzowany za pomocą cytoplazmatycznych rybosomów , a następnie transportowany do macierzy mitochondrialnej.
Syntaza cytrynianowa jest powszechnie stosowana jako ilościowy marker enzymatyczny obecności nienaruszonych mitochondriów . Maksymalna aktywność syntazy cytrynianowej wskazuje na zawartość mitochondrialną mięśni szkieletowych. Maksymalną aktywność można zwiększyć poprzez trening wytrzymałościowy lub trening interwałowy o wysokiej intensywności , ale maksymalna aktywność jest dodatkowo zwiększana poprzez trening interwałowy o wysokiej intensywności.
Cytrynian syntazy katalizuje się reakcji kondensacji z dwóch węgla octanu pozostałości z acetylo-koenzymu A i cząsteczki czterech węgla szczawiooctanu w celu utworzenia sześciu węgla cytrynian :
- acetylo-CoA + szczawiooctan + H 2 O → cytrynian + CoA-SH
Szczawiooctan regeneruje się po zakończeniu jednej rundy cyklu Krebsa.
Szczawiooctan jest pierwszym substratem, który wiąże się z enzymem. To indukuje enzym do zmiany jego konformacji i tworzy miejsce wiązania dla acetylo-CoA. Dopiero gdy utworzy się ten cytryl-CoA, kolejna zmiana konformacyjna spowoduje hydrolizę tioestru i uwolnienie koenzymu A. Zapewnia to, że energia uwolniona z rozszczepienia wiązania tioestrowego będzie napędzać kondensację.
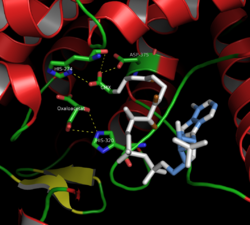
Struktura
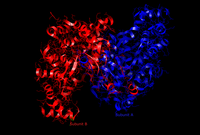
437 reszt aminokwasowych syntazy cytrynianowej jest zorganizowanych w dwie główne podjednostki, z których każda składa się z 20 alfa-helis. Te alfa helisy tworzą około 75% trzeciorzędowej struktury syntazy cytrynianowej , podczas gdy pozostałe reszty tworzą głównie nieregularne przedłużenia struktury, z wyjątkiem pojedynczego beta-kartki 13 reszt. Pomiędzy tymi dwiema podjednostkami istnieje pojedyncza szczelina zawierająca miejsce aktywne. Można w nim znaleźć dwa miejsca wiązania: jedno zarezerwowane dla cytrynianu lub szczawiooctanu, a drugie dla koenzymu A. Miejsce aktywne zawiera trzy kluczowe reszty: His274, His320 i Asp375, które są wysoce selektywne w swoich interakcjach z substratami. Sąsiednie obrazy przedstawiają trzeciorzędową strukturę syntazy cytrynianowej w jej otwartej i zamkniętej formie. Enzym zmienia się z otwartego na zamknięty po dodaniu jednego z jego substratów (takich jak szczawiooctan).
Funkcjonować
| Syntaza cytrynianowa (Si) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||||
| Nr WE | 2.3.3.1 | ||||||||
| Nr CAS | 9027-96-7 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRIAM | profil | ||||||||
| Struktury WPB | RCSB PDB PDBe Suma PDB | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Mechanizm
Syntaza cytrynianowa ma w swoim miejscu aktywnym trzy kluczowe aminokwasy (znane jako triada katalityczna ), które katalizują konwersję acetylo-CoA [H 3 CC(=O)−SCoA] i szczawiooctanu [ − O 2 CCH 2 C(=O) CO 2 − ] na cytrynian [ − O 2 CCH 2 C(OH)(CO 2 − )CH 2 CO 2 − ] i H−SCoA w reakcji kondensacji aldolowej . Konwersja ta rozpoczyna się z ujemnie naładowanym karboksylowego łańcuch boczny atom tlenu Asp-375 deprotonującymi acetylo-CoA jest alfa atomie węgla w celu wytworzenia anionu enolanowego który z kolei jest neutralizowany przez protonowania His-274, tworząc enolowe pośredni [II 2 = C ( OH)−SCoA]. W tym momencie, samotna para elektronów azotu epsilon na His-274 utworzona w ostatnim etapie odciąga proton hydroksyenolowy w celu przekształcenia anionu enolowego, który inicjuje atak nukleofilowy na węgiel karbonylowy szczawiooctanu [ - O 2 CCH 2 C(=O )CO 2 − ], które z kolei deprotonują atom azotu epsilon z His-320. Ten nukleofilowego prowadzi do powstawania citroyl-CoA [ - O 2 CCH 2 CH (CO 2 - ) CH 2 C (= O) -SCoA]. W tym momencie cząsteczka wody jest deprotonowana przez atom azotu epsilon His-320 i rozpoczyna się hydroliza . Jedna z samotnych par tlenu nukleofilowo atakuje węgiel karbonylowy citroilo-CoA. Tworzy to tetraedryczny związek pośredni i powoduje wyrzucenie -SCoA w postaci reform karbonylowych. −SCoA jest protonowana, tworząc HSCoA. Wreszcie dodaje się do hydroksylowej grupy karbonylowej w poprzednim etapie poddaje się deprotonowaniu i cytrynianu [ - O 2 CCH 2 C (OH) (CO 2 - ) CH 2 CO 2 - ] uformowaniu.
Zahamowanie
Enzym jest hamowany przez wysoki stosunek ATP : ADP i NADH : NAD , ponieważ wysokie stężenia ATP i NADH pokazują, że dostarczanie energii do komórki jest wysokie. Jest również hamowany przez sukcynylo-CoA i propionylo-CoA, który przypomina Acetyl-coA i działa jako kompetycyjny inhibitor acetylo-CoA i niekonkurencyjny inhibitor szczawiooctanu. Cytrynian hamuje reakcję i jest przykładem hamowania produktu. Inhibicja syntazy cytrynianowej przez analogi acetylo-CoA również została dobrze udokumentowana i została wykorzystana do udowodnienia istnienia pojedynczego miejsca aktywnego. Eksperymenty te wykazały, że to pojedyncze miejsce występuje naprzemiennie w dwóch formach, które uczestniczą odpowiednio w aktywności ligazy i hydrolazy. Białko to może wykorzystywać morfeeinowy model regulacji allosterycznej .
Bibliografia
Zewnętrzne linki
- Cytrynian + syntaza w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- PDBe-KB zawiera przegląd wszystkich informacji o strukturze dostępnych w PDB dla syntazy cytrynianu ludzkiego, mitochondrialnego