Kokolitowirus -Coccolithovirus
| Kokolitowirus | |
|---|---|

|
|
| Giant coccolithovirus, Emiliania wirus huxleyi 86 (strzałki), zarażając się huxleyi Emiliania coccolithophyceae | |
|
Klasyfikacja wirusów |
|
| (bez rankingu): | Wirus |
| Królestwo : | Varidnaviria |
| Królestwo: | Bamfordvirae |
| Gromada: | Nucleocytoviricota |
| Klasa: | Megaviricetes |
| Zamówienie: | Algavirale |
| Rodzina: | Phycodnaviridae |
| Rodzaj: | Kokolitowirus |
| Szczepy | |
|
|
Coccolithovirus to rodzaj olbrzymiego dwuniciowego wirusa DNA z rodziny Phycodnaviridae . Algi, a konkretnie Emiliania huxleyi , gatunek coccolithophor , są naturalnymi żywicielami. W tym rodzaju opisany jest tylko jeden gatunek: wirus Emiliania huxleyi 86 .
Struktura
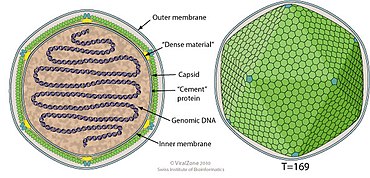
Kokolitowirusy są otoczkowe, dwudziestościenne i mają średnicę w zakresie 100–220 nm. Ich genomy są liniowe, mają długość od 410 do 415 kb i przewidują, że będą kodować około 472 białek.
| Rodzaj | Struktura | Symetria | Kapsyd | Układ genomowy | Segmentacja genomowa |
|---|---|---|---|---|---|
| Kokolitowirus | Icosahedral | T=169 | Koperta | Liniowy | Jednostronny |
Koło życia
Coccolithoviruses są częścią rodziny Phycodnaviridae , jednej z pięciu rodzin należących do dużej i filogenetycznie zróżnicowanej grupy wirusów znanych jako nukleocytoplazmatyczne wirusy dużego dsDNA ( NCLDV ). Wirusy te albo replikują się wyłącznie w cytoplazmie komórki gospodarza, albo rozpoczynają swój cykl życiowy w jądrze gospodarza, ale kończą go w cytoplazmie. W przypadku EhV-86 strategia infekcji nie jest w pełni zrozumiała, ale Mackinder i in. (2009) zaproponowali następujący model: Wirus wnika do komórki gospodarza poprzez endocytozę , po której następuje fuzja jego błony lipidowej z błoną wakuoli gospodarza i uwolnienie rdzenia nukleoproteinowego do cytoplazmy. Alternatywnie, błona wirusa może łączyć się bezpośrednio z błoną plazmatyczną gospodarza. Genom wirusa jest następnie uwalniany z kapsydu do jądra, gdzie jest replikowany przez wirusową polimerazę DNA . Zreplikowany genom jest pakowany w złożone kapsydy w cytoplazmie i uważa się, że nowo utworzone (do 400–1000) wiriony są transportowane do błony plazmatycznej i uwalniane przez kontrolowany mechanizm pączkowania, co prowadzi do rozpadu komórkowego komórki gospodarza .
W fazie G2 i M cyklu życiowego kokosfera jest niekompletna, a ekspozycja błony komórkowej na wirusa jest zwiększona. Nawet przy nienaruszonej kokosferze infekcja może wystąpić z powodu naturalnie występujących luk między kokolitami.
E. huxleyi znany jest z tworzenia sezonowe glonów, które mogą dotrzeć 250.000 km 2 , w której gęstość komórek w górnych 200 m wzrasta od 10 3 do 10 5 komórek na ml wody morskiej. Te zakwity glonów zanikają zwykle po 5-8 dniach, a kilka badań wykazało, że zakończenie zakwitu jest nierozerwalnie związane z infekcją przez kokolitowirusy. Przenoszenie wirusów między żywicielami glonów odbywa się poprzez dyfuzję bierną. Ponadto DNA EhV wykryto również u widłonogów , co doprowadziło do wniosku , że wirusy są dalej rozprzestrzeniane przez zooplankton przenoszący wirusa .
Genom
Do chwili obecnej w latach 1999-2008 wyizolowano 14 szczepów EhV głównie z kanału La Manche (EC), ale także z wybrzeża Norwegii i Szkocji. Chociaż dostępne są częściowe sekwencje wszystkich tych 14 szczepów, EhV-86 jest jedynym szczepem, który został w pełni zsekwencjonowany ze względu na wysoce powtarzalny charakter genomu. Sekwencjonowanie EhV-86 ujawniło kolisty genom o długości 407 339 pz z 472 przewidywanymi sekwencjami kodującymi ( CDS ). Co ciekawe, 80% tych domniemanych genów nie ma do tej pory homologów w bazie danych. Te, którym można przypisać funkcję ze względu na podobieństwo sekwencji lub dopasowanie domen białkowych, obejmują podjednostki polimerazy DNA i RNA , osiem proteaz, a także co najmniej cztery geny, które kodują białka zaangażowane w biosyntezę sfingolipidów. Wykazano , że zostały one pozyskane od gospodarza poprzez horyzontalny transfer genów .
Ponadto genom EhV-86 ujawnił trzy różne rodziny (A, B, C) powtarzających się regionów w genomie. Rodzina C składa się z powtórzeń bogatych w AT, które nie kodują i które są prawdopodobnie częścią początku replikacji ( ORF ). Rodzina B to powtórzenia bogate w GC, które znajdują się w produktach białkowych ośmiu przewidywanych CDS. Regiony homologiczne z rodziny A różnią się wielkością od 30 do 300 pz i znajdują się w sekcji genomu 104 kpz (200-304 kpz), która w aktualnych bazach danych nie zawiera żadnych homologów genów o znanej funkcji. Powtarzające się jednostki rodziny A są niekodujące i charakteryzują się nanomerem (GTTCCC(T/C)AA), który w sumie występuje w 106 miejscach w tym regionie. Ta sekwencja znajduje się bezpośrednio przed 86 CDS i prawdopodobnie odgrywa rolę w kontrolowaniu ekspresji powiązanych CDS.
Podczas infekcji opisano odrębny wzór ekspresji genów wirusowych, który można podzielić na trzy fazy zgodnie z ekspresją CDS. Godzinę po zakażeniu dokonano transkrypcji 39 genów wirusowych, a następnie 194 geny po 2 godz. i 71 genów po 4 godz. Wszystkie 39 genów, które ulegają ekspresji 1 h po zakażeniu, znajdują się w regionie 104 kbp i mają nanomer bezpośrednio przed kodonem start. Ponieważ ekspresja wirusowej polimerazy RNA nie została wykryta 1 godzinę po zakażeniu, należy jeszcze ustalić, czy promotor jest rozpoznawany przez upakowaną wirusową polimerazę RNA, czy przez polimerazę RNA gospodarza. Analiza proteomiczna wirionu EhV-86 nie wykazała jednak żadnych głównych podjednostek polimerazy RNA.
Historia
Wilson i jego zespół z Marine Biological Association (MBA), University of East Anglia i Plymouth Marine Laboratory (PML) po raz pierwszy zaobserwowali wirusa w 1999 roku. Później latem 2005 roku naukowcy z Plymouth Marine Laboratory (Willie Wilson et al. ) oraz w Sanger Institute (Holden et al.) zsekwencjonowali genom szczepu EhV-86, stwierdzając, że ma on 472 geny kodujące białka, co czyni go „ wirusem olbrzymim ” i największym znanym wirusem morskim według genomu.
Na podstawie wstępnych badań genomu Coccolithoviruses odkryto sekwencję genów odpowiedzialnych za produkcję ceramidu . Ceramid jest czynnikiem kontrolującym śmierć komórki i obecnie uważa się, że Coccolithovirus wykorzystuje go do przedłużenia życia Emiliania huxleyi, podczas gdy wykorzystuje komórkę gospodarza do replikacji. Jest to wyjątkowa zdolność niespotykana do tej pory w żadnym innym genomie wirusa.
Zobacz też
- Mimivirus – największy odnotowany gigantyczny wirus według genomu
- Mycoplasma genitalium , Pelagibacter ubique – jedne z najmniejszych znanych bakterii
- Nanoarchaeum – najmniejsze znane archaeum
- Najmniejsze organizmy
- Parwowirus – najmniejsza znana rodzina wirusów
- Phycodnaviridae – glony infekujące wirusy
Uwagi
Bibliografia
Dalsza lektura
- Wilson, WH, Schroeder, DC, Allen, MJ, Holden, MTG, Parkhill, J., Barrell, BG, Churcher, C., Hamlin, N., Mungall, K., Norbertczak, H., Przepiórka, MA, Cena , C., Rabbinowitsch, E., Walker, D., Craigon, M., Roy, D. i Ghazal, P. (2005) Complete Genome Sequence and Lytic Phase Transcription Profile of a Coccolithovirus . Nauka 5737 , 1090-1092
- Allen, MJ, Schroeder, DC, Holden, MT i Wilson, WH (2006) Historia ewolucji Coccolithoviridae . Mol Biol Evol. 23 , 86-92 ( wymagane logowanie w Atenach )