Peptyd hybrydyzujący z kolagenem - Collagen hybridizing peptide

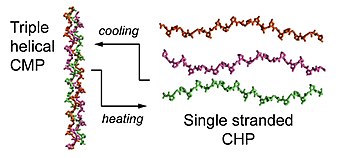
Peptyd kolagenu hybrydyzującą ( CHP ) jest syntetycznym peptydem sekwencji z typowo 6 do 10 powtarzających się jednostek o Gly-Xaa-Yaa aminokwas triplet, który naśladuje Sekwencja cechą naturalnego kolagenu . Peptyd CHP zwykle ma wysoką zawartość proliny i hydroksyproliny w pozycjach Xaa i Yaa, co nadaje mu silną skłonność do tworzenia unikalnej konformacji potrójnej helisy kolagenu . W stanie jednoniciowym (monomerycznym) peptyd może rozpoznawać zdenaturowane nici kolagenowe w tkankach poprzez utworzenie zhybrydyzowanej potrójnej helisy z niciami kolagenowymi. Odbywa się to poprzez składanie potrójnego łańcucha helikalnego i wiązanie wodorowe między łańcuchami, w sposób podobny do starterów wiążących się ze stopionymi nićmi DNA podczas PCR . Wiązanie nie zależy od konkretnej sekwencji lub epitopu na kolagenie, umożliwiając CHP celowanie w zdenaturowane łańcuchy kolagenowe różnych typów.
Kolagen, CHP, CMP i CLP
Kolagen jest głównym składnikiem macierzy zewnątrzkomórkowej (ECM). Nadrodzina kolagenu składa się z 28 różnych rodzajów kolagenu. Chociaż funkcja i struktura hierarchiczna tych kolagenów mogą się różnić, wszystkie mają wspólną cechę strukturalną znaną jako potrójna helisa, w której trzy lewoskrętne helisy z poliproliny II typu (PPII) łączą się, tworząc prawoskrętny, superskręcony motyw spiralny. Krótkie syntetyczne peptydy znane jako peptydy mimetyczne kolagenu (CMP) lub peptydy kolagenopodobne (CLP) odegrały główną rolę w wyjaśnieniu struktury 3D potrójnej helisy kolagenu , jej kinetyki fałdowania i stabilności termicznej jako małych modeli potrójnej helisy. CMP, CLP i CHP są bardzo podobne pod względem sekwencji aminokwasowych, ale tylko wtedy, gdy CMP lub CLP są ogrzewane powyżej ich temperatur topnienia, istnieją w stanie zdysocjowanym, jednoniciowym i można je uznać za CHP.
Mechanizm wiązania
Jednoniciowe CHP wiążą się ze zdenaturowanymi łańcuchami kolagenu i żelatyną w sposób, który jest unikalny w porównaniu z innymi mechanizmami celowania, ponieważ specyficznie rozpoznają unikalny motyw strukturalny ( potrójna helisa kolagenu ) do fałdowania i składania łańcuchów, w przeciwieństwie do wiązania specyficznych epitopów, które jest widoczne na przykład dla przeciwciał monoklonalnych (mAb). Ze względu na swój unikalny mechanizm celowania, CHP mają wysoką swoistość wiązania z zdenaturowanymi łańcuchami kolagenu, ale prawie nie mają powinowactwa do nienaruszonego (potrójnej spirali) kolagenu. CHP mogą w szerokim zakresie kierować łańcuchy kolagenu, które zostały zdenaturowane w procesach termicznych, chemicznych, mechanicznych lub enzymatycznych, jak również wiele typów kolagenu (np. Col I , II , IV ). Badania wykazały również, że CHP i ich koniugaty fluoroforowe mają lepszą stabilność w kontakcie z surowicą.
Zdenaturowany kolagen jako biomarker przebudowy i uszkodzenia tkanek
Kontrolowany obrót kolagenu ma kluczowe znaczenie dla rozwoju embrionalnego, morfogenezy narządów oraz utrzymania i naprawy tkanek. Jednak zmiany homeostazy kolagenu wiążą się z licznymi chorobami i stanami patologicznymi. Nadmierna degradacja kolagenu może być związana z przerzutami raka , starzeniem się skóry , zapaleniem stawów i osteoporozą . CHP mogą celować w tkanki przechodzące przebudowę w oparciu o ich zdolność do wiązania się ze zdegradowanymi i rozwiniętymi nićmi kolagenu poprzez tworzenie potrójnej helisy. Jako ugrupowanie docelowe, CHP oferują ogromny potencjał w histopatologii , diagnostyce i dostarczaniu leków na wiele różnych chorób.
Większość metod oceny denaturacji kolagenu w stanach chorobowych to metody pośrednie, takie jak wykrywanie aktywności metaloproteinazy macierzy (MMP) lub ilościowe oznaczanie fragmentów peptydów kolagenowych w moczu, surowicy lub płynie maziowym . Stosując konwencjonalne metody bezpośredniego ukierunkowania na kolagen, badacze muszą polegać na peptydach wiążących kolagen wyselekcjonowanych przez prezentację fagową , pochodzących z białek wiążących kolagen lub przeciwciał wytworzonych przeciwko kolagenom. Niestety, związki te nie mogą być ukierunkowane na zdenaturowane kolageny, które nie mają struktury i nie prezentują określonego epitopu 3D. Ponadto, przeciwciała, o których doniesiono, że odróżniają określone fragmenty zdegradowanego kolagenu, mogą rozpoznawać tylko jeden lub kilka typów kolagenu. W przeciwieństwie do tego, CHP w zasadzie mogą wiązać się ze wszystkimi typami zdenaturowanych kolagenów.
Aplikacje
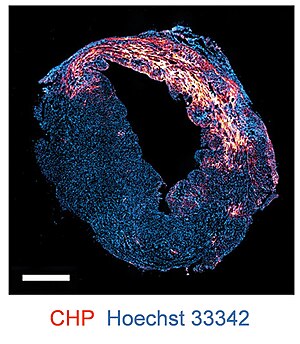
Barwienie tkanek

CHP znakowane fluoroforem lub biotyną są stosowane jako środek barwiący do wykrywania degradacji i denaturacji kolagenu poprzez zastosowania immunofluorescencji i immunohistochemii . CHP mogą barwić zamrożone skrawki tkanek, skrawki utrwalone w formalinie i zatopione w parafinie (FFPE), a także świeże tkanki. CHP ma zastosowanie do próbek tkanek z wielu gatunków i szeregu chorób, takich jak zawał mięśnia sercowego , zapalenie stawów , zapalenie nerek i zwłóknienie .
Obrazowanie in vivo
CHP można również znakować fluoroforami bliskiej podczerwieni do obrazowania fluorescencyjnego in vivo .
Identyfikacja kolagenu
CHP można wykorzystać do wizualizacji wielu różnych typów pasm kolagenowych w żelach SDS-PAGE . Kolagen jest denaturowany przez ogrzewanie w obecności SDS przed nałożeniem żelu. Pasma kolagenu uwidacznia się poprzez hybrydyzację CHP-kolagen, gdy żele są barwione przez CHP znakowane fluorescencyjnie.
Wykrywanie uszkodzeń mechanicznych tkanki łącznej
Kolagen zapewnia wytrzymałość mechaniczną w tkankach nośnych w ciele, takich jak ścięgna, więzadła i kości. Po przyłożeniu sił do tych tkanek potrójna helisa kolagenu może ulec uszkodzeniu i rozwinięciu, a CHP umożliwiają wykrywanie uszkodzeń mechanicznych w takich tkankach łącznych na poziomie molekularnym.