Zespół Kearnsa-Sayre'a - Kearns–Sayre syndrome
| Zespół Kearnsa-Sayre'a | |
|---|---|
| Inne nazwy | Zaburzenie oko-kraniasomatyczne lub zaburzenie nerwowo-mięśniowe oko-kraniosomatyczne z postrzępionymi czerwonymi włóknami |
| Specjalność |
Okulistyka |
Zespół Kearnsa-Sayre'a ( KSS), zaburzenie oko-kraniasomatyczne lub zaburzenie nerwowo-mięśniowe oko-kranio-somatyczne z postrzępionymi czerwonymi włóknami , jest miopatią mitochondrialną o typowym początku przed 20. rokiem życia. KSS jest cięższą syndromiczną odmianą przewlekłej postępującej oftalmoplegii zewnętrznej (w skrócie CPEO), zespołu charakteryzującego się izolowanym zajęciem mięśni kontrolujących ruch powieki (dźwigacz powieki, orbicularis oculi) i oka (mięśnie zewnątrzgałkowe). Powoduje to odpowiednio opadanie powiek i oftalmoplegię . KSS obejmuje kombinację już opisanych CPEO oraz retinopatii barwnikowej w obu oczach i zaburzeń przewodzenia w sercu . Inne objawy mogą obejmować ataksję móżdżkową , osłabienie mięśni proksymalnych, głuchotę , cukrzycę , niedobór hormonu wzrostu , niedoczynność przytarczyc i inne endokrynopatie . W obu tych chorobach zajęcie mięśni może rozpocząć się jednostronnie, ale zawsze rozwija się w deficyt obustronny, a przebieg jest postępujący. Ta dyskusja ogranicza się konkretnie do wariantu cięższego i zaangażowanego systemowo.
Symptomy i objawy
Osoby z KSS prezentują się początkowo podobnie jak osoby z typowym CPEO. Początek przypada na pierwszą i drugą dekadę życia.
Pierwszym objawem tej choroby jest jednostronne opadanie powiek , czyli trudności w otwieraniu powiek, które stopniowo przechodzi w obustronne opadanie powiek. Gdy opadanie powiek pogarsza się, osoba zwykle wydłuża szyję, unosząc podbródek, próbując zapobiec zatkaniu osi wzroku przez powieki. Wraz z podstępnym rozwojem opadanie powieki, ruchy gałek ocznych w końcu stają się ograniczone, co powoduje, że osoba bardziej polega na obracaniu głowy z boku na bok lub w górę i w dół, aby oglądać obiekty w peryferyjnym polu widzenia .
Retinopatia pigmentowa
KSS powoduje pigmentację siatkówki , głównie w tylnym dnie . Wygląd jest opisany jako wygląd „sól i pieprz”. Występuje rozlana depigmentacja nabłonka barwnikowego siatkówki, z największym efektem występującym w plamce żółtej . Jest to przeciwieństwo barwnikowego zwyrodnienia siatkówki, w którym pigmentacja jest obwodowa. Wygląd siatkówki w KSS jest podobny do obserwowanego w dystrofii miotonicznej typu 1 (w skrócie DM1). Niewielką ślepotę nocną można zaobserwować u pacjentów z KSS. Utrata ostrości wzroku jest zwykle łagodna i występuje tylko u 40–50% pacjentów.
Zaburzenia przewodzenia w sercu
Najczęściej występują one po latach od wystąpienia opadanie powiek i oftalmoplegii. Blok przedsionkowo-komorowy (w skrócie „AV”) jest najczęstszym deficytem przewodzenia w sercu. To często postępuje do bloku przedsionkowo-komorowego trzeciego stopnia , który jest całkowitym zablokowaniem przewodzenia elektrycznego od przedsionka do komory. Objawy bloku serca obejmują omdlenie , nietolerancję wysiłku i bradykardię .
Niedobór folianu mózgowego
U pacjentów z Kearns-Sayre konsekwentnie stwierdza się niedobór folianu mózgowego , zespół, w którym poziomy 5-MTHF są obniżone w płynie mózgowo-rdzeniowym, mimo że są prawidłowe w surowicy. Leczenie kwasem folinowym może w niektórych przypadkach złagodzić towarzyszące objawy i częściowo skorygować związane z nimi nieprawidłowości mózgu, zwłaszcza jeśli rozpoczęto je na wczesnym etapie choroby. Proponowaną przyczyną niedoboru folianów w mózgu w zespole Kearnsa-Sayre'a jest zaburzenie mechanizmów splotu naczyniówkowego odpowiedzialnych za przechodzenie folianów z surowicy do płynu mózgowo-rdzeniowego.
Przyczyna i rozpowszechnienie
Jak scharakteryzowano w oryginalnej publikacji Kearnsa z 1965 r. i późniejszych publikacjach, niespójnymi cechami KSS, które mogą wystąpić, są osłabienie mięśni twarzy, gardła, tułowia i kończyn, ubytek słuchu , niski wzrost, zmiany elektroencefalograficzne, ataksja móżdżkowa i podwyższony poziom czynności mózgowo-rdzeniowych. płynne białko.
Zespół Kearnsa-Sayre'a występuje w większości przypadków samoistnie. W niektórych przypadkach wykazano, że jest dziedziczony przez dziedziczenie mitochondrialne, autosomalne dominujące lub autosomalne recesywne. Nie ma predylekcji do rasy lub płci i nie ma znanych czynników ryzyka. W 1992 roku w opublikowanej literaturze zgłoszono tylko 226 przypadków. Chociaż NIH i inne badania szacują występowanie w populacji na 1-3, a niektóre nawet na 9 na 100 000 osób, ale brak skierowania do specjalistycznych ośrodków i nierozpoznania objawów choroby jest powszechny
Genetyka
KSS jest wynikiem delecji w mitochondrialnym DNA (mtDNA), które powodują określoną konstelację medycznych oznak i objawów. mtDNA jest przekazywane wyłącznie z komórki jajowej matki. Mitochondrialny DNA składa się z 37 genów znajdujących się w pojedynczym kolistym chromosomie o długości 16 569 par zasad . Wśród nich 13 genów koduje białka łańcucha transportu elektronów (w skrócie „ETC”), 22 kodują transferowy RNA (tRNA), a dwa kodują dużą i małą podjednostkę tworzącą rybosomalny RNA (rRNA). 13 białek zaangażowanych w ETC mitochondrium jest niezbędnych do fosforylacji oksydacyjnej . Mutacje w tych białkach powodują upośledzenie produkcji energii przez mitochondria. Ten niedobór energii komórkowej objawia się najłatwiej w tkankach, które w dużym stopniu zależą od metabolizmu tlenowego, takich jak mózg, mięśnie szkieletowe i sercowe, narządy zmysłów i nerki. Jest to jeden z czynników zaangażowanych w prezentację chorób mitochondrialnych.
Oprócz wielkości i lokalizacji mutacji, w manifestacji choroby mitochondrialnej biorą udział inne czynniki. Mitochondria replikują się podczas każdego podziału komórki podczas ciąży i przez całe życie. Ponieważ mutacja w chorobie mitochondrialnej najczęściej występuje na wczesnym etapie ciąży w tych chorobach, tylko te mitochondria w zmutowanej linii są wadliwe. Powoduje to nierównomierne rozmieszczenie dysfunkcyjnych mitochondriów w każdej komórce i między różnymi tkankami ciała. Określa termin heteroplazmatyczny, charakterystyczny dla chorób mitochondrialnych, w tym KSS. Dystrybucja zmutowanego mtDNA w każdej komórce, tkance i narządzie zależy od tego, kiedy i gdzie występuje mutacja. To może wyjaśniać, dlaczego dwóch pacjentów z identyczną mutacją w mtDNA może prezentować zupełnie różne fenotypy, a co za tym idzie różne zespoły. Publikacja z 1992 roku Fischel-Ghodsian et al. zidentyfikowali tę samą delecję 4977 pz w mtDNA u dwóch pacjentów prezentujących dwie całkowicie różne choroby. Jeden z pacjentów miał charakterystyczny KSS, podczas gdy drugi pacjent miał bardzo inną chorobę znaną jako zespół trzustki szpiku Pearsona . Komplikując sprawę, w niektórych przypadkach wykazano, że zespół Pearsona przechodzi w KSS w późniejszym życiu.
Nowsze badania wykazały, że duplikacje mtDNA mogą również odgrywać znaczącą rolę w określaniu, jaki fenotyp jest obecny. Duplikacje mtDNA wydają się być charakterystyczne dla wszystkich przypadków KSS i zespołu Pearsona, podczas gdy nie występują one w CPEO.
Delecje mtDNA w KSS różnią się wielkością (1,3–8 kb), a także położeniem w genomie mitochondrialnym . Najpowszechniejsza delecja ma długość 4,9 kb i rozciąga się od pozycji 8469 do pozycji 13147 w genomie . To usunięcie występuje u około ⅓ osób z KSS{{}}
Diagnoza
Neuro-okulista jest zazwyczaj zaangażowane w diagnostyce i leczeniu KSS. Należy podejrzewać, że osoba ma KSS na podstawie wyników badania klinicznego. Podejrzenie miopatii powinna być zwiększona u pacjentów z oftalmoplegii nie pasuje do danego zestawu porażenia nerwów czaszkowych ( okoruchowy porażenia nerwów , czwarty porażenia nerwów , szósty porażenia nerwów ). Początkowo często przeprowadza się badania obrazowe, aby wykluczyć bardziej powszechne patologie. Rozpoznanie można potwierdzić biopsją mięśnia i uzupełnić o oznaczenie mutacji mtDNA metodą PCR .
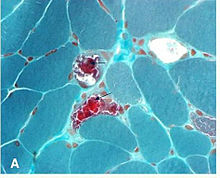
Wyniki biopsji
Biopsja mięśnia gałki ocznej nie jest konieczna, aby wykazać nieprawidłowości histopatologiczne. Przekrój włókien mięśniowych wybarwionych barwnikiem trichromowym Gömöri jest oglądany pod mikroskopem świetlnym . We włóknach mięśniowych zawierających wysokie proporcje zmutowanych mitochondriów występuje wyższe stężenie mitochondriów. Nadaje to tym włóknom ciemniejszy czerwony kolor, co powoduje, że ogólny wygląd biopsji jest opisywany jako „ postrzępione czerwone włókna . Nieprawidłowości można również wykazać w próbkach z biopsji mięśni przy użyciu innych badań histochemicznych, takich jak barwienie enzymów mitochondrialnych, mikroskopia elektronowa, analizy biochemiczne tkanki mięśniowej (tj. aktywności enzymów łańcucha transportu elektronów) oraz poprzez analizę mitochondrialnego DNA mięśni.”
Badania laboratoryjne
Krew mleczanu i pirogronianu poziomy są zazwyczaj podwyższona wskutek zwiększonego metabolizmu beztlenowego i zmniejszony stosunek ATP : ADP . Analiza płynu mózgowo-rdzeniowego wykazuje podwyższony poziom białka, zwykle >100 mg/dl, a także podwyższony poziom mleczanu.
Kierownictwo
Obecnie nie ma leczenia KSS. Ponieważ jest to rzadki stan, istnieją tylko doniesienia o przypadkach leczenia z bardzo małą ilością danych potwierdzających ich skuteczność. Doniesiono o kilku obiecujących odkryciach, które mogą wspierać odkrycie nowych metod leczenia dalszymi badaniami. Za regenerację włókien mięśniowych odpowiadają komórki satelitarne. Zauważono, że zmutowany mtDNA jest rzadki lub niewykrywalny w komórkach satelitarnych hodowanych od pacjentów z KSS. Shoubridge i in. (1997) zadał pytanie, czy mtDNA typu dzikiego można przywrócić do tkanki mięśniowej poprzez zachęcanie do regeneracji mięśni. We wspomnianym badaniu pobrano próbki regenerujących się włókien mięśniowych w oryginalnym miejscu biopsji i stwierdzono, że były one zasadniczo homoplazmatyczne dla mtDNA typu dzikiego. Być może dzięki przyszłym technikom promowania regeneracji komórek mięśniowych i proliferacji komórek satelitarnych stan funkcjonalny pacjentów z KSS mógłby ulec znacznej poprawie.
W jednym badaniu opisano pacjenta z KSS, który miał obniżony poziom koenzymu Q10 w surowicy . Podawanie 60–120 mg koenzymu Q10 przez 3 miesiące spowodowało normalizację poziomu mleczanów i pirogronianu , poprawę wcześniej zdiagnozowanego bloku przedsionkowo- komorowego I stopnia oraz poprawę ruchów gałek ocznych.
U wszystkich pacjentów z CPEO zaleca się wykonanie przesiewowego EKG. W KSS zaleca się wszczepienie stymulatora po rozwinięciu się istotnej choroby przewodzenia, nawet u pacjentów bezobjawowych.
Należy przeprowadzić badania przesiewowe w kierunku zaburzeń endokrynologicznych, w tym pomiary stężenia glukozy w surowicy , testy czynności tarczycy , stężenia wapnia i magnezu oraz stężenia elektrolitów w surowicy. Hiperaldosteronizm występuje u 3% pacjentów z KSS.
Historia
Triada CPEO, obustronna retinopatia barwnikowa i zaburzenia przewodzenia w sercu została po raz pierwszy opisana w opisie przypadku dwóch pacjentów w 1958 r. przez Thomasa P. Kearnsa (1922-2011), MD. i George Pomeroy Sayre (1911-1992), MD. . Drugi przypadek został opublikowany w 1960 roku przez Jagera i współautorów opisujących te objawy u 13-letniego chłopca. Opublikowano wcześniejsze przypadki nagłego zgonu pacjentów z CPEO, niekiedy udokumentowane jako z powodu zaburzeń rytmu serca. W innych przypadkach odnotowano osobliwą pigmentację siatkówki, ale żadna z tych publikacji nie udokumentowała tych trzech patologii występujących łącznie jako zespół genetyczny. Kearns opublikował definiujący przypadek w 1965 roku opisujący 9 niepowiązanych przypadków z tą triadą. W 1988 roku powstało pierwsze powiązanie między KSS a delecjami mitochondrialnego DNA na dużą skalę (w skrócie mtDNA). Od tego odkrycia liczne delecje w mitochondrialnym DNA powiązano z rozwojem KSS.
Bibliografia
Zewnętrzne linki
- kearns_sayre w NINDS
- Zespół Kearnsa Sayre'a w Biurze Chorób Rzadkich NIH
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |