Koenzym Q 10 -Coenzyme Q10
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-[(2 E ,6 E ,10 E ,14 E ,18 E ,22 E ,26 E ,30 E ,34 E )-3,7,11,15,19,23,27,31,35, 39-Dekametylotetrakonta-2,6,10,14,18,22,26,30,34,38-dekaen-1-ylo]-5,6-dimetoksy-3-metylocykloheksa-2,5-dieno-1,4 -dione |
|
| Inne nazwy
Ubichinon, ubidekarenon, koenzym Q, koenzym Q 10 , / ˌ K oʊ ˌ K JU t ɛ n / , koenzym Q, P 10 , P witaminy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.005.590 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 59 H 90 O 4 | |
| Masa cząsteczkowa | 863,365 g·mol -1 |
| Wygląd zewnętrzny | żółte lub pomarańczowe ciało stałe |
| Temperatura topnienia | 48-52 ° C (118-126 ° F; 321-325 K) |
| nierozpuszczalny | |
| Farmakologia | |
| C01EB09 ( KTO ) | |
| Związki pokrewne | |
|
Powiązane chinony
|
1,4-Benzochinon Plastochinon Ubichinol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Koenzym Q , znany również jako ubichinon , to rodzina koenzymów wszechobecnych u zwierząt i większości bakterii (stąd nazwa ubichinon). U ludzi, najczęstszą postacią jest koenzym Q 10 i ubichinon-10 . CoQ 10 nie jest zatwierdzony przez amerykańską Agencję ds. Żywności i Leków (FDA) do leczenia jakichkolwiek schorzeń; jednak jest sprzedawany jako suplement diety i jest składnikiem niektórych kosmetyków.
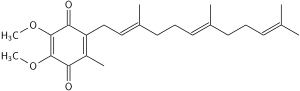
Jest to 1,4-benzochinon , gdzie Q odnosi się do grupy chemicznej chinonu , a 10 odnosi się do liczby podjednostek chemicznych izoprenylu w jego ogonie. W naturalnych ubichinonach liczba ta może wynosić od 6 do 10. Ta rodzina substancji rozpuszczalnych w tłuszczach, przypominająca witaminy , występuje we wszystkich oddychających komórkach eukariotycznych , przede wszystkim w mitochondriach . Jest składnikiem łańcucha transportu elektronów i uczestniczy w tlenowym oddychaniu komórkowym , które wytwarza energię w postaci ATP . W ten sposób powstaje dziewięćdziesiąt pięć procent energii ludzkiego ciała . Narządy najwyższe wymagania energetyczne, takich jak serce , wątrobę i nerki -należy najwyższych koenzym Q 10 stężeniach.
Istnieją trzy redoks stany koenzymu Q: całkowicie utlenione ( ubi chinonu), semi chinonodimetan ( ubisemi chinonu) i całkowicie zredukowane ( ubichinol ). Zdolność tej cząsteczki do działania jako nośnik dwuelektronowy (poruszający się między formą chinonową i chinolową) oraz nośnik jednoelektronowy (poruszający się między semichinonem a jedną z tych innych form) ma kluczowe znaczenie dla jej roli w łańcuchu transportu elektronów ze względu na skupiska żelaza i siarki, które mogą przyjmować tylko jeden elektron na raz, oraz jako przeciwutleniacz wymiatający wolne rodniki .
Niedobór i toksyczność
Istnieją dwa główne czynniki, które prowadzą do niedoboru CoQ 10 u ludzi: zmniejszona biosynteza i zwiększone wykorzystanie przez organizm. Biosynteza jest głównym źródłem koenzymu Q 10 . Biosynteza wymaga co najmniej 12 genów , a mutacje w wielu z nich powodują niedobór CoQ. Na poziom CoQ 10 mogą również wpływać inne defekty genetyczne (takie jak mutacje mitochondrialnego DNA , ETFDH , APTX , FXN i BRAF , genów, które nie są bezpośrednio związane z procesem biosyntezy CoQ 10 ). Niektóre z nich, takie jak mutacje w COQ6 , mogą prowadzić do poważnych chorób, takich jak oporny na steroidy zespół nerczycowy z głuchotą czuciowo-nerwową .
Niektóre działania niepożądane, głównie żołądkowo-jelitowe, są zgłaszane przy bardzo wysokim spożyciu. Metoda oceny ryzyka zaobserwowanego bezpiecznego poziomu (OSL) wykazała, że dowody na bezpieczeństwo są silne przy spożyciu do 1200 mg/dzień, a poziom ten jest określany jako OSL.
Oszacowanie
Chociaż CoQ 10 można mierzyć w osoczu krwi , pomiary te odzwierciedlają raczej spożycie w diecie niż stan tkanek. Obecnie większość ośrodków klinicznych mierzy poziom CoQ 10 w hodowanych fibroblastach skóry , biopsjach mięśni i jednojądrzastych komórkach krwi. Fibroblasty Kultura może być stosowany również do oceny szybkości endogennego koenzymu Q 10 biosyntezy, mierząc wychwyt 14 C - oznaczone p -hydroksybenzoesan .
Statyny
Sugerowano, że miotoksyczność statyn wynika z upośledzenia biosyntezy CoQ, ale dowody na to potwierdzające zostały uznane za kontrowersyjne w 2011 roku.
Podczas statyn może zmniejszać koenzym Q 10 we krwi nie jest jasne, czy zmniejszenie koenzym Q 10 mięśni. Dowody nie potwierdzają, że suplementacja łagodzi skutki uboczne statyn. Jednak nowsza metaanaliza wykazała, że „suplementacja CoQ10 polepszyła SAMS, co sugeruje, że suplementacja CoQ10 może być uzupełniającym podejściem do złagodzenia miopatii wywołanej przez statyny”.
Suplement diety
Regulacja i skład
CoQ 10 jest sprzedawany w wielu jurysdykcjach jako suplement diety pod nazwą UbiQ 300 i UbiQ 100, nie podlega tym samym regulacjom co leki , ale nie jest dopuszczony do leczenia jakiegokolwiek schorzenia . Produkcja CoQ 10 nie jest regulowana, a różne partie i marki mogą się znacznie różnić: analiza laboratoryjna z 2004 roku przeprowadzona przez ConsumerLab.com dotycząca suplementów CoQ 10 sprzedawanych w USA wykazała, że niektóre z nich nie zawierały ilości określonej na etykiecie produktu. Ilości wahały się od „braku wykrywalnego CoQ 10 ”, przez 75% podanej dawki, aż do 75% nadmiaru.
Ogólnie CoQ 10 jest dobrze tolerowany. Najczęstszymi działaniami niepożądanymi są objawy żołądkowo-jelitowe ( nudności , wymioty , tłumienie apetytu i bóle brzucha ), wysypki i bóle głowy .
Chociaż nie ma ustalonej idealnej dawki CoQ 10 , typowa dzienna dawka to 100-200 miligramów. Różne receptury mają różne deklarowane ilości CoQ 10 i innych składników.
Choroba serca
W przeglądzie Cochrane z 2014 r. nie znaleziono „przekonujących dowodów na poparcie lub odrzucenie” stosowania CoQ 10 w leczeniu niewydolności serca . W innym przeglądzie Cochrane z 2014 r. znaleziono niewystarczające dowody, aby wyciągnąć wnioski na temat jego stosowania w zapobieganiu chorobom serca. W przeglądzie Cochrane z 2016 r. stwierdzono, że CoQ 10 nie ma wpływu na ciśnienie krwi . W metaanalizie z 2017 r. dotyczącej osób z niewydolnością serca 30–100 mg/d CoQ 10 spowodowało o 31% niższą śmiertelność. Zwiększono również zdolność wysiłkową. Nie stwierdzono istotnej różnicy w punktach końcowych frakcji wyrzutowej lewego serca i klasyfikacji New York Heart Association (NYHA).
Migrenowe bóle głowy
Kanadyjski Headache Society wytyczną dla migrena profilaktyka zaleca, w oparciu o niskiej jakości dowodów, że 300 mg koenzymu Q 10 być oferowane jako wybór dla profilaktyki.
Miopatia statynowa
CoQ 10 jest rutynowo stosowany w leczeniu rozpadu mięśni związanego z efektem ubocznym stosowania statyn . 2015 Metaanaliza z randomizowanych badań klinicznych wykazały, że koenzym Q 10 nie miało wpływu na statynami miopatii . Metaanaliza z 2018 r. wykazała, że istnieją wstępne dowody na to, że doustny CoQ 10 zmniejsza objawy mięśniowe związane ze statynami, w tym ból mięśni, osłabienie mięśni, skurcze mięśni i zmęczenie mięśni.
Nowotwór
Od 2014 r. nie przeprowadzono żadnych dużych badań klinicznych CoQ 10 w leczeniu raka . Amerykański Narodowy Instytut Raka zidentyfikował problemy z kilkoma małymi badaniami, które zostały przeprowadzone, stwierdzając, że „sposób, w jaki badania zostały przeprowadzone i ilość zgłoszonych informacji sprawiły, że nie było jasne, czy korzyści były spowodowane przez CoQ 10, czy przez coś innego. ”. American Cancer Society stwierdziła, „koenzymu Q 10 może zmniejszać skuteczność chemioterapii i radioterapii, więc większość onkologów polecam unikanie go podczas leczenia raka.”
Choroba zębów
Badanie przeglądowe z 1995 r. wykazało, że stosowanie CoQ 10 w leczeniu chorób przyzębia nie przynosi żadnych korzyści klinicznych . Większość badań sugerujących inaczej była przestarzała, skupiała się na testach in vitro , miała zbyt małą liczbę badanych i/lub błędną metodologię statystyczną i konfigurację badania lub była sponsorowana przez producenta produktu.
Przewlekłą chorobę nerek
W 2019 roku zaproponowano przegląd efektów suplementacji CoQ 10 u osób z PChN.
Dodatkowe zastosowania
Koenzym Q10 był również stosowany w leczeniu choroby Alzheimera, wysokiego poziomu cholesterolu lub stwardnienia zanikowego bocznego (choroba Lou Gehriga). Jednak badania wykazały, że może to nie być skuteczne w leczeniu tych schorzeń
Koenzym Q10 jest również wykorzystywany jako składnik aktywny w kosmeceutykach oraz jako nieaktywny składnik preparatów przeciwsłonecznych . Stosowany miejscowo w produktach do pielęgnacji skóry wykazuje pewną zdolność do zmniejszania stresu oksydacyjnego w skórze, opóźniania oznak wewnętrznego starzenia się skóry, odwracania oznak zewnętrznego starzenia się skóry, wspomagania zanikania dyspigmentacji , zwiększania stabilności niektórych substancji aktywnych przeciwsłonecznych, zwiększania SPF filtrów przeciwsłonecznych, i zapewnij sobie ochronę przed promieniowaniem podczerwonym dla filtrów przeciwsłonecznych. Wiele badań nad korzyściami skórnymi ubichinonu pokazuje, że działa on synergistycznie z innymi miejscowymi przeciwutleniaczami, poprawiając skórę i preparaty kosmetyczne.
Interakcje
Koenzym Q 10 ma potencjał do hamowania działania teofiliny , a także przeciwzakrzepowe warfaryny ; Koenzym Q 10 mogą zakłócać działania warfaryny przez interakcję z cytochromu P450, enzymów zmniejszając przez INR , środek krzepnięcia krwi. Struktura koenzymu Q 10 jest bardzo podobna do budowy witaminy K , która konkuruje i przeciwdziała przeciwzakrzepowym efektom warfaryny. Koenzymu Q 10 należy unikać u pacjentów aktualnie przyjmujących warfarynę ze względu na zwiększone ryzyko powstawania zakrzepów.
Właściwości chemiczne
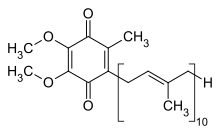
Utlenioną strukturę CoQ 10 pokazano powyżej. Różne rodzaje koenzymu Q można rozróżnić na podstawie liczby podjednostek izoprenoidowych w ich łańcuchach bocznych . Najczęstszym koenzym Q ludzkich mitochondriów koenzym Q 10 . Q odnosi się do głowy chinonu, a 10 odnosi się do liczby powtórzeń izoprenowych w ogonie. Poniższa cząsteczka ma trzy jednostki izoprenoidowe i nazywa się Q 3 .
W stanie czystym jest lipofilowym proszkiem o barwie pomarańczowej i nie ma smaku ani zapachu.
Biosynteza
Biosynteza zachodzi w większości tkanek ludzkich. Istnieją trzy główne kroki:
- Tworzenie struktury benzochinonu (za pomocą fenyloalaniny lub tyrozyny , poprzez 4-hydroksybenzoesan )
- Tworzenie łańcucha bocznego izoprenu (przy użyciu acetylo-CoA )
- Łączenie lub kondensacja powyższych dwóch struktur
Początkowe dwie reakcje zachodzą w mitochondriach , retikulum endoplazmatycznym i peroksysomach , co wskazuje na liczne miejsca syntezy w komórkach zwierzęcych.
Ważnym enzymem na tym szlaku jest reduktaza HMG-CoA , zwykle cel interwencji w powikłaniach sercowo-naczyniowych. Rodzina „statyn” leków obniżających poziom cholesterolu hamuje reduktazę HMG-CoA. Jednym z możliwych skutków ubocznych statyn jest zmniejszenie produkcji CoQ 10 , co może być związane z rozwojem miopatii i rabdomiolizy . Jednak rola, jaką statyny odgrywają w niedoborze CoQ, jest kontrowersyjna. Chociaż te leki obniżają poziom CoQ we krwi, badania nad wpływem CoQ na mięśnie dopiero nadejdą. Suplementacja CoQ nie zmniejsza również skutków ubocznych leków statynowych.
Zaangażowane geny obejmują PDSS1 , PDSS2 , COQ2 i ADCK3 ( COQ8 , CABC1 ).
Organizmy inne niż człowiek wykorzystują nieco inne chemikalia źródłowe do wytworzenia struktury benzochinonu i struktury izoprenu. Na przykład bakteria E. coli wytwarza te pierwsze z chorismatu, a drugie ze źródła innego niż mewalonian. Jednak pospolite drożdże S. cerevisiae wywodzą te pierwsze z chorismatu lub tyrozyny, a drugie z mewalonianu . Większość organizmów ma wspólny 4-hydroksybenzoesanowy związek pośredni, ale ponownie wykorzystuje różne etapy, aby uzyskać strukturę „Q”.
Wchłanianie i metabolizm
Wchłanianie
CoQ 10 to krystaliczny proszek nierozpuszczalny w wodzie. Wchłanianie przebiega tak samo jak w przypadku lipidów; mechanizm wchłaniania wydaje się być podobny do mechanizmu witaminy E , innego składnika odżywczego rozpuszczalnego w tłuszczach. Ten proces w organizmie człowieka obejmuje wydzielanie do jelita cienkiego w enzymów trzustkowych i żółciowych , co ułatwia emulgowanie i miceli powstawaniu wymaganego absorpcji lipofilowych substancji. Przyjmowanie pokarmu (i obecności lipidów) pobudza ciała żółcią kwasów żółciowych, a także znacznie zwiększa wchłanianie koenzymu Q 10 . Egzogenny CoQ 10 jest wchłaniany z jelita cienkiego i najlepiej wchłania się, gdy jest przyjmowany z posiłkiem. Stężenie CoQ 10 w surowicy po posiłku jest wyższe niż w warunkach na czczo.
Metabolizm
Dane dotyczące metabolizmu CoQ 10 u zwierząt i ludzi są ograniczone. W jednym z badań 14 C znakowanego koenzym Q 10 na szczurach wykazały, większość radioaktywności wątroby dwie godziny po podaniu doustnym w przypadku zaobserwowano radioaktywności w osoczu, ale koenzym Q 9 (tylko u 9 jednostek izoprenyloglinem) jest główną formą koenzymu Q szczury. Wydaje się, że CoQ 10 jest metabolizowany we wszystkich tkankach, natomiast główną drogą jego eliminacji jest wydalanie z żółcią i kałem . Po odstawieniu suplementacji CoQ 10 poziomy wracają do normy w ciągu kilku dni, niezależnie od rodzaju użytego preparatu.
Farmakokinetyka
Niektóre raporty zostały opublikowane na farmakokinetykę z koenzymu Q 10 . Szczyt w osoczu można zaobserwować 2–6 godzin po podaniu doustnym, w zależności głównie od projektu badania. W niektórych badaniach drugi szczyt w osoczu zaobserwowano również po około 24 godzinach od podania, prawdopodobnie z powodu zarówno krążenia jelitowo-wątrobowego, jak i redystrybucji z wątroby do krążenia. Tomono i in . zastosował krystaliczny CoQ10 znakowany deuterem w celu zbadania farmakokinetyki u ludzi i określił czas połowicznej eliminacji wynoszący 33 godziny.
Poprawa biodostępności CoQ 10
Znane jest znaczenie sposobu formułowania leków dla biodostępności. Aby znaleźć zasadę zwiększania biodostępności CoQ 10 po podaniu doustnym, zastosowano kilka nowych podejść; różne formuły i formy zostały opracowane i przetestowane na zwierzętach i ludziach.
Zmniejszenie wielkości cząstek
Nanocząstki badano jako system dostarczania różnych leków, np. poprawiając biodostępność doustną leków o słabej charakterystyce wchłaniania. Jednak nie okazało się to skuteczne w przypadku CoQ 10 , chociaż raporty znacznie się różniły. Zastosowanie wodnej zawiesiny drobno sproszkowanego CoQ 10 w czystej wodzie również wykazuje jedynie niewielki efekt.
Miękkie kapsułki żelowe z CoQ 10 w zawiesinie olejowej
Skutecznym podejściem jest zastosowanie układu emulsji do ułatwienia wchłaniania z przewodu pokarmowego i poprawy biodostępności. Emulsje oleju sojowego (mikrosfery lipidowe) mogły być bardzo skutecznie stabilizowane lecytyną i były wykorzystywane do przygotowania kapsułek softgel . W jednej z pierwszych takich prób Ozawa i in. przeprowadził badanie farmakokinetyczne na psach rasy beagle, w którym badano emulsję CoQ 10 w oleju sojowym; około dwukrotna osoczu koenzym Q 10 poziomie niż preparatu tabletka kontroli określano podczas podawania mikrosfer lipidów. Chociaż prawie znikomą poprawę biodostępności zaobserwowali Kommuru i in. w przypadku kapsułek softgel na bazie oleju w późniejszym badaniu na psach, znacznie zwiększona biodostępność CoQ 10 została potwierdzona dla kilku preparatów na bazie oleju w większości innych badań.
Nowe formy CoQ 10 o zwiększonej rozpuszczalności w wodzie
Ułatwienie absorpcji leku przez zwiększenie jego rozpuszczalność w wodzie jest wspólny strategii farmaceutycznych i również okazały się skuteczne dla koenzymu Q 10 . Aby osiągnąć ten cel, opracowano różne podejścia, z których wiele daje znacznie lepsze wyniki niż kapsułki żelowe na bazie oleju, pomimo wielu prób optymalizacji ich składu. Przykładami takich metod są Zastosowanie wodnej dyspersji litego koenzymu Q 10 z polimeru tyloksapol , preparaty oparte na różnych środków solubilizujących, takich jak uwodornione lecytyny i kompleksowanie z cyklodekstrynami ; Wśród nich, kompleks z p-cyklodekstryną stwierdzono mają znacznie lepszą biodostępność i są również stosowane w przemyśle farmaceutycznym i spożywczym dla koenzym Q 10 -fortification.
Historia
W 1950 roku GN Festenstein jako pierwszy wyizolował niewielką ilość CoQ 10 z wyściółki końskiego jelita w Liverpoolu w Anglii. W kolejnych badaniach związek ten nazwano pokrótce substancją SA , uznano go za chinon i zauważono, że można go znaleźć w wielu tkankach wielu zwierząt.
W 1957 Frederick L. Crane i współpracownicy z University of Wisconsin-Madison Enzyme Institute wyizolowali ten sam związek z błon mitochondrialnych serca wołowego i zauważyli, że transportuje on elektrony w mitochondriach. Nazwali go Q-275 w skrócie, ponieważ był to chinon . Wkrótce zauważyli, że badane w Anglii Q-275 i substancja SA mogą być tym samym związkiem. Zostało to potwierdzone później w tym samym roku i Q-275/substancja SA została przemianowana na ubichinon, ponieważ był to wszechobecny chinon, który można znaleźć we wszystkich tkankach zwierzęcych.
W 1958 roku DE Wolf i współpracownicy pracujący pod kierunkiem Karla Folkersa w Merck w Rahway opisali jego pełną strukturę chemiczną . Później w tym samym roku DE Green i współpracownicy należący do grupy badawczej z Wisconsin zasugerowali, że ubichinon powinien być nazywany mitochinonem lub koenzymem Q ze względu na jego udział w mitochondrialnym łańcuchu transportu elektronów .
W 1966 roku A. Mellors i AL Tappel z Uniwersytetu Kalifornijskiego jako pierwsi wykazali, że zredukowany CoQ 6 jest skutecznym przeciwutleniaczem w komórkach.
W 1960 roku Peter D. Mitchell powiększony na zrozumienie funkcji mitochondriów poprzez jego teorii gradientu elektrochemicznego , co wiąże koenzym Q 10 , a pod koniec 1970 roku badania Lars Ernster enlargened na znaczeniu koenzymu Q 10 jako przeciwutleniacz. Lata osiemdziesiąte były świadkiem gwałtownego wzrostu liczby badań klinicznych dotyczących CoQ 10 .
Stężenia dietetyczne
Szczegółowe przeglądy dotyczące występowania CoQ 10 i jego spożycia zostały opublikowane w 2010 roku. Oprócz endogennej syntezy w organizmach, CoQ 10 jest również dostarczany do organizmu przez różne pokarmy. Pomimo ogromnego zainteresowania społeczności naukowej tym związkiem, przeprowadzono jednak bardzo ograniczoną liczbę badań w celu określenia zawartości CoQ 10 w składnikach diety. Pierwsze doniesienia na ten temat ukazały się w 1959 roku, jednak czułość i selektywność ówczesnych metod analitycznych nie pozwalały na wiarygodne analizy, zwłaszcza dla produktów o niskich stężeniach. Od tego czasu rozwój chemii analitycznej umożliwił bardziej wiarygodne oznaczanie stężeń CoQ 10 w różnych produktach spożywczych:
| Żywność | Stężenie CoQ 10 (mg/kg) | |
|---|---|---|
| Wołowina | serce | 113 |
| wątroba | 39-50 | |
| mięsień | 26-40 | |
| Mięso wieprzowe | serce | 12–128 |
| wątroba | 23–54 | |
| mięsień | 14–45 | |
| Kurczak | pierś | 8-17 |
| udo | 24–25 | |
| skrzydło | 11 | |
| Ryba | sardynka | 5-64 |
| makrela : | ||
| – czerwony miąższ | 43–67 | |
| – biały miąższ | 11-16 | |
| łosoś | 4–8 | |
| Tuńczyk | 5 | |
| Obrazy olejne | soja | 54–280 |
| Oliwa | 4-160 | |
| nasienie winogorna | 64–73 | |
| słonecznik | 4–15 | |
| rzepak | 64–73 | |
| Orzechy | arachid | 27 |
| orzech włoski | 19 | |
| nasiona sezamu | 18–23 | |
| pistacja | 20 | |
| orzech laskowy | 17 | |
| migdałowy | 5–14 | |
| Warzywa | Pietruszka | 8–26 |
| brokuły | 6–9 | |
| kalafior | 2–7 | |
| szpinak | do 10 | |
| kapusta pekińska | 2–5 | |
| Owoc | awokado | 10 |
| czarna porzeczka | 3 | |
| winogrono | 6–7 | |
| truskawka | 1 | |
| Pomarańczowy | 1-2 | |
| grejpfrut | 1 | |
| jabłko | 1 | |
| banan | 1 | |
Mięso i ryby są najbogatszym źródłem CoQ 10 w diecie ; poziom powyżej 50 mg/kg można znaleźć w wołowinie , wieprzowinie oraz w sercu i wątrobie kurczaka . Produkty mleczne są znacznie uboższym źródłem CoQ 10 niż tkanki zwierzęce. Oleje roślinne są również dość bogate w CoQ 10 . Wśród warzyw, pietruszka i perilla są najbogatszymi źródłami CoQ 10 , ale w literaturze można znaleźć znaczące różnice w ich poziomach CoQ 10 . Brokuły , winogrona i kalafior są skromne źródła koenzymu Q 10 . Większość owoców i jagód stanowi słabe lub bardzo słabe źródło CoQ 10 , z wyjątkiem awokado , które mają stosunkowo wysoką zawartość CoQ 10 .
Wlot
W krajach rozwiniętych szacunkowe dzienne spożycie CoQ 10 określono na 3–6 mg dziennie, pochodzącego głównie z mięsa.
Wpływ ciepła i przetwarzania
Gotowanie przez smażenie zmniejsza zawartość CoQ 10 o 14-32%.
Zobacz też
- Idebenone – syntetyczny analog o obniżonych właściwościach generujących utleniacze
- Mesylan mitochinonu – syntetyczny analog o zwiększonej przepuszczalności mitochondrialnej
Bibliografia
Zewnętrzne linki
- „Lista składników CoQ 10 zweryfikowanych przez USP ” . Konwencja Farmakopealna Stanów Zjednoczonych. Zarchiwizowane z oryginału w dniu 9 lutego 2009 r.
- "Koenzym Q 10 " . Narodowy Instytut Raka . 23 września 2005 r.
- Bonakdar, Robert Alan; Guarneri, Erminia (15 września 2005). "Koenzym Q 10 " . Amerykański lekarz rodzinny . 72 (6): 1065–1070. PMID 16190504 .