Modelowa dwuwarstwa lipidowa - Model lipid bilayer
Modelu dwuwarstwy lipidowej są każdy dwuwarstwowej montowane w warunkach in vitro , w przeciwieństwie do podwójnej warstwy naturalnych błon komórkowych lub pokrycia różnych struktur subkomórkowych, takich jak jądra . Są one wykorzystywane do badania podstawowych właściwości błon biologicznych w uproszczonym i dobrze kontrolowanym środowisku oraz coraz częściej w oddolnej biologii syntetycznej do budowy sztucznych komórek . Modelowa dwuwarstwa może być wykonana z syntetycznych lub naturalnych lipidów . Najprostsze układy modelowe zawierają tylko jeden czysty syntetyczny lipid. Bardziej istotne fizjologicznie dwuwarstwy modelowe można wytworzyć z mieszanin kilku syntetycznych lub naturalnych lipidów.
Istnieje wiele różnych typów dwuwarstw modelowych, z których każda ma eksperymentalne zalety i wady. Pierwszym opracowanym systemem była czarna membrana lipidowa lub „malowana” dwuwarstwa, która umożliwia prostą charakterystykę elektryczną dwuwarstw, ale jest krótkotrwała i może być trudna w obróbce. Podparte dwuwarstwy są zakotwiczone na stałym podłożu, zwiększając stabilność i umożliwiając zastosowanie narzędzi do charakteryzowania, które nie są możliwe w roztworze masowym. Korzyści te wiążą się z niepożądanymi interakcjami z substratami, które mogą denaturować białka błonowe .
Czarne błony lipidowe (BLM)
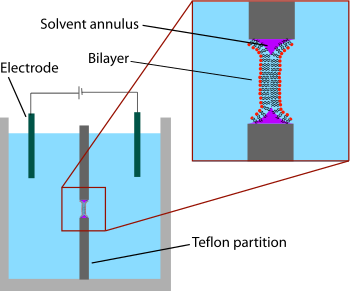
Najwcześniejszym opracowanym modelowym systemem dwuwarstwowym była dwuwarstwa „malowana”, znana również jako „czarna błona lipidowa”. Termin „malowany” odnosi się do procesu, w którym powstają te dwuwarstwy. Najpierw tworzony jest mały otwór w cienkiej warstwie materiału hydrofobowego, takiego jak teflon . Zazwyczaj średnica tego otworu wynosi od kilkudziesięciu mikrometrów do setek mikrometrów. Aby utworzyć BLM, obszar wokół otworu jest najpierw "wstępnie pomalowany" roztworem lipidów rozpuszczonych w hydrofobowym rozpuszczalniku poprzez nałożenie tego roztworu na otwór za pomocą pędzla, strzykawki lub aplikatora szklanego. Stosowany rozpuszczalnik musi mieć bardzo wysoki współczynnik podziału i musi być stosunkowo lepki, aby zapobiec natychmiastowemu rozerwaniu. Najczęściej stosowanym rozpuszczalnikiem jest mieszanina dekanu i skwalenu .
Po pozostawieniu otworu do wyschnięcia, roztwór soli (faza wodna) jest dodawany po obu stronach komory. Otwór jest następnie „malowany” roztworem lipidu (zazwyczaj ten sam roztwór, który był używany do malowania wstępnego). Monowarstwa lipidowa samorzutnie tworzy się na granicy faz pomiędzy fazą organiczną i wodną po obu stronach kropli lipid/rozpuszczalnik. Ponieważ ścianki apertury są hydrofobowe, roztwór lipid/rozpuszczalnik zwilża to połączenie, rozrzedzając kropelkę w środku. Gdy obie strony kropelki zbliżą się wystarczająco blisko siebie, monowarstwy lipidowe łączą się, szybko usuwając niewielką pozostałą objętość roztworu. W tym momencie w środku otworu tworzy się dwuwarstwa, ale na obwodzie pozostaje znaczny pierścień rozpuszczalnika. Ten pierścień jest wymagany do utrzymania stabilności, działając jako mostek między dwuwarstwą ~5 nm a 10 s arkusza o grubości 10 mikrometrów, w którym wykonany jest otwór.
Termin „czarna” dwuwarstwa odnosi się do tego, że są one ciemne w świetle odbitym, ponieważ grubość membrany wynosi tylko kilka nanometrów, więc światło odbijające się od tylnej strony destrukcyjnie zakłóca światło odbijające się od przedniej strony. Rzeczywiście, była to jedna z pierwszych wskazówek, że ta technika wytworzyła membranę o grubości w skali molekularnej. Czarne membrany lipidowe są również dobrze przystosowane do charakteryzacji elektrycznej, ponieważ obie komory oddzielone dwuwarstwą są dostępne, co umożliwia łatwe umieszczenie dużych elektrod. Z tego powodu charakterystyka elektryczna jest jedną z najważniejszych metod stosowanych w połączeniu z malowanymi dwuwarstwami lipidowymi. Proste pomiary wskazują, kiedy tworzy się dwuwarstwa, a kiedy pęka, ponieważ nienaruszona dwuwarstwa ma dużą rezystancję (>GΩ) i dużą pojemność (~2 µF/cm 2 ). Bardziej zaawansowana charakterystyka elektryczna jest szczególnie ważna w badaniach kanałów jonowych bramkowanych napięciem . Białka błonowe, takie jak kanały jonowe, zazwyczaj nie mogą być włączone bezpośrednio do malowanej dwuwarstwy podczas tworzenia, ponieważ zanurzenie w rozpuszczalniku organicznym spowodowałoby denaturację białka. Zamiast tego białko jest rozpuszczane za pomocą detergentu i dodawane do roztworu wodnego po utworzeniu dwuwarstwy. Powłoka detergentowa umożliwia tym białkom samorzutne wstawienie się do dwuwarstwy w ciągu kilku minut. Dodatkowo przeprowadzono wstępne eksperymenty łączące badania elektrofizjologiczne i strukturalne czarnych błon lipidowych. W innej odmianie techniki BLM, zwanej stemplem dwuwarstwowym, szklana pipeta (średnica wewnętrzna ~10-40 µm) jest używana jako elektroda po jednej stronie dwuwarstwy w celu wyizolowania niewielkiego fragmentu membrany. Ta modyfikacja techniki patch clamp umożliwia rejestrację z niskim poziomem szumów, nawet przy wysokich potencjałach (do 600 mV), kosztem dodatkowego czasu na przygotowanie.
Główne problemy związane z malowanymi dwuwarstwami to pozostałości rozpuszczalnika i ograniczona żywotność. Niektórzy badacze uważają, że kieszenie rozpuszczalnika uwięzione między dwiema dwuwarstwowymi listkami mogą zakłócać normalne funkcjonowanie białka. Aby przezwyciężyć to ograniczenie, Montal i Mueller opracowali zmodyfikowaną technikę osadzania, która eliminuje użycie ciężkiego nielotnego rozpuszczalnika. W tej metodzie otwór zaczyna się nad powierzchnią wody, całkowicie oddzielając dwie komory płynu. Na powierzchni każdej komory tworzy się monowarstwa poprzez nałożenie lipidów w lotnym rozpuszczalniku, takim jak chloroform, i oczekiwanie na odparowanie rozpuszczalnika. Otwór jest następnie opuszczany przez interfejs powietrze-woda, a dwie monowarstwy z oddzielnych komór są składane względem siebie, tworząc dwuwarstwę w poprzek otworu. Problem stabilności okazał się trudniejszy do rozwiązania. Zazwyczaj czarna błona lipidowa przetrwa mniej niż godzinę, co wyklucza długoterminowe eksperymenty . Czas życia można wydłużyć poprzez precyzyjne ukształtowanie szczeliny podtrzymującej, chemiczne usieciowanie lipidów lub żelowanie otaczającego roztworu w celu mechanicznego podparcia dwuwarstwy. W tej dziedzinie trwają prace i możliwe będzie kilkugodzinne życie.
Obsługiwane dwuwarstwy lipidowe (SLB)
W przeciwieństwie do pęcherzyka lub błony komórkowej, w której podwójna warstwa lipidowa jest zwinięta w zamkniętą powłokę, podparta podwójna warstwa jest płaską strukturą osadzoną na stałym podłożu. Z tego powodu tylko górna powierzchnia dwuwarstwy jest wystawiona na działanie wolnego roztworu. Taki układ ma zalety i wady związane z badaniem dwuwarstw lipidowych. Jedną z największych zalet obsługiwanej dwuwarstwy jest jej stabilność. SLB pozostaną w dużej mierze nienaruszone, nawet gdy zostaną poddane wysokim natężeniom przepływu lub wibracjom i, w przeciwieństwie do czarnych błon lipidowych, obecność dziur nie zniszczy całej dwuwarstwy. Ze względu na tę stabilność możliwe są eksperymenty trwające tygodnie, a nawet miesiące z obsługiwanymi dwuwarstwami, podczas gdy eksperymenty BLM są zwykle ograniczone do godzin. Inną zaletą podtrzymywanej dwuwarstwy jest to, że ponieważ znajduje się na płaskiej, twardej powierzchni, jest podatna na szereg narzędzi charakteryzacyjnych, które byłyby niemożliwe lub oferowałyby niższą rozdzielczość, gdyby przeprowadzono na swobodnie pływającej próbce.
Jednym z najbardziej wyraźnych przykładów tej przewagi jest zastosowanie mechanicznych technik sondowania, które wymagają bezpośredniej fizycznej interakcji z próbką. Mikroskopia sił atomowych (AFM) została wykorzystana do obrazowania separacji faz lipidowych , tworzenia transbłonowych nanoporów, a następnie adsorpcji pojedynczych cząsteczek białka i składania białek z dokładnością sub-nm bez potrzeby stosowania barwnika do znakowania. Ostatnio AFM jest również stosowany do bezpośredniego badania właściwości mechanicznych pojedynczych dwuwarstw i wykonywania spektroskopii sił na poszczególnych białkach błonowych. Badania te byłyby trudne lub niemożliwe bez użycia dwuwarstw na nośniku, ponieważ powierzchnia komórki lub pęcherzyka jest stosunkowo miękka i dryfowałaby i zmieniała się w czasie. Innym przykładem sondy fizycznej jest zastosowanie mikrowagi kryształu kwarcu (QCM) do badania kinetyki wiązania na powierzchni dwuwarstwowej. Interferometria z podwójną polaryzacją jest narzędziem optycznym o wysokiej rozdzielczości do charakteryzowania porządku i rozerwania dwuwarstw lipidowych podczas interakcji lub przejść fazowych, dostarczającym danych uzupełniających do pomiarów QCM.
Wiele nowoczesnych technik mikroskopii fluorescencyjnej wymaga również sztywno podpartej płaskiej powierzchni. Metody pola zanikającego , takie jak mikroskopia fluorescencyjna z całkowitym wewnętrznym odbiciem (TIRF) i powierzchniowy rezonans plazmonowy (SPR) mogą oferować niezwykle czuły pomiar wiązania analitu i właściwości optycznych dwuwarstw, ale mogą działać tylko wtedy, gdy próbka jest osadzona na specjalistycznych optycznie funkcjonalnych materiałach. Inną klasą metod mających zastosowanie tylko w przypadku dwuwarstwowych nośników są metody oparte na interferencji optycznej, takie jak mikroskopia kontrastowa interferencji fluorescencyjnej (FLIC) i mikroskopia kontrastowa interferencyjno-odbiciowa (RICM) lub mikroskopia rozpraszania interferometrycznego (iSCAT). Gdy dwuwarstwa jest osadzona na wierzchu powierzchni odbijającej, zmiany intensywności spowodowane niszczącą interferencją z tego interfejsu można wykorzystać do obliczenia z dokładnością do angstremów położenia fluoroforów w dwuwarstwie. Zarówno techniki zanikające, jak i interferencyjne oferują rozdzielczość subfalową tylko w jednym wymiarze (z lub pionowym). W wielu przypadkach ta rezolucja wystarczy. W końcu dwuwarstwy są bardzo małe tylko w jednym wymiarze. Z boku dwuwarstwa może rozciągać się na wiele mikrometrów, a nawet milimetrów. Jednak pewne zjawiska, takie jak dynamiczne przegrupowanie faz, występują w dwuwarstwach na bocznej skali długości submikrometrowej. Obiecującym podejściem do badania tych struktur jest skaningowa mikroskopia optyczna bliskiego pola (NSOM). Podobnie jak AFM, NSOM opiera się na skanowaniu mikroobrobionej końcówki, aby uzyskać wysoce zlokalizowany sygnał. Ale w przeciwieństwie do AFM, NSOM wykorzystuje raczej optyczną niż fizyczną interakcję z próbką, potencjalnie zaburzając delikatne struktury w mniejszym stopniu.
Inną ważną zdolnością podpartych dwuwarstw jest zdolność do kształtowania powierzchni w celu wytworzenia wielu izolowanych regionów na tym samym podłożu. Zjawisko to zostało po raz pierwszy zademonstrowane przy użyciu zadrapań lub metalowych „korali”, aby zapobiec mieszaniu się między sąsiednimi regionami, jednocześnie umożliwiając swobodną dyfuzję w dowolnym regionie. Późniejsze prace rozszerzyły tę koncepcję poprzez integrację mikroprzepływów, aby wykazać, że stabilne gradienty składu mogą powstawać w dwuwarstwach, potencjalnie umożliwiając masowo równoległe badania segregacji faz, wiązania molekularnego i odpowiedzi komórkowej na sztuczne błony lipidowe. Kreatywne wykorzystanie koncepcji koralowców umożliwiło również badanie dynamicznej reorganizacji białek błonowych na styku synaptycznym .
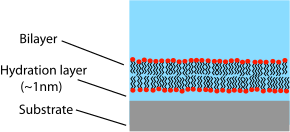
Jednym z podstawowych ograniczeń dwuwarstw na nośniku jest możliwość niepożądanych interakcji z podłożem. Chociaż dwuwarstwy na nośniku na ogół nie dotykają bezpośrednio powierzchni podłoża, są one oddzielone jedynie bardzo cienką szczeliną wodną. Wielkość i charakter tej luki zależy od materiału podłoża i rodzaju lipidu, ale generalnie wynosi około 1 nm dla lipidów obojnaczych osadzonych na krzemionce , najpowszechniejszym układzie doświadczalnym. Ponieważ ta warstwa jest tak cienka, występuje rozległe sprzężenie hydrodynamiczne między dwuwarstwą a podłożem, co skutkuje niższym współczynnikiem dyfuzji we wspieranych dwuwarstwach niż w przypadku wolnych dwuwarstw o tym samym składzie. Pewien procent obsługiwanej dwuwarstwy będzie również całkowicie nieruchomy, chociaż dokładna natura i przyczyna tych „przypiętych” witryn jest nadal niepewna. W przypadku wysokiej jakości dwuwarstw na nośniku w fazie ciekłej frakcja nieruchoma wynosi zazwyczaj około 1-5%. Aby określić ilościowo współczynnik dyfuzji i frakcję ruchomą, naukowcy badający obsługiwane dwuwarstwy często zgłaszają dane FRAP .
Niepożądane interakcje z substratami stanowią znacznie większy problem przy włączaniu integralnych białek błonowych, szczególnie tych z dużymi domenami wystającymi poza rdzeń dwuwarstwy. Ponieważ szczelina między dwuwarstwą a podłożem jest tak cienka, białka te często ulegają denaturacji na powierzchni podłoża, a tym samym tracą wszelką funkcjonalność. Jednym ze sposobów obejścia tego problemu jest zastosowanie dwuwarstw uwiązanych polimerem. W tych układach dwuwarstwa jest osadzona na luźnej sieci uwodnionych polimerów lub hydrożelu, który działa jak przekładka i teoretycznie zapobiega denaturującym oddziaływaniom z podłożem. W praktyce pewien procent białek nadal będzie tracił mobilność i funkcjonalność, prawdopodobnie z powodu interakcji z kotwicami polimer/lipid. Badania w tej dziedzinie trwają.
Związane dwuwarstwowe błony lipidowe (t-BLM)
Zastosowanie uwiązanej dwuwarstwowej błony lipidowej (t-BLM) dodatkowo zwiększa stabilność podtrzymywanych błon poprzez chemiczne zakotwiczenie lipidów w stałym podłożu.
Złoto może być stosowane jako substrat ze względu na jego chemię obojętną i tiolipidy do kowalencyjnego wiązania ze złotem. Tiolipidy składają się z pochodnych lipidów, wydłużonych na ich polarnych grupach głów przez hydrofilowe odstępniki, które kończą się grupą tiolową lub dwusiarczkową , która tworzy wiązanie kowalencyjne ze złotem, tworząc samoorganizujące się monowarstwy (SAM).
Ograniczenie ruchliwości wewnątrzbłonowej podtrzymywanych dwuwarstw lipidowych można przezwyciężyć przez wprowadzenie półbłonowych lipidów łączących błonę z dwusiarczkiem benzylu (DPL) i syntetycznych analogów archeonów pełnobłonowych lipidów obejmujących łańcuchy fitanoli w celu stabilizacji struktury i jednostek glikolu polietylenowego jako hydrofilowego odstępnik. Tworzenie dwuwarstwy osiąga się przez wystawienie złotego podłoża pokrytego lipidami na działanie lipidów warstwy zewnętrznej w roztworze etanolu lub w liposomach.
Zaletą tego podejścia jest to, że ze względu na hydrofilową przestrzeń około 4 nm, oddziaływanie z podłożem jest minimalne, a dodatkowa przestrzeń umożliwia wprowadzenie kanałów jonowych białek do dwuwarstwy. Dodatkowo warstwa rozdzielająca tworzy zbiornik jonów, który z łatwością umożliwia pomiar impedancji elektrycznej prądu przemiennego w dwuwarstwie.
Pęcherzyki
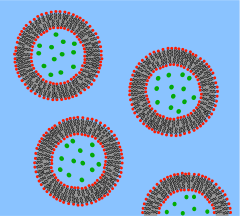
Pęcherzyk to dwuwarstwa lipidowa zwinięta w kulistą powłokę, która zamyka niewielką ilość wody i oddziela ją od wody znajdującej się na zewnątrz pęcherzyka. Ze względu na to fundamentalne podobieństwo do błony komórkowej, pęcherzyki są szeroko wykorzystywane do badania właściwości dwuwarstw lipidowych. Innym powodem, dla którego tak często używa się pęcherzyków, jest to, że można je stosunkowo łatwo wytworzyć. Jeśli próbka odwodnionego lipidu zostanie wystawiona na działanie wody, spontanicznie utworzy pęcherzyki. Te początkowe pęcherzyki są zazwyczaj wielowarstwowe (wielościenne) i mają szeroki zakres rozmiarów od dziesiątek nanometrów do kilku mikrometrów. Do rozbicia tych początkowych pęcherzyków na mniejsze, jednościenne pęcherzyki o jednakowej średnicy, znane jako małe pęcherzyki jednowarstwowe (SUV), potrzebne są takie metody, jak sonikacja lub wytłaczanie przez błonę. SUV-y mają zazwyczaj średnice od 50 do 200 nm. Alternatywnie, zamiast syntetyzować pęcherzyki, można je po prostu wyizolować z hodowli komórkowych lub próbek tkanek. Pęcherzyki są wykorzystywane do transportu lipidów, białek i wielu innych cząsteczek w obrębie komórki, jak również do lub z komórki. Te naturalnie izolowane pęcherzyki składają się ze złożonej mieszaniny różnych lipidów i białek, więc chociaż oferują większy realizm w badaniu określonych zjawisk biologicznych, do badania podstawowych właściwości lipidów preferowane są proste sztuczne pęcherzyki.
Ponieważ sztuczne SUV-y mogą być produkowane w dużych ilościach, nadają się one do badań materiałów sypkich, takich jak dyfrakcja rentgenowska w celu określenia odstępów między sieciami i różnicowej kalorymetrii skaningowej w celu określenia przejść fazowych. Interferometria z podwójną polaryzacją może mierzyć struktury jednowarstwowe i wielowarstwowe oraz wstawianie i rozrywanie pęcherzyków w formacie testu bez znacznika. Pęcherzyki można również znakować barwnikami fluorescencyjnymi, aby umożliwić czułe testy fuzji oparte na FRET .
Pomimo oznakowania fluorescencyjnego często trudno jest wykonać szczegółowe obrazowanie SUV-ów tylko dlatego, że są one tak małe. Aby zwalczyć ten problem, naukowcy stosują gigantyczne pęcherzyki jednowarstwowe (GUV). GUV są wystarczająco duże (1–200 µm), aby można je było badać przy użyciu tradycyjnej mikroskopii fluorescencyjnej i mieszczą się w tym samym zakresie wielkości, co większość komórek biologicznych. W związku z tym są wykorzystywane jako mimikry błon komórkowych do badań in vitro w biologii molekularnej i komórkowej. Z tego powodu wiele badań tratw lipidowych w sztucznych układach lipidowych przeprowadzono z użyciem GUV. W porównaniu z dwuwarstwowymi nośnikami, GUV prezentują bardziej „naturalne” środowisko, ponieważ nie ma sztywnej powierzchni, która mogłaby wywoływać defekty, wpływać na właściwości membrany lub białka denaturujące. Dlatego GUV są często wykorzystywane do badania przebudowy błony i innych interakcji białko-błona in vitro. Istnieje wiele metod enkapsulacji białek lub innych reagentów biologicznych w takich pęcherzykach, dzięki czemu GUV są idealnym systemem do odtwarzania (i badania) funkcji komórek in vitro w komórkowych środowiskach modelowych błon. Metody te obejmują metody mikroprzepływowe, które pozwalają na wysokowydajną produkcję pęcherzyków o stałych rozmiarach.
Dwuwarstwowe warstwy interfejsu kropli
Dwuwarstwowe warstwy przylegania kropel (DIB) to otoczone fosfolipidami kropelki, które tworzą dwuwarstwy po zetknięciu. Kropelki są otoczone olejem, a fosfolipidy są rozproszone w wodzie lub oleju. W rezultacie fosfolipidy spontanicznie tworzą monowarstwę na każdym z interfejsów olej-woda. DIB można formować w celu stworzenia materiału tkankowopodobnego ze zdolnością do tworzenia asymetrycznych dwuwarstw, odtwarzania białek i kanałów białkowych lub do wykorzystania w badaniach elektrofizjologii. Rozszerzone sieci DIB mogą być tworzone przy użyciu urządzeń mikroprzepływowych kropelkowych lub przy użyciu drukarek kropelkowych.
Micele, bicele i nanodyski
Micele detergentowe to kolejna klasa modelowych błon, które są powszechnie stosowane do oczyszczania i badania białek błonowych , chociaż nie zawierają dwuwarstwy lipidowej. W roztworach wodnych micele to zespoły cząsteczek amfipatycznych z hydrofilowymi główkami wystawionymi na działanie rozpuszczalnika i hydrofobowymi ogonami pośrodku. Micele mogą rozpuszczać białka błonowe poprzez częściowe ich kapsułkowanie i osłanianie ich hydrofobowych powierzchni przed rozpuszczalnikiem.
Bicele są pokrewną klasą błon modelowych, zwykle składających się z dwóch lipidów, z których jeden tworzy podwójną warstwę lipidową, podczas gdy drugi tworzy amfipatyczny, micelarny zespół osłaniający centrum dwuwarstwy przed otaczającymi cząsteczkami rozpuszczalnika. Bicelles można traktować jako segment dwuwarstwy kapsułkowany i solubilizowany przez micelę. Bicelles są znacznie mniejsze niż liposomy, a więc mogą być używane w eksperymentach, takich jak spektroskopia NMR, gdzie większe pęcherzyki nie są opcją.
Nanodyski składają się z segmentu dwuwarstwy otoczonej amfipatyczną powłoką białkową, a nie z warstwy lipidowej lub detergentowej. Nanodyski są bardziej stabilne niż bicele i micele w niskich stężeniach i mają bardzo dobrze zdefiniowany rozmiar (w zależności od rodzaju płaszcza białkowego, od 10 do 20 nm ). Białka błonowe włączone i rozpuszczone przez nanodyski można badać za pomocą wielu różnych technik biofizycznych.