Sztuczna komórka - Artificial cell
Komórki sztucznej , komórki syntetyczny lub minimalne komórka jest inżynieryjną cząstek, który naśladuje jedną lub wiele funkcji w komórce biologicznej . Często sztuczne komórki są błonami biologicznymi lub polimerowymi, które otaczają materiały biologicznie aktywne. Jako takie, jako sztuczne komórki można zakwalifikować liposomy , polimerosomy , nanocząsteczki , mikrokapsułki i szereg innych cząsteczek.
Terminy „sztuczna komórka” i „komórka syntetyczna” są używane w wielu różnych dziedzinach i mogą mieć różne znaczenia, co jest również odzwierciedlone w różnych sekcjach tego artykułu. Niektóre bardziej rygorystyczne definicje opierają się na założeniu, że termin „komórka” odnosi się bezpośrednio do komórek biologicznych i dlatego struktury te muszą być żywe, a ponadto, że termin „sztuczny” oznacza, że struktury te są sztucznie budowane oddolnie. , czyli z podstawowych składników. Jako takie, w dziedzinie biologii syntetycznej , sztuczną komórkę można rozumieć jako całkowicie syntetycznie wykonaną komórkę, która może wychwytywać energię , utrzymywać gradienty jonów , zawierać makrocząsteczki, a także przechowywać informacje i mieć zdolność do replikacji . Tego rodzaju sztuczna komórka nie została jeszcze wykonana.
Jednak w innych przypadkach termin „sztuczny” nie oznacza, że cała struktura jest stworzona przez człowieka, ale może odnosić się do idei, że pewne funkcje lub struktury komórek biologicznych mogą być zastąpione lub uzupełnione bytem syntetycznym.
W innych dziedzinach termin „sztuczna komórka” może odnosić się do dowolnego przedziału, który pod względem wielkości lub struktury nieco przypomina komórkę biologiczną, która jest wytworzona syntetycznie lub nawet całkowicie wykonana z niebiologicznych składników. Termin „sztuczna komórka” jest również używany do struktur o bezpośrednim zastosowaniu, takich jak przedziały do dostarczania leków. Mikrokapsułkowanie pozwala na metabolizm w błonie, wymianę małych cząsteczek i zapobieganie przechodzeniu przez nią dużych substancji. Główne zalety enkapsulacji to poprawa mimikry w organizmie, zwiększona rozpuszczalność ładunku i zmniejszona odpowiedź immunologiczna . Warto zauważyć, że sztuczne komórki odniosły kliniczny sukces w hemoperfuzji .
| Część serii artykułów na temat |
| Biologia syntetyczna |
|---|
| Syntetyczne obwody biologiczne |
| Edycja genomu |
| Sztuczne komórki |
| Ksenobiologia |
| Inne tematy |
Inżynieria oddolna żywych sztucznych komórek
Niemiecki patolog Rudolf Virchow przedstawił ideę, że nie tylko życie powstaje z komórek, ale każda komórka pochodzi z innej komórki; " Omnis cellula e cellula ". Do tej pory większość prób stworzenia sztucznej komórki tworzyła jedynie pakiet, który może naśladować niektóre zadania komórki. Postępy w bezkomórkowych reakcjach transkrypcji i translacji umożliwiają ekspresję wielu genów , ale wysiłki te są dalekie od wytworzenia w pełni sprawnej komórki.
Oddolne podejście do tworzenia komórkę sztuczną wiązałoby tworząc protocell de novo , w całości z materiałów nieożywionych. Jak sugeruje termin „komórka”, jednym z warunków wstępnych jest wytworzenie pewnego rodzaju przedziału, który definiuje indywidualną jednostkę komórkową. Błony fosfolipidowe są oczywistym wyborem jako granice przedziałowe, ponieważ działają jako selektywne bariery we wszystkich żywych komórkach biologicznych. Naukowcy mogą zamykać biocząsteczki w pęcherzykach fosfolipidowych wielkości komórki i dzięki temu obserwować, jak te cząsteczki zachowują się podobnie jak w komórkach biologicznych, a tym samym odtwarzają określone funkcje komórek. W podobny sposób funkcjonalne biologiczne elementy budulcowe mogą być zamknięte w tych przedziałach lipidowych w celu uzyskania syntezy (jakkolwiek szczątkowych) sztucznych komórek.
Proponuje się stworzenie dwuwarstwowego pęcherzyka fosfolipidowego z DNA zdolnym do samoreprodukowania się przy użyciu syntetycznej informacji genetycznej. Trzy podstawowe elementy takich sztucznych komórek to tworzenie błony lipidowej , replikacja DNA i RNA w procesie matrycowym oraz zbieranie energii chemicznej do aktywnego transportu przez błonę. Głównymi przeszkodami przewidzianymi i napotkanymi w przypadku tej proponowanej protokomórki jest stworzenie minimalnego syntetycznego DNA, które zawiera wszystkie informacje wystarczające do życia, oraz reprodukcja niegenetycznych komponentów, które są integralną częścią rozwoju komórki, takich jak samoorganizacja molekularna. Mamy jednak nadzieję, że tego rodzaju podejście oddolne zapewni wgląd w fundamentalne kwestie organizacji na poziomie komórkowym i początków życia biologicznego. Jak dotąd nie zsyntetyzowano żadnej całkowicie sztucznej komórki zdolnej do samoreprodukowania się przy użyciu cząsteczek życia, a cel ten jest wciąż odległy, chociaż obecnie nad tym celem pracują różne grupy.
Inna proponowana metoda tworzenia protokomórki bardziej przypomina warunki , które, jak się uważa, występowały podczas ewolucji, znane jako pierwotna zupa. Różne polimery RNA można by kapsułkować w pęcherzykach iw tak małych warunkach granicznych testowano by reakcje chemiczne.
Etyka i kontrowersje
Badania Protocell wywołały kontrowersje i sprzeczne opinie, w tym krytyków niejasnej definicji „sztucznego życia”. Stworzenie podstawowej jednostki życia jest najbardziej palącą troską etyczną, chociaż najbardziej rozpowszechnionym problemem związanym z protokomórkami jest ich potencjalne zagrożenie dla zdrowia ludzkiego i środowiska poprzez niekontrolowaną replikację.
Międzynarodowa Wspólnota Badawcza
W połowie 2010 roku środowisko naukowe zaczęło dostrzegać potrzebę ujednolicenia pola badań nad komórkami syntetycznymi, uznając, że zadanie zbudowania całego żywego organizmu z nieożywionych składników wykracza poza możliwości jednego kraju.
W 2017 r. rozpoczęto międzynarodową współpracę badawczą Build-a-Cell na dużą skalę w celu budowy syntetycznych żywych komórek, a następnie krajowe organizacje zajmujące się komórkami syntetycznymi w kilku krajach. Do tych organizacji krajowych należą FabriCell, MaxSynBio i BaSyC. Europejskie wysiłki na rzecz komórek syntetycznych zostały ujednolicone w 2019 r. jako inicjatywa SynCellEU.
Odgórne podejście do stworzenia minimalnej żywej komórki
Członkowie Instytutu J. Craiga Ventera zastosowali odgórne podejście obliczeniowe do wyeliminowania genów w żywym organizmie do minimalnego zestawu genów. W 2010 roku zespołowi udało się stworzyć replikujący szczep Mycoplasma mycoides ( laboratorium Mycoplasma laboratorium ) przy użyciu syntetycznie wytworzonego DNA uznanego za minimum życia, które zostało wprowadzone do genomowo pustej bakterii. Oczekuje się, że proces odgórnej biosyntezy umożliwi wprowadzenie nowych genów, które pełniłyby opłacalne funkcje, takie jak wytwarzanie wodoru do paliwa czy wychwytywanie nadmiaru dwutlenku węgla w atmosferze. Niezliczone sieci regulatorowe, metaboliczne i sygnalizacyjne nie są w pełni scharakteryzowane. Te odgórne podejścia mają ograniczenia w zrozumieniu podstawowej regulacji molekularnej, ponieważ organizmy gospodarzy mają złożony i niekompletnie zdefiniowany skład molekularny. W 2019 roku opublikowano kompletny model obliczeniowy wszystkich szlaków w komórce Mycoplasma Syn3.0, reprezentujący pierwszy kompletny model in silico dla żywego organizmu minimalnego.
Duże inwestycje w biologię poczyniły duże firmy, takie jak ExxonMobil , który nawiązał współpracę z Synthetic Genomics Inc ; Własna firma biosyntetyczna Craiga Ventera w rozwoju paliwa z alg.
Od 2016 r. Mycoplasma genitalium jest jedynym organizmem używanym jako punkt wyjścia do inżynierii minimalnej komórki, ponieważ ma najmniejszy znany genom, który można hodować w warunkach laboratoryjnych; odmiana typu dzikiego ma 482 genów, a usunięcie dokładnie 100 genów uznanych za nieistotne dało żywotny szczep o lepszych wskaźnikach wzrostu. Escherichia coli o zredukowanym genomie jest uważana za bardziej użyteczną, a żywe szczepy zostały opracowane z usuniętym 15% genomu.
Stworzono odmianę sztucznej komórki, w której do genomowo opróżnionych komórek gospodarza wprowadzono całkowicie syntetyczny genom . Chociaż nie jest to całkowicie sztuczne, ponieważ składniki cytoplazmatyczne oraz błona komórki gospodarza są zachowane, zmodyfikowana komórka jest pod kontrolą syntetycznego genomu i jest zdolna do replikacji .
Sztuczne ogniwa do zastosowań medycznych
Historia
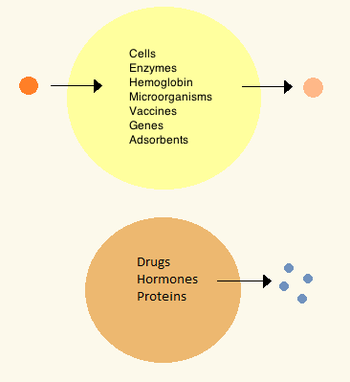
W latach 60. Thomas Chang opracował mikrokapsułki, które później nazwał „sztucznymi komórkami”, ponieważ były to przedziały wielkości komórki wykonane ze sztucznych materiałów. Komórki te składały się z ultracienkich błon z nylonu, kolodionu lub usieciowanego białka, których właściwości półprzepuszczalne umożliwiały dyfuzję małych cząsteczek do iz komórki. Komórki te były wielkości mikronów i zawierały komórki , enzymy , hemoglobinę , materiały magnetyczne , adsorbenty i białka .
Późniejsze sztuczne komórki miały rozmiary od stu mikrometrów do nanometrów i mogą przenosić mikroorganizmy, szczepionki , geny , leki, hormony i peptydy . Pierwszym klinicznym zastosowaniem sztucznych komórek była hemoperfuzja poprzez kapsułkowanie aktywowanego węgla drzewnego .
W latach 70. naukowcom udało się wprowadzić enzymy, białka i hormony do biodegradowalnych mikrokapsułek, co później doprowadziło do zastosowania klinicznego w takich chorobach, jak zespół Lescha-Nyhana . Chociaż początkowe badania Changa koncentrowały się na sztucznych czerwonych krwinkach , dopiero w połowie lat 90. opracowano biodegradowalne sztuczne krwinki czerwone. Sztuczne komórki w biologicznej enkapsulacji komórek zostały po raz pierwszy zastosowane w klinice w 1994 roku w leczeniu pacjentów z cukrzycą i od tego czasu inne typy komórek, takie jak hepatocyty , dorosłe komórki macierzyste i komórki genetycznie zmodyfikowane zostały otoczone i są badane pod kątem wykorzystania w regeneracji tkanek .
Materiały
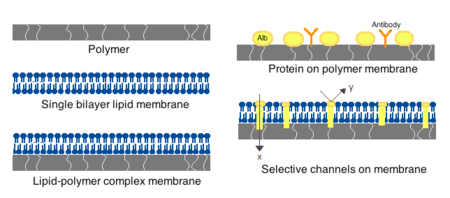
Membrany do sztucznych komórek mogą być wykonane z prostych polimerów , usieciowanych białek, błon lipidowych lub kompleksów polimerowo-lipidowych. Ponadto membrany mogą być tak skonstruowane, aby prezentowały białka powierzchniowe , takie jak albumina , antygeny , nośniki Na/K-ATPazy lub pory, takie jak kanały jonowe . Powszechnie stosowane materiały do produkcji membran obejmują polimery hydrożelowe, takie jak alginian , celuloza i polimery termoplastyczne, takie jak metakrylan hydroksyetylu-metakrylan metylu (HEMA-MMA), poliakrylonitryl-chlorek poliwinylu (PAN-PVC), a także odmiany powyższych: wzmiankowany. Zastosowany materiał określa przepuszczalność błony komórkowej, która dla polimeru zależy od odcięcia masy cząsteczkowej (MWCO). MWCO to maksymalna masa cząsteczkowa cząsteczki, która może swobodnie przechodzić przez pory i jest ważna przy określaniu odpowiedniej dyfuzji składników odżywczych, odpadów i innych krytycznych cząsteczek. Polimery hydrofilowe mogą być biokompatybilne i można je wytwarzać w różnych postaciach, które obejmują micele polimerowe , mieszaniny zol-żel , mieszanki fizyczne oraz usieciowane cząstki i nanocząstki. Szczególnie interesujące są polimery reagujące na bodźce, które reagują na zmiany pH lub temperatury do zastosowania w dostarczaniu docelowym. Polimery te można podawać w postaci płynnej przez wstrzyknięcie makroskopowe i zestalać się lub żelować in situ ze względu na różnicę pH lub temperatury. Preparaty nanocząsteczkowe i liposomowe są również rutynowo stosowane do enkapsulacji i dostarczania materiału. Główną zaletą liposomów jest ich zdolność do łączenia się z błonami komórkowymi i organellami .
Przygotowanie
Opracowano wiele odmian do przygotowania i enkapsulacji sztucznych komórek. Zazwyczaj syntetyzuje się pęcherzyki, takie jak nanocząstka , polimerosom lub liposom . Emulsja jest typowo wytwarzana przy użyciu sprzętu wysokociśnieniowego, takiego jak homogenizator wysokociśnieniowy lub mikrofluidyzator . Poniżej opisano również dwie metody mikrokapsułkowania nitrocelulozy.
Homogenizacja wysokociśnieniowa
W homogenizatorze wysokociśnieniowym dwie ciecze w zawiesinie olej/ciecz są przeciskane przez mały otwór pod bardzo wysokim ciśnieniem. Proces ten dzieli produkty i pozwala na tworzenie bardzo drobnych cząstek, o wielkości zaledwie 1 nm.
Mikrofluidyzacja
Ta technika wykorzystuje opatentowany mikrofluidyzator, aby uzyskać większą ilość jednorodnych zawiesin, które mogą tworzyć mniejsze cząstki niż homogenizatory. Homogenizator jest najpierw używany do wytworzenia grubej zawiesiny, która jest następnie pompowana do mikrofluidyzatora pod wysokim ciśnieniem. Przepływ jest następnie rozdzielany na dwa strumienie, które będą reagowały z bardzo dużymi prędkościami w komorze oddziaływań, aż do uzyskania pożądanej wielkości cząstek. Technika ta pozwala na produkcję na dużą skalę liposomów fosfolipidowych i kolejnych nanokapsułek materiałowych.
Metoda upuszczania
W tej metodzie roztwór komórkowy wprowadza się kroplami do kolodionowego roztworu azotanu celulozy. Gdy kropla przechodzi przez kolodion, jest pokryta membraną dzięki właściwościom polimeryzacji międzyfazowej kolodionu. Komórka osadza się później w parafinie, gdzie błona zestala się i ostatecznie zostaje zawieszona w roztworze soli fizjologicznej. Metoda kroplowa służy do tworzenia dużych sztucznych komórek, które zawierają komórki biologiczne, komórki macierzyste i komórki macierzyste poddane inżynierii genetycznej.
Metoda emulsyjna
Metoda emulsyjna różni się tym, że kapsułkowany materiał jest zwykle mniejszy i jest umieszczany na dnie komory reakcyjnej, gdzie kolodion jest dodawany na górze i odwirowywany lub w inny sposób zakłócany w celu wytworzenia emulsji. Kapsułkowany materiał jest następnie dyspergowany i zawieszany w roztworze soli.
Znaczenie kliniczne
Uwalnianie i dostarczanie leków
Sztuczne komórki stosowane do dostarczania leku różnią się od innych sztucznych komórek, ponieważ ich zawartość ma dyfundować z błony lub być pochłonięta i strawiona przez docelową komórkę gospodarza. Często używane są submikronowe, sztuczne komórki z błoną lipidową, które mogą być określane jako nanokapsułki, nanocząstki, polimerosomy lub inne odmiany tego terminu.
Terapia enzymatyczna
Terapia enzymatyczna jest aktywnie badana pod kątem genetycznych chorób metabolicznych, w których enzym jest nadmiernie, niedostatecznie ekspresjonowany, wadliwy lub w ogóle nie występuje. W przypadku niedostatecznej ekspresji lub ekspresji wadliwego enzymu , do organizmu wprowadzana jest aktywna forma enzymu w celu skompensowania deficytu. Z drugiej strony, nadekspresji enzymatycznej można przeciwdziałać przez wprowadzenie konkurującego niefunkcjonalnego enzymu; to znaczy enzym, który metabolizuje substrat do nieaktywnych produktów. Po umieszczeniu w sztucznej komórce enzymy mogą pełnić swoją funkcję przez znacznie dłuższy czas w porównaniu do wolnych enzymów i mogą być dalej optymalizowane przez sprzęganie polimerów.
Pierwszym enzymem badanym w sztucznej enkapsulacji komórek była asparaginaza do leczenia mięsaka limfatycznego u myszy. To leczenie opóźniło początek i wzrost guza . Te wstępne odkrycia doprowadziły do dalszych badań nad wykorzystaniem sztucznych komórek do dostarczania enzymów w czerniakach zależnych od tyrozyny . Te nowotwory są bardziej zależne od tyrozyny niż normalne komórki pod względem wzrostu, a badania wykazały, że obniżenie ogólnoustrojowego poziomu tyrozyny u myszy może hamować wzrost czerniaka. Wykorzystanie sztucznych komórek w dostarczaniu tyrozynazy ; oraz enzym, który trawi tyrozynę, pozwala na lepszą stabilność enzymu i wykazuje skuteczność w usuwaniu tyrozyny bez poważnych skutków ubocznych związanych z deprawacją tyrozyny w diecie.
Terapia enzymami sztucznymi komórkami jest również interesująca dla aktywacji proleków, takich jak ifosfamid, w niektórych nowotworach. Sztuczne komórki zawierające enzym cytochrom p450, który przekształca ten prolek w aktywny lek, mogą być przystosowane do akumulacji w raku trzustki lub wszczepiania sztucznych komórek w pobliżu miejsca guza. Tutaj lokalne stężenie aktywowanego ifosfamidu będzie znacznie wyższe niż w pozostałej części organizmu, zapobiegając w ten sposób toksyczności ogólnoustrojowej . Leczenie było skuteczne u zwierząt i wykazało podwojenie mediany przeżycia wśród pacjentów z zaawansowanym rakiem trzustki w badaniach klinicznych I/II fazy oraz potrojenie rocznego wskaźnika przeżycia.
Terapia genowa
W leczeniu chorób genetycznych terapia genowa ma na celu wprowadzenie, zmianę lub usunięcie genów w komórkach chorego osobnika. Technologia w dużej mierze opiera się na wektorach wirusowych, co budzi obawy dotyczące mutagenezy insercyjnej i ogólnoustrojowej odpowiedzi immunologicznej , które w badaniach klinicznych doprowadziły do zgonów ludzi i rozwoju białaczki . Obejście potrzeby wektorów przez zastosowanie nagiego lub plazmidowego DNA jako własnego systemu dostarczania również napotyka problemy, takie jak niska wydajność transdukcji i słabe ukierunkowanie na tkankę przy podawaniu ogólnoustrojowym.
Zaproponowano sztuczne komórki jako wektor niewirusowy, za pomocą którego genetycznie zmodyfikowane nieautologiczne komórki są kapsułkowane i wszczepiane w celu dostarczenia rekombinowanych białek in vivo . Ten rodzaj immunoizolacji okazał się skuteczny u myszy poprzez dostarczanie sztucznych komórek zawierających mysi hormon wzrostu, który ratował opóźnienie wzrostu u zmutowanych myszy. Kilka strategii zostało wprowadzonych do badań klinicznych na ludziach w leczeniu raka trzustki , stwardnienia bocznego i kontroli bólu.
Hemoperfuzja
Pierwszym klinicznym zastosowaniem sztucznych komórek była hemoperfuzja poprzez kapsułkowanie aktywowanego węgla drzewnego . Węgiel aktywowany ma zdolność adsorpcji wielu dużych cząsteczek i od dawna znany jest ze swojej zdolności do usuwania toksycznych substancji z krwi w przypadku przypadkowego zatrucia lub przedawkowania. Jednak perfuzja poprzez bezpośrednie podanie węgla drzewnego jest toksyczna, ponieważ prowadzi do zatorów i uszkodzenia komórek krwi, a następnie usunięcia płytek krwi. Sztuczne komórki pozwalają toksynom dyfundować do komórki, jednocześnie utrzymując niebezpieczny ładunek w ultracienkiej błonie.
Zaproponowano sztuczną hemoperfuzję komórek jako mniej kosztowną i bardziej wydajną opcję detoksykacji niż hemodializa , w której filtrowanie krwi odbywa się tylko poprzez oddzielenie wielkości przez fizyczną membranę. W hemoperfuzji tysiące adsorbujących sztucznych komórek jest zatrzymywanych w małym pojemniku dzięki zastosowaniu dwóch ekranów na każdym końcu, przez które perfuzja krwi pacjenta . Gdy krew krąży, toksyny lub leki dyfundują do komórek i są zatrzymywane przez materiał absorbujący. Błony sztucznych komórek są znacznie cieńsze od stosowanych w dializie, a ich mały rozmiar powoduje, że mają dużą powierzchnię membrany . Oznacza to, że część komórki może mieć teoretyczny transfer masy stokrotnie wyższy niż w przypadku całej maszyny ze sztuczną nerką. Urządzenie zostało uznane za rutynową metodę kliniczną dla pacjentów leczonych z powodu przypadkowego lub samobójczego zatrucia, ale zostało również wprowadzone jako terapia niewydolności wątroby i nerek poprzez wykonywanie części funkcji tych narządów. Zaproponowano również sztuczną hemoperfuzję komórek do zastosowania w immunoadsorpcji, dzięki której przeciwciała mogą być usuwane z organizmu przez dołączenie materiału immunoadsorpcyjnego, takiego jak albumina, na powierzchni sztucznych komórek. Zasada ta została wykorzystana do usuwania przeciwciał grup krwi z osocza do przeszczepu szpiku kostnego oraz do leczenia hipercholesterolemii za pomocą przeciwciał monoklonalnych w celu usunięcia lipoprotein o małej gęstości . Hemoperfuzja jest szczególnie przydatna w krajach o słabym przemyśle produkcji hemodializy, ponieważ urządzenia są tam tańsze i stosowane u pacjentów z niewydolnością nerek .
Zamknięte komórki
Najpopularniejszą metodą przygotowania sztucznych komórek jest enkapsulacja komórek . Kapsułkowane komórki są zazwyczaj uzyskiwane poprzez wytwarzanie kropelek o kontrolowanej wielkości z płynnej zawiesiny komórek, które następnie szybko zestalają się lub żelują, aby zapewnić dodatkową stabilność. Stabilizację można osiągnąć poprzez zmianę temperatury lub poprzez sieciowanie materiału. Mikrośrodowisko, które komórka widzi, zmienia się po enkapsulacji. Zwykle przechodzi od monowarstwy do zawiesiny w polimerowym rusztowaniu w polimerowej membranie. Wadą tej techniki jest to, że kapsułkowanie komórki zmniejsza jej żywotność oraz zdolność do proliferacji i różnicowania. Co więcej, po pewnym czasie w mikrokapsułce komórki tworzą skupiska, które hamują wymianę tlenu i odpadów metabolicznych, prowadząc do apoptozy i martwicy, ograniczając w ten sposób skuteczność komórek i aktywując układ odpornościowy gospodarza . Sztuczne komórki z powodzeniem przeszczepiają wiele komórek, w tym wysepki Langerhansa do leczenia cukrzycy , komórki przytarczyc i komórki kory nadnerczy.
Hepatocyty otoczkowane
Niedobór dawców narządów sprawia, że sztuczne komórki odgrywają kluczową rolę w alternatywnych terapiach niewydolności wątroby . Zastosowanie sztucznych komórek do przeszczepu hepatocytów wykazało wykonalność i skuteczność w zapewnianiu funkcji wątroby w modelach chorób wątroby zwierząt i urządzeniach do biosztucznej wątroby . Badania wywodziły się z eksperymentów, w których hepatocyty były przyczepione do powierzchni mikronośnika i przekształciły się w hepatocyty zamknięte w trójwymiarowej matrycy w mikrokropelkach alginianu pokrytych zewnętrzną warstwą polilizyny . Kluczową zaletą tej metody dostarczania jest omijanie terapii immunosupresyjnej w czasie trwania leczenia. Zaproponowano zastosowanie enkapsulacji hepatocytów w biosztucznej wątrobie . Urządzenie składa się z cylindrycznej komory wypełnionej izolowanymi hepatocytami, przez którą osocze pacjenta krąży poza ciałem w rodzaju hemoperfuzji . Ponieważ mikrokapsułki mają wysoki stosunek powierzchni do objętości , zapewniają dużą powierzchnię do dyfuzji substratu i mogą pomieścić dużą liczbę hepatocytów. Leczenie myszy z indukowaną niewydolnością wątroby wykazało znaczny wzrost wskaźnika przeżycia. Systemy sztucznej wątroby są wciąż na wczesnym etapie rozwoju, ale wykazują potencjał dla pacjentów oczekujących na przeszczep narządu lub gdy własna wątroba pacjenta regeneruje się na tyle, aby powrócić do normalnego funkcjonowania. Do tej pory badania kliniczne z wykorzystaniem sztucznych układów wątroby i przeszczepiania hepatocytów w schyłkowych chorobach wątroby wykazały poprawę wskaźników zdrowotnych, ale jeszcze nie poprawiły przeżywalności. Krótka żywotność i agregacja sztucznych hepatocytów po przeszczepie to główne przeszkody, jakie napotykamy. Hepatocyty koenkapsulowane z komórkami macierzystymi wykazują większą żywotność w hodowli, a po wszczepieniu i wszczepieniu samych sztucznych komórek macierzystych również wykazywały regenerację wątroby. W związku z tym pojawiło się zainteresowanie wykorzystaniem komórek macierzystych do enkapsulacji w medycynie regeneracyjnej .
Zamknięte komórki bakteryjne
Zaproponowano doustne przyjmowanie żywych kolonii komórek bakteryjnych i jest ono obecnie stosowane w terapii między innymi w celu modulowania mikroflory jelitowej , zapobiegania chorobom biegunkowym , leczenia infekcji H. Pylori , atopowych stanów zapalnych, nietolerancji laktozy i modulacji odporności . Proponowany mechanizm działania nie jest w pełni zrozumiały, ale uważa się, że ma dwa główne skutki. Pierwszy to efekt odżywczy, w którym bakterie konkurują z bakteriami wytwarzającymi toksyny. Drugi to efekt sanitarny, który stymuluje odporność na kolonizację i stymuluje odpowiedź immunologiczną . Doustne dostarczanie kultur bakteryjnych jest często problemem, ponieważ są one atakowane przez układ odpornościowy i często niszczone po podaniu doustnym. Sztuczne komórki pomagają rozwiązać te problemy, zapewniając organizmowi mimikę i selektywne lub długotrwałe uwalnianie, zwiększając w ten sposób żywotność bakterii docierających do układu pokarmowego . Ponadto można zaprojektować enkapsulację żywych komórek bakteryjnych, aby umożliwić dyfuzję małych cząsteczek, w tym peptydów, do organizmu w celach terapeutycznych. Błony, które okazały się skuteczne w dostarczaniu bakterii, obejmują octan celulozy i warianty alginianu . Dodatkowe zastosowania, które powstały w wyniku enkapsulacji komórek bakteryjnych, obejmują ochronę przed prowokacją M. tuberculosis i regulację w górę komórek wydzielających Ig z układu odpornościowego. Technologia jest ograniczona przez ryzyko infekcji ogólnoustrojowych, niekorzystnej aktywności metabolicznej oraz ryzyko transferu genów. Jednak większym wyzwaniem pozostaje dostarczenie wystarczającej ilości żywych bakterii do miejsca będącego przedmiotem zainteresowania.
Sztuczne krwinki jako nośniki tlenu
Nośniki tlenu o rozmiarach nano są stosowane jako rodzaj zamienników czerwonych krwinek , chociaż brakuje im innych składników czerwonych krwinek. Składają się z syntetycznego polimersomu lub sztucznej błony otaczającej oczyszczoną hemoglobinę zwierzęcą, ludzką lub rekombinowaną . Ogólnie rzecz biorąc, dostarczanie hemoglobiny nadal stanowi wyzwanie, ponieważ jest wysoce toksyczne, gdy jest dostarczane bez żadnych modyfikacji. W niektórych badaniach klinicznych obserwowano działanie wazopresyjne.
Sztuczne czerwone krwinki
Zainteresowanie badawcze wykorzystaniem sztucznych komórek do wytwarzania krwi pojawiło się po strachu przed AIDS w latach 80-tych. Oprócz omijania możliwości przenoszenia chorób, pożądane są sztuczne czerwone krwinki, ponieważ eliminują one wady związane z transfuzjami krwi allogenicznej, takie jak typowanie krwi, reakcje immunologiczne i krótki okres przechowywania wynoszący 42 dni. Hemoglobiny zastępczy może być przechowywana w temperaturze pokojowej, a nie w lodówce przez okres dłuższy niż rok. Podjęto próby opracowania w pełni działającej krwinki czerwonej, która zawiera węgiel nie tylko nośnik tlenu, ale także enzymy związane z komórką. Pierwszą próbę podjęto w 1957 r., zastępując błonę krwinek czerwonych ultracienką membraną polimerową, po której nastąpiła enkapsulacja przez błonę lipidową, a ostatnio biodegradowalną membranę polimerową. Biologiczna błona krwinek czerwonych zawierająca lipidy i związane z nimi białka może być również stosowana do enkapsulacji nanocząstek i wydłużenia czasu przebywania in vivo poprzez ominięcie wychwytu makrofagów i klirensu ogólnoustrojowego.
Sztuczne leukopolimery
Leukopolimersom jest polimerosomem zaprojektowanym tak , aby mieć właściwości adhezyjne leukocytów . Polimersomy to pęcherzyki składające się z dwuwarstwowego arkusza, który może zawierać wiele aktywnych cząsteczek, takich jak leki lub enzymy . Poprzez dodanie właściwości adhezyjnych leukocytów do ich błon, mogą one spowolnić lub toczyć się wzdłuż ścian nabłonka w szybko przepływającym układzie krążenia .
Niekonwencjonalne rodzaje sztucznych komórek
Elektroniczna sztuczna komórka
Koncepcja elektronicznej sztucznej komórki została rozszerzona w serii 3 projektów UE koordynowanych przez Johna McCaskill w latach 2004-2015.
Komisja Europejska sponsoruje rozwój Evolution programu Programowalny Sztuczne komórki (PACE) od 2004 do 2008 roku, którego celem było stworzenie podstaw do powstania „mikroskopowej samoorganizacji, samo-replikację i evolvable podmiotów autonomicznych zbudowany z prostych organicznych i substancje nieorganiczne, które można genetycznie zaprogramować do wykonywania określonych funkcji” w celu ewentualnej integracji z systemami informacyjnymi. W ramach projektu PACE opracowano pierwszą maszynę Omega, mikroprzepływowy system podtrzymywania życia dla sztucznych komórek, który mógłby uzupełnić brakujące chemicznie funkcje (jak pierwotnie zaproponowali Norman Packard, Steen Rasmussen, Mark Beadau i John McCaskill). Ostatecznym celem było uzyskanie ewoluującej komórki hybrydowej w złożonym, programowalnym środowisku w mikroskali. Funkcje Maszyny Omega można następnie stopniowo usuwać, co stawia przed chemią sztucznych komórek szereg możliwych do rozwiązania wyzwań ewolucyjnych. W ramach projektu osiągnięto integrację chemiczną do poziomu par trzech podstawowych funkcji sztucznych komórek (podsystem genetyczny, system hermetyzacji i system metaboliczny) oraz wygenerowano nowe, przestrzennie rozdzielone programowalne środowiska mikroprzepływowe do integracji hermetyczności i wzmocnienia genetycznego. Projekt doprowadził do powstania Europejskiego Centrum Technologii Życia.
W następstwie tych badań, w 2007 roku John McCaskill zaproponował skoncentrowanie się na elektronicznie uzupełnionej sztucznej komórce, zwanej Electronic Chemical Cell. Kluczowym pomysłem było zastosowanie masowo równoległego układu elektrod połączonych z lokalnie dedykowanymi obwodami elektronicznymi w dwuwymiarowej cienkiej warstwie, aby uzupełnić nową chemiczną funkcjonalność komórkową. Lokalne informacje elektroniczne określające obwody przełączania i wykrywania elektrod mogą służyć jako genom elektroniczny uzupełniający sekwencyjne informacje molekularne w powstających protokołach. Propozycja badawcza odniosła sukces w Komisji Europejskiej, a międzynarodowy zespół naukowców częściowo pokrywający się z konsorcjum PACE rozpoczął prace w latach 2008-2012 nad projektem Elektroniczne Komórki Chemiczne. Projekt wykazał między innymi, że elektronicznie sterowany lokalny transport określonych sekwencji może zostać wykorzystany jako sztuczny przestrzenny system kontroli proliferacji genetycznej przyszłych sztucznych komórek oraz że podstawowe procesy metabolizmu mogą być realizowane za pomocą odpowiednio pokrytych matryc elektrod.
Głównym ograniczeniem tego podejścia, poza początkowymi trudnościami w opanowaniu elektrochemii i elektrokinetyki w mikroskali, jest to, że układ elektroniczny jest połączony jako sztywny, nieautonomiczny element makroskopowego sprzętu. W 2011 roku McCaskill zaproponował odwrócenie geometrii elektroniki i chemii: zamiast umieszczania substancji chemicznych w aktywnym medium elektronicznym, umieścić mikroskopijną autonomiczną elektronikę w medium chemicznym. Zorganizował projekt mający na celu rozwiązanie problemu trzeciej generacji elektronicznych sztucznych komórek w skali 100 µm, które mogłyby samoistnie składać się z dwóch półkomórek „labletek”, aby zamknąć wewnętrzną przestrzeń chemiczną i funkcjonować za pomocą aktywnej elektroniki zasilanej przez medium są w niej zanurzone. Takie komórki mogą kopiować zarówno swoją zawartość elektronową, jak i chemiczną i będą zdolne do ewolucji w ramach ograniczeń zapewnianych przez ich specjalne, wstępnie zsyntetyzowane, mikroskopijne cegiełki budulcowe. We wrześniu 2012 rozpoczęto prace nad tym projektem.
Jeewanu
Protokomórki Jeewanu są syntetycznymi cząstkami chemicznymi, które mają strukturę komórkową i wydają się mieć pewne funkcjonalne właściwości życiowe. Po raz pierwszy zsyntetyzowany w 1963 roku z prostych minerałów i podstawowych substancji organicznych wystawionych na działanie promieni słonecznych , nadal wykazuje pewne zdolności metaboliczne, obecność półprzepuszczalnej błony , aminokwasów , fosfolipidów , węglowodanów i cząsteczek podobnych do RNA. Jednak natura i właściwości Jeewanu pozostają do wyjaśnienia.
Zobacz też
- Protokół
- Biologia syntetyczna
- Sztuczne życie
- Ukierunkowane dostarczanie leków
- Respirocyt
- Chemoton
- Jeewanu
- Budowanie komórki
Bibliografia
Zewnętrzne linki
- Sztuczne komórki, substytuty krwi i biotechnologia Journal of Artificial Cells Blood Substitute and Biotechnology