Płyta neuronowa - Neural plate
| Płyta neuronowa | |
|---|---|
 Grzebień neuronowy
| |
| Detale | |
| Etap Carnegie | 9 |
| Dni | 19 |
| Prekursor | ektoderma |
| Daje początek | fałdy nerwowe |
| System | System nerwowy |
| Identyfikatory | |
| łacina | blaszka nerwowa |
| Siatka | D054258 |
| TE | tablica_by_E5.13.1.0.1.0.1 E5.13.1.0.1.0.1 |
| Terminologia anatomiczna | |
Płyta neuronowa jest kluczowym struktura rozwojowy, który służy jako podstawa dla układu nerwowego. Naprzeciwko prymitywnej smugi w zarodku tkanka ektodermalna pogrubia się i spłaszcza, stając się płytką nerwową. Obszar przed węzłem pierwotnym można ogólnie nazwać płytką nerwową. W tym procesie komórki nabierają kolumnowego wyglądu, ponieważ wydłużają się i zwężają. Końce płytki nerwowej, zwane fałdami nerwowymi , popychają końce płytki do góry i razem, składając się w cewę nerwową , strukturę kluczową dla rozwoju mózgu i rdzenia kręgowego. Ten proces jako całość nazywa się neurulacją pierwotną .
Białka sygnałowe są również ważne w rozwoju płytki nerwowej i pomagają różnicować tkankę, która ma stać się płytką nerwową. Przykłady takich białek obejmują białka morfogenetyczne kości i kadheryny . Ekspresja tych białek jest niezbędna do fałdowania płytki nerwowej i późniejszego tworzenia cewy nerwowej .
Zaangażowanie w neurację pierwotną
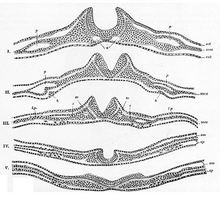
Ogólnie podzielony na cztery, proces pierwotnej neurulacji obejmuje płytkę nerwową w pierwszych trzech etapach. Tworzenie i fałdowanie płytki nerwowej jest pierwszym krokiem w neurulacji pierwotnej. Następnie następuje udoskonalenie i wzrost komórek płytki nerwowej. Trzeci etap pierwotnej neurulacji nie obejmuje samej płytki nerwowej, ale raczej krawędzie płytki nerwowej, które łączą się, zamieniając płytkę w początek cewy nerwowej . Po złożeniu płytki nerwowej w rurkę fałdy nerwowe łączą się, aby zakończyć fuzję cewy nerwowej. Proces ten jest zilustrowany na rysunku po prawej stronie, gdzie płytka nerwowa jest zaznaczona na fioletowo. Limonkowa zieleń oznacza krawędzie płytki nerwowej, które stają się fałdami nerwowymi, zaangażowanymi w fałdowanie płytki w celu utworzenia cewy nerwowej. Rysunek przedstawia rozwój płytki nerwowej w cewce nerwowej, skąd pochodzą również komórki grzebienia nerwowego .
W neurulacji pierwotnej warstwa ektodermy dzieli się na trzy zestawy komórek: cewę nerwową (przyszły mózg i rdzeń kręgowy), naskórek (skóra) i komórki grzebienia nerwowego (łączą naskórek i cewę nerwową i migrują, tworząc neurony , glej , i pigmentacja komórek skóry).
Rozwój
Na etapie tworzenia płytki nerwowej zarodek składa się z trzech warstw komórkowych: ektodermy, która ostatecznie tworzy skórę i tkanki nerwowe, mezodermy, która tworzy mięśnie i kości oraz endodermy, z której będą powstawać komórki wyściełające przewód pokarmowy i oddechowy. Komórki progenitorowe, które tworzą prekursory tkanek nerwowych w płytce nerwowej, nazywane są komórkami neuroepitelialnymi .
Rozciągnięte na strunie grzbietowej komórki ektodermalne na grzbietowej części zarodka są ostatecznie tymi, które tworzą płytkę nerwową. Około połowa tych komórek zostanie indukowana do pozostania ektodermą, podczas gdy druga połowa utworzy płytkę nerwową.
Istnieją cztery etapy tworzenia płytki nerwowej i cewy nerwowej: formowanie, zginanie, zbieżność i zamykanie. Tworzenie płytki nerwowej rozpoczyna się, gdy mezoderma grzbietowa sygnalizuje znajdującym się nad nią komórkom ektodermalnym, aby wydłużyły się do kolumnowych komórek płytki nerwowej. Ten inny kształt odróżnia komórki przypuszczalnej płytki nerwowej od innych komórek przednaskórkowych. Jeśli płytka nerwowa zostanie oddzielona sama, nadal będzie się rozwijać, tworząc cieńszą płytkę, ale nie utworzy cewy nerwowej. Jeśli obszar zawierający przypuszczalny naskórek i tkankę płytki nerwowej zostanie wyizolowany, utworzą się małe fałdy nerwowe . Niezbędne jest wydłużenie, które zachodzi podczas formowania się płytki nerwowej i zamykania cewy nerwowej ; widać, że zamykające się obszary cewy nerwowej mają bardzo zwiększoną aktywność wydłużania w linii środkowej w porównaniu z już zamkniętymi obszarami, gdy płytka zaczynała się kształtować w rurkę.
Wygięcie płytki nerwowej polega na utworzeniu zawiasów, w których płytka nerwowa łączy się z otaczającymi tkankami. Linia środkowa płytki nerwowej odnosi się do środkowego punktu zawiasowego (MHP). Komórki w tym obszarze, znane jako przyśrodkowe komórki punktu zawiasowego, ze względu na ich zaangażowanie w tę strukturę, są ustabilizowane i połączone ze struną grzbietową. Pochodzą one z obszaru płytki nerwowej znajdującej się przed pierwotnym węzłem. Struna grzbietowa rozpocznie zmiany kształtu w komórkach MHP. Komórki te zmniejszą się i przybiorą kształt klina. Inny typ punktu zawiasowego występuje grzbietowo-bocznie, określany jako grzbietowo-boczny punkt zawiasowy (DLHP). Regiony te bruzdają się i zmieniają kształt w taki sam sposób, jak robią to komórki MHP, zanim połączą się ze sobą, tworząc cewę nerwową. W eksperymencie zaobserwowano, że bez struny grzbietowej charakterystyka MHP nie rozwijała się prawidłowo, więc formacja płytki nerwowej i cewy nerwowej nie przebiegała prawidłowo. Komunikacja między płytką nerwową a struną grzbietową jest ważna dla przyszłej indukcji i tworzenia cewy nerwowej.
Zamknięcie cewy nerwowej jest zakończone, gdy fałdy nerwowe są połączone, przylegając do siebie. Podczas gdy komórki, które pozostają jako cewa nerwowa, tworzą mózg i rdzeń kręgowy, inne komórki, które były częścią płytki nerwowej, migrują z cewy nerwowej jako komórki grzebienia nerwowego. Po przejściu nabłonkowo- mezenchymalnym komórki te tworzą autonomiczny układ nerwowy i pewne komórki obwodowego układu nerwowego .
Sygnalizacja komórkowa i niezbędne białka
Kluczem do prawidłowego fałdowania i funkcji płytki nerwowej jest N-kadheryna, rodzaj białka kadheryny związanego z układem nerwowym. N-kadheryna ma kluczowe znaczenie dla utrzymywania razem komórek płytek nerwowych. Ponadto komórki, które mają stać się komórkami płytki nerwowej, wyrażają cząsteczkę adhezyjną komórek nerwowych (NCAM) w celu dalszej spójności płytki nerwowej. Inna kadheryna, E-kadheryna, jest wyrażana przez komórki ektodermalne w procesie rozwoju płytki nerwowej.

Białko morfogenetyczne kości 4 lub BMP4 jest transformującym czynnikiem wzrostu, który powoduje różnicowanie się komórek ektodermy w komórki skóry. Bez BMP4 komórki ektodermy rozwinęłyby się w komórki nerwowe. Osiowe komórki mezodermy pod ektodermy wydzielają sygnałów hamujących zwanych chordyna , kubek i folistatyna . Te sygnały hamujące zapobiegają działaniu BMP4, które normalnie powodowałoby ektodermę komórek; w rezultacie leżące nad nimi komórki przyjmują normalny przebieg i rozwijają się w komórki nerwowe. Komórki w ektodermie, które otaczają te komórki nerwowe, nie otrzymują sygnałów inhibitora BMP4, w wyniku czego BMP4 indukuje rozwój tych komórek w komórki skóry.
Specyfikatory granicy płytki neuronalnej są indukowane jako zestaw czynników transkrypcyjnych. Dystalne-5, PAX3 i PAX7 zapobiegają przekształceniu obszaru granicznego w płytkę nerwową lub naskórek. Indukują one drugi zestaw czynników transkrypcyjnych zwanych specyfikatorami grzebienia nerwowego, które powodują, że komórki stają się komórkami grzebienia nerwowego .
W nowo utworzonej płytki nerwowej, Pax3 mRNA MSX1 mRNA i MSX1 / MSX2 białka są wyrażane mediolaterally. Kiedy płytka nerwowa zaczyna się fałdować, obszary rostralne płytki nerwowej nie wyrażają białek Pax3 i MSX. Obszary ogonowe do zamknięcia cewy nerwowej mają ekspresję PAX3 i MSX ograniczoną do bocznych obszarów fałdów nerwowych. Te fluktuacje w ekspresji mRNA i białek nawiązują do ich roli w różnicowaniu komórek płytek nerwowych.
Niskie poziomy pSMAD 1, 5, 8 umożliwiają większą mobilność w środkowym punkcie zawiasowym niż w komórkach bocznej płytki nerwowej. Ta elastyczność umożliwia obracanie i zawiasowanie, co umożliwia wyboczenie i podniesienie płytki nerwowej podczas formatowania cewy nerwowej . Płytka nerwowa musi być wystarczająco sztywna, aby mogły wystąpić ruchy morfogeniczne, a jednocześnie na tyle elastyczna, aby podlegała zmianom kształtu i położenia w celu przekształcenia w cewę nerwową .
Inne zwierzęta
Cewka nerwowa zamyka się w różny sposób u różnych gatunków, przy czym rozróżnienie między ludźmi a kurczakami jest jednym z najbardziej zbadanych. U ludzi cewa nerwowa łączy się z centralnym obszarem zarodka i przesuwa się na zewnątrz. U kur zamknięcie cewy nerwowej zaczyna się w przyszłym regionie śródmózgowia i zamyka się w obu kierunkach. U ptaków i ssaków zamknięcie nie następuje jednocześnie.
W zarodkach traszek i płazów uogólnionych podział komórek nie odgrywa kluczowej roli w morfogenezie. Komórki zarodkowe traszki są znacznie większe i wykazują pigmentację jaja, aby odróżnić komórki od siebie. Płytka nerwowa traszki podwaja swoją długość, zmniejsza się szerokość wierzchołkową i zwiększa grubość. Krawędzie płytki unoszą się grzbietowo i zaginają w kierunku linii środkowej, tworząc cewę nerwową. Powierzchnia wierzchołkowa zmniejsza się.
W embrionach kurzych, podczas gdy płytka nerwowa wydłuża się i zmniejsza szerokość wierzchołkową, grubość płytki nie zmienia się drastycznie. W miarę jak płytka nerwowa przechodzi przez stadia Hamburgera-Hamiltona , płytka gęstnieje do około HH6-7, kiedy płytka nerwowa zaczyna się składać w rurkę. Powierzchnia wierzchołkowa zwiększa się podczas neurulacji, w przeciwieństwie do zarodków płazów. W zarodkach myszy po obu stronach środka płytki znajduje się duża wypukła krzywizna. Ta krzywa musi zostać odwrócona, gdy płyta toczy się razem, tworząc cewę nerwową.
Badania
Badania nad płytką nerwową rozpoczęły się na poważnie od przyjrzenia się determinacji ektodermy i jej zaangażowaniu w ścieżkę neuronalną. Wraz z rozwojem technik badawczych i laboratoryjnych nastąpił znaczny postęp w badaniach nad neurulacją oraz rozwojem i rolą płytki nerwowej w rosnącym zarodku. Stosowanie takich technik różni się w zależności od etapu rozwoju i ogólnych celów badawczych, ale obejmuje takie metody, jak znakowanie i przeszczepianie komórek .
Etykietowanie komórek
Proces hybrydyzacji in situ (ISH) następuje po znakowaniu sekwencji DNA lub RNA , która służy jako antysensowna sonda mRNA , komplementarna do sekwencji mRNA w zarodku. Znakowanie barwnikiem fluorescencyjnym lub znacznikiem radioaktywnym pozwala na wizualizację sondy i jej lokalizacji w zarodku. Ta technika jest użyteczna, ponieważ ujawnia określone obszary ekspresji genów w tkance, jak również w całym zarodku poprzez hybrydyzację typu „cały mount” in situ. Technika ta jest często wykorzystywana w określaniu ekspresji genów niezbędnych do prawidłowego rozwoju zarodka. Oznaczenie określonych genów w rozwijającym się zarodku pozwala na określenie dokładnego czasu i miejsca, w którym gen jest aktywowany, dostarczając informacji o roli danego genu w rozwoju.
Podobnie jak w przypadku hybrydyzacji in situ, immunofluorescencja (IF) pozwala również na określenie roli poszczególnych elementów komórki w rozwoju. Jednak w przeciwieństwie do hybrydyzacji in situ, immunofluorescencja wykorzystuje fluorofor przyłączony do przeciwciała z docelową biocząsteczką, taką jak białka, a nie sekwencje DNA i RNA. Pozwala na wizualizację elementów biomolekuł komórki. W badaniach embriogenezy immunofluorescencja może być wykorzystywana do celów podobnych do hybrydyzacji, do śledzenia białek biorących udział w rozwoju zarodka oraz ich specyficznego czasu i miejsca produkcji i użytkowania. Obecne badania rozszerzyły technikę immunofluorescencji, aby połączyć ją z metodami hybrydyzacji in situ, fluorescencyjnej lub radioaktywnej. Uważa się, że ta kombinacja zwiększa specyficzność i usuwa ograniczenia każdej indywidualnej techniki. Na przykład ta metoda ze wzmocnieniem barwienia kontrastowego w tkance i znakowaniem wielu białek.
Przeszczep komórek
Przeszczep komórek na wczesnych etapach rozwoju zarodka dostarczył kluczowych informacji na temat losów komórek i procesów determinacji. Wszczepienie w określonych stadiach neurulacji przyspieszyło badania nad sygnalizacją niezbędną do prawidłowego rozwoju płytki nerwowej i innych struktur. Przeszczep ektodermy i struktur nerwowych jest bardzo specjalistycznym i delikatnym zabiegiem, wymagającym usunięcia i oznaczenia pożądanej grupy komórek, a następnie ich przeszczepienia np. w nowe miejsce zarodka.
Eksperymenty z przeszczepami przeprowadzone na Xenopus i zarodkach kurzych wykazały zdolność płytki nerwowej do indukowania innych obszarów komórek, w tym obszaru przedplakodalnego, grupy komórek ektodermalnych niezbędnych do funkcjonowania narządów zmysłów.
Zobacz też
Bibliografia
Ten artykuł zawiera tekst w domenie publicznej z 20. edycji Gray's Anatomy (1918)