Reakcja Ramberga – Bäcklunda - Ramberg–Bäcklund reaction
| Reakcja Ramberga – Bäcklunda | |
|---|---|
| Nazwany po |
Ludwig Ramberg Birger Bäcklund |
| Typ reakcji | Reakcja przegrupowania |
| Identyfikatory | |
| Portal chemii organicznej | reakcja-ramberga-baecklunda |
| Identyfikator ontologii RSC | RXNO: 0000094 |
Reakcji Ramberg-Bäcklund jest organicznym reakcji przekształcania α-halo sulfonu w produkt alkenu , w obecności zasady, z wytłaczanie dwutlenku siarki . Nazwa reakcji pochodzi od nazwiska dwóch szwedzkich chemików Ludwiga Ramberga i Birgera Bäcklunda . Karbanion utworzony przez deprotonację daje niestabilny episulfon, który rozkłada się wraz z eliminacją dwutlenku siarki . Ten etap eliminacji jest uważany za skoordynowaną eliminację cykliczną.
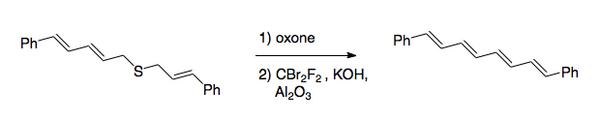
Cała przemiana polega na przekształceniu wiązań węgiel-siarka w podwójne wiązanie węgiel-węgiel. Oryginalna procedura obejmowała halogenowanie siarczku , a następnie utlenianie do sulfonu . Ostatnio preferowana metoda zmieniła kolejność kroków. Po utlenieniu , które zwykle przeprowadza się kwasem nadtlenowym , przeprowadza się halogenowanie w warunkach zasadowych przy użyciu dibromodifluorometanu na etapie przenoszenia halogenu. Metodę tę wykorzystano do syntezy 1,8-difenylo-1,3,5,7-oktatetraenu.
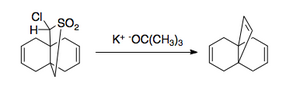
Reakcja Ramberga – Bäcklunda ma kilka zastosowań. Ze względu na charakter eliminacji można go nakładać na oba małe pierścienie,
i duże pierścienie zawierające podwójne wiązanie.
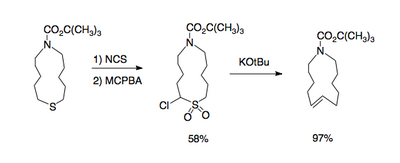
Niezbędne a-fluorowco-sulfony są dostępne przez utlenianie odpowiednich a-fluorowcosiarczków za pomocą nadkwasów, takich jak kwas meta -chloronadbenzoesowy ; utlenianie siarczków odbywa się selektywnie w obecności alkenów i alkoholi. Siarczki α-chlorowcowe można z kolei syntetyzować przez traktowanie siarczków elektrofilami halogenowymi, takimi jak N -chlorosukcynimid lub N -bromosukcynimid .
Grupa sulfonowa zawiera kwaśny proton w jednej z pozycji α, który jest oderwany przez mocną zasadę ( schemat 1 ). Ujemny ładunek umieszczony w tej pozycji (formalnie karbanion ) jest przenoszony do halogenu znajdującego się w drugiej pozycji α w nukleofilowym przemieszczeniu, tworząc tymczasowo trójczłonowy cykliczny sulfon. Ten półprodukt jest nietrwały i uwalnia dwutlenek siarki, tworząc alken. Zwykle otrzymuje się mieszaniny izomeru cis i izomeru trans.
Ten typ reakcji daje dostęp do 1,2-dimetylenocykloheksanu
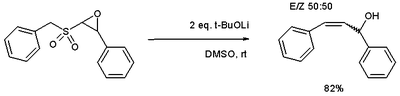
oraz zmienny dostęp epoksydów do alkoholi allilowych .
Przegrupowanie Favorskii i siarczek skurcz Eschenmoser są koncepcyjnie pokrewne reakcje.
Niedawno opracowanym zastosowaniem reakcji Ramberga – Bäcklunda jest synteza C- glikozydów. Wymagane tioetery można łatwo przygotować przez wymianę na tiol . Zastosowanie warunków Ramberga – Bäcklunda prowadzi następnie do egzocyklicznego eteru winylowego, który można zredukować do C-nukleozydu.
Bibliografia
- ^ Ramberg Ludwig ; Bäcklund, Birger (1940). „Reakcje niektórych monohalogenowych pochodnych dietylosulfonu”. Archiwa Chemii, Mineralogii i Geologii . 27 (13A): 1–50. ISSN 0365-3781 .
-
^ Chan, Tze-Lock; Fong, Sun; Li, Yu; Mężczyzna, Tim-On; Poon, Chi-Duen (1994). „Nowa jedna kolba reakcja Ramberga – Bäcklunda”. Journal of the Chemical Society, Chemical Communications (15): 1771–1772. doi : 10.1039 / C39940001771 .
Cao, Xiao-Ping (2002). „Stereoselektywna synteza podstawionych all- trans 1,3,5,7-oktatetraenów w zmodyfikowanej reakcji Ramberga-Bäcklunda”. Czworościan . 58 (7): 1301–1307. doi : 10.1016 / S0040-4020 (01) 01224-8 . - ^ Paquette, Leo A .; Philips, J. Christopher; Wingard, Robert E. (1971). "α-Halo sulfony. XVIII. Przegrupowanie Ramberga – Baecklunda jako syntetyczne wejście do nienasyconych propelanów". Dziennik Amerykańskiego Towarzystwa Chemicznego . 93 (18): 4516–4522. doi : 10.1021 / ja00747a029 .
- ^ Magee, DI; Beck, EJ (sierpień 2000). „Zastosowanie przegrupowania Ramberga-Bäcklunda do tworzenia aza-makrocyklów: całkowita synteza manzaminy C”. Canadian Journal of Chemistry . 78 (8): 1060–1066. doi : 10.1139 / v00-103 .
- ^ Böhme, Horst; Gran, Heinz-Joachim (12 lipca 1952). „Über die Einwirkung von Chlor auf Thioäther und Mercaptale” [O działaniu chloru na tioeter i merkaptale]. Justus Liebigs Annalen der Chemie (w języku niemieckim). 577 : 68–77. doi : 10.1002 / jlac.19525770109 .
- ^ Paquette, Leo A. (2005). „Przegrupowanie Ramberga – Bäcklunda”. Reakcje organiczne . 25 . s. 1–71. doi : 10.1002 / 0471264180. lub025.01 . ISBN 9780471264187 .
- ^ Block, Eric; Aslam, Mohammad (1987). „Ogólna syntetyczna metoda wytwarzania sprzężonych dienów z olefin przy użyciu bromku bromometanosulfonylu: 1,2-dimetylenocykloheksan” . Synteza organiczna . 65 : 90. doi : 10.15227 / orgsyn.065.0090 . ; Tom zbiorczy , 8 , s. 212
- ^ Evans, P .; Johnson, P .; Taylor, RJK (kwiecień 2006). „The Epoxy-Ramberg-Bäcklund Reaction (ERBR): A Sulfone-Based Method for the Synthesis Allylic Alcohols”. European Journal of Organic Chemistry . 2006 (7): 1740-1754. doi : 10.1002 / ejoc.200500956 .
- ^ Griffin, FK; Paterson, DE; Murphy, PV; Taylor, RJK (sierpień 2002). „ChemInform Streszczenie: nowa trasa do egzo -Glycals Korzystanie z Ramberg-Baecklund przegrupowania”. ChemInform . 33 (33): 1305. doi : 10.1002 / chin.200233219 .